相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、是重要的化工原料,可用于某些配合物的制备,如溶于氨水形成 , 下列有关的说法正确的是A、Ni元素处于元素周期表ds区 B、中键的数目为 C、中的键角大于中的键角 D、VA族元素单质的晶体类型相同
-
2、石灰氨()是一种氮肥,与土壤中的反应生成氰胺),氰胺可进一步转化为尿素。下列有关说法不正确的是A、是由极性键构成的极性分子 B、尿素中的碳原子的杂化类型为 C、属于有机化合物 D、1个分子中含3个键
-
3、北京冬奥会火种灯的外形设计灵感来自于西汉的“长信宫灯”。下列说法正确的是
 A、青铜的硬度小于纯铜 B、两灯实物如图所示,所用燃料均为烃 C、铝合金表面氧化物薄膜可保护内部金属不被腐蚀 D、镏金层破损后生成铜锈的主要成分为
A、青铜的硬度小于纯铜 B、两灯实物如图所示,所用燃料均为烃 C、铝合金表面氧化物薄膜可保护内部金属不被腐蚀 D、镏金层破损后生成铜锈的主要成分为 -
4、回答下列问题。(1)、现有常温下的盐酸(甲)和的醋酸溶液(乙),请根据下列操作回答:
①常温下,溶液加水稀释,下列数值一定变小的是(填字母)。
A. B. C. D.
②取10mL乙溶液,加入少量无水固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中的值将(填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲,乙两溶液,分别与溶液反应,消耗溶液的体积甲乙(填“”“”或“”)。
(2)、某温度下,测得的HCl溶液中,水电离出的 , 此温度下,将的HCl溶液和的溶液混合均匀(忽略混合后溶液体积的变化),测得溶液的 , 则。(3)、已知:在 , 有关弱电解质的电离平衡常数如下表有下表:弱电解质
电离常数
①将通入该氨水中,当降至时,溶液中的(精确值)。
②下列微粒在溶液中不能大量共存的是。
a.、 b.、 c.、 d.、
-
5、
(一)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于。某研究小组用溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。
Ⅰ.实验步骤
A.冷却至室温后,在100mL容量瓶中定容配成100mL白醋溶液。
B.量取20.00mL待测白醋溶液于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为标准溶液装入碱式滴定管,调节液面记下读数。如果液面位置如图所示,则此时的读数为___________mL。
E.继续滴定至终点,记下最终读数。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入标准溶液,边滴边摇动锥形瓶。
G.用干燥的酸式滴定管量取食用白醋样品10.00mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。

(1)以上步骤的正确顺序为___________ , ________,________(用编号字母填写)
(2)步骤D中的读数为________mL。
Ⅱ.实验记录
实验数据
滴定次数
1
2
3
4
V(样品)/mL
20.00
20.00
20.00
20.00
滴定前
0.00
0.10
0.20
1.00
滴定后
15.95
15.10
15.25
15.95
Ⅲ.数据处理与讨论
(3)按数据处理,市售白醋中醋酸的含量________(保留四位有效数字)。
(4)若测定结果偏低,其原因可能是___________。
A. 滴定过程中振摇时有液滴溅出 B. 滴定前仰视读数,滴定后读数正确 C. 盛装待测液的锥形瓶用蒸馏水洗过后未干燥 D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 Ⅳ.实验讨论:
(5)某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 , 则此时溶液中的________。(已知室温下醋酸的)。
(二)某同学欲利用下图装置及相关药品,完成酸碱中和反应反应热的测定实验。回答下列问题:
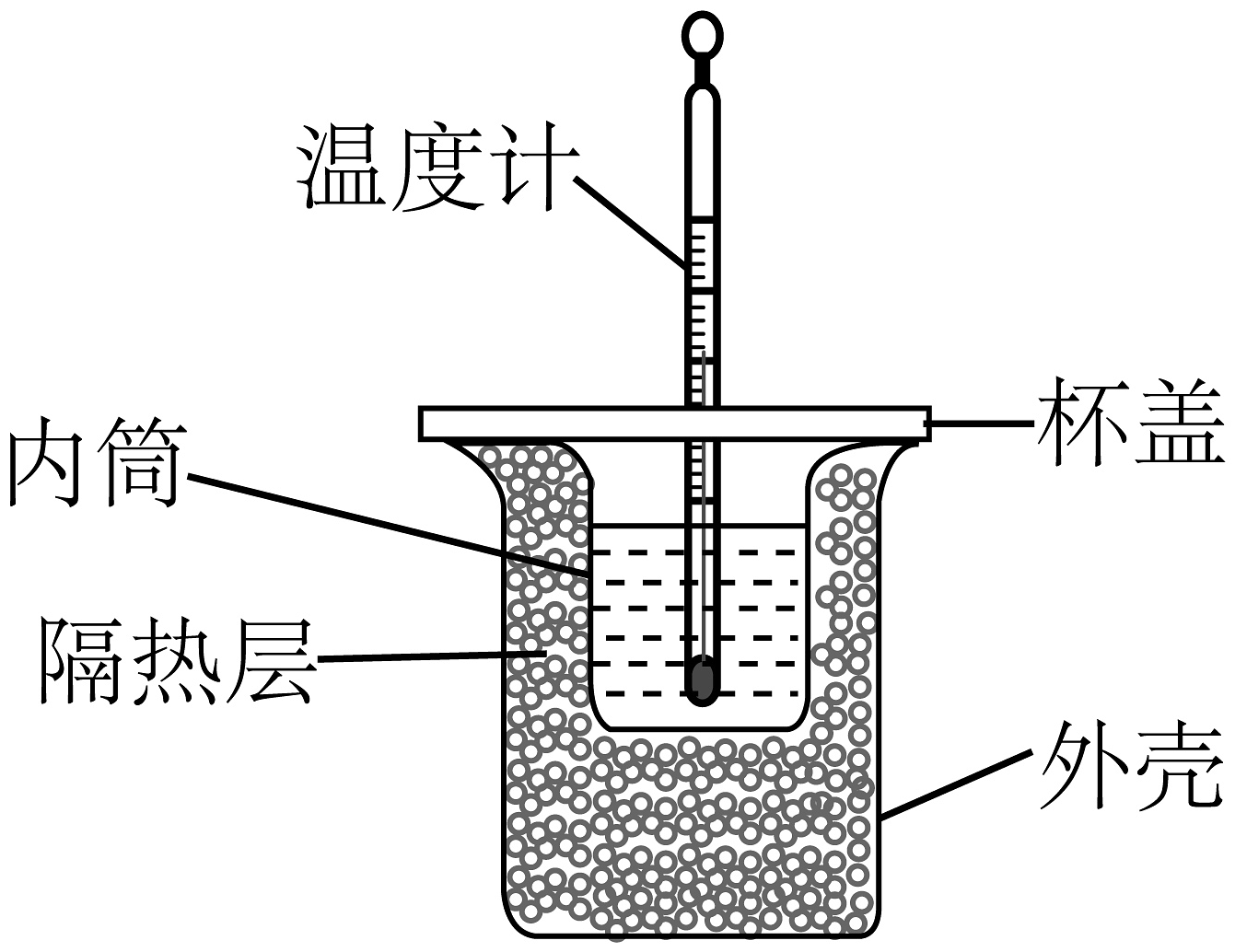
Ⅰ.配制的盐酸和的氢氧化钠溶液各250mL。
Ⅱ.测定中和反应的反应热
(6)该同学组装简易量热计需要的仪器还缺少的仪器是________。
(7)用组装好的仪器和配制好的溶液按要求测定中和反应的反应热,做四次平行实验(每次量取50mL盐酸和50mL氢氧化钠溶液)。
①四次平行实验所测的温度差数据如表所示,请填写下表中的空白:

起始温度
终止温度
温度差平均值
平均值
________
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②上述实验数值结果比正常值偏小,产生偏差的原因可能是________(填字母)。
A.实验装置保温,隔热效果差
B.量取溶液的体积时仰视读数
C.分多次把溶液倒入盛有盐酸的小烧杯中
D.用温度计测定溶液起始温度后直接测定盐酸的温度
(8)写出用稀盐酸和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为):________。
-
6、合成氨技术是人类科学技术领域的一大进步,合成氨工业的发展大大提高了粮食产量,促进了国民经济和国防工业的发展,也丰富了我国的能源结构。哈伯因此获得了诺贝尔化学奖,近年来,中国化学家也取得了重要突破。其反应原理: 。工业合成氨生产流程示意图如图:

回答下列问题:
(1)、合成氨反应在(填“高温”或“低温”)下能自发进行。(2)、“干燥净化”是为了除去原料气(、及少量的CO,的混合气)中的CO,高压,低温条件有利于醋酸亚铜氨溶液(含有、的溶液)更好地吸收CO,生成含的溶液,其原理为:(用离子方程式解释),吸收CO后的溶液经过加热,减压处理能再生,恢复其吸收CO的能力,可循环使用。(3)、流程中“干燥净化”除去原料气中CO的作用是:;“冷却”分离X的目的是:。(4)、工业上和混合气反应后经过图1中的过程再及时补充和进入合成塔反应,以一定量的和为研究对象,计算转化率时不考虑新补充进入的和 , 循环过程中转化率随温度变化曲线如图所示,图中所示进程中表示热交换过程的是。
A. B. C. D.
E. F. G. H.
(5)、某化学小组利用虚拟仿真软件模拟合成氨的反应。一定温度下,在容积固定为1L的密闭容器内充入和发生反应。①下列能说明反应已达到平衡状态的是(填字母标号)。
a.容器内的压强保持不变 b.反应停止,正、逆反应的速率都等于零
c.、、的浓度之比为 d.混合气体的平均摩尔质量不再变化
e.气体的密度不再发生改变 f.断裂键的同时生成键
②已知 , 、表示组分的分压(分压总压物质的量分数)。反应达到平衡时, , 此时的转化率为80%。通过上述信息可知:。
-
7、研究金属腐蚀和防护的原理很有现实意义。(1)、下图为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有(填序号)。

A.用纯氧气代替具支试管内空气 B.用酒精灯加热具支试管提高温度
C.将铁钉换成铁粉和碳粉混合粉末
(2)、该小组将上图装置改进成下图装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐(填“加快”“减慢”或“不变”)。
时间/min
1
3
5
7
9
液柱高度/cm
0.8
2.1
3.0
3.7
4.2
(3)、为探究(2)题图中a、b两点所发生的反应,进行以下实验,请完成表中空白:实验操作
实验现象
向NaCl溶液中滴加2~3滴酚酞溶液
a点附近溶液出现红色
一段时间后再滴加2~3滴铁氰化钾溶液
b点周围出现蓝色沉淀
根据以上实验探究,试判断(填a或b)为负极,该点腐蚀更严重。
(4)、设计下左图装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内压强和空气中氧气的体积分数随时间变化如图丁所示,从下右图中可分析,之间主要发生(填“吸氧”或“析氢”)腐蚀,原因是。 (5)、金属阳极钝化是一种电化学防护方法。将Fe作阳极置于溶液中,一定条件下,Fe钝化形成致密氧化膜,试写出该阳极的电极反应式。
(5)、金属阳极钝化是一种电化学防护方法。将Fe作阳极置于溶液中,一定条件下,Fe钝化形成致密氧化膜,试写出该阳极的电极反应式。 -
8、回答下列问题:(1)、甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水放出热量222.5kJ,则表示甲烷燃烧热的热化学方程式为。(2)、查阅文献资料,化学键的键能如下表:
化学键
键
键
键
436
946
391
氨分解反应的活化能 , 则合成氨反应的活化能。
(3)、研究氮氧化物与悬浮的大气中海盐粒子的相互作用时,涉及如下反应:Ⅰ.
Ⅱ.
则反应的(用、表示)。
(4)、写出氢硫酸的第二步电离平衡常数表达式。(5)、298K时,将 , 和溶液混合(混合后溶液的体积变化忽略不计),发生反应:。溶液中与反应时间(t)的关系如图所示。
若平衡时溶液的 , 则该反应的平衡常数K为。
-
9、根据下列实验操作,预测的实验现象和实验结论或解释不正确的是
实验操作
预测实验现象
实验结论或解释
A
相同温度下,同时向①酸性溶液②酸性溶液中分别加入溶液
②中溶液先褪色
该实验条件下,浓度越大,反应速率越快
B
将的氨水稀释为 , 测量稀释前后溶液pH
稀释后pH减小不到1
稀释后氨水的电离程度增大
C
白铁皮(镀锌铁)出现刮痕后浸泡在经过酸化的3%食盐水中,一段时间后滴入几滴溶液
无明显现象
不能说明该过程未发生原电池反应
D
 分别测定和蒸馏水的电导率
分别测定和蒸馏水的电导率蒸馏水的电导率大于的
温度升高,平衡正移
A、A B、B C、C D、D -
10、如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
 A、a极连接外接电源的负极 B、电解过程中Na+从右池移向左池 C、b极的电极反应式为Cl--2e-+H2O=ClO-+2H+ D、外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
A、a极连接外接电源的负极 B、电解过程中Na+从右池移向左池 C、b极的电极反应式为Cl--2e-+H2O=ClO-+2H+ D、外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L -
11、某小组实验验证“”为可逆反应,并通过测定浓度计算其平衡常数。
实验Ⅰ.将溶液和溶液等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ.将少量粉中与溶液混合,固体完全溶解。
下列说法错误的是
A、Ⅰ中反应的平衡常数 B、实验Ⅰ、Ⅱ说明为可逆反应 C、通过测定实验Ⅱ清液中的浓度计算其平衡常数 D、实验Ⅱ中,不宜用溶液代替溶液 -
12、微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法正确的是
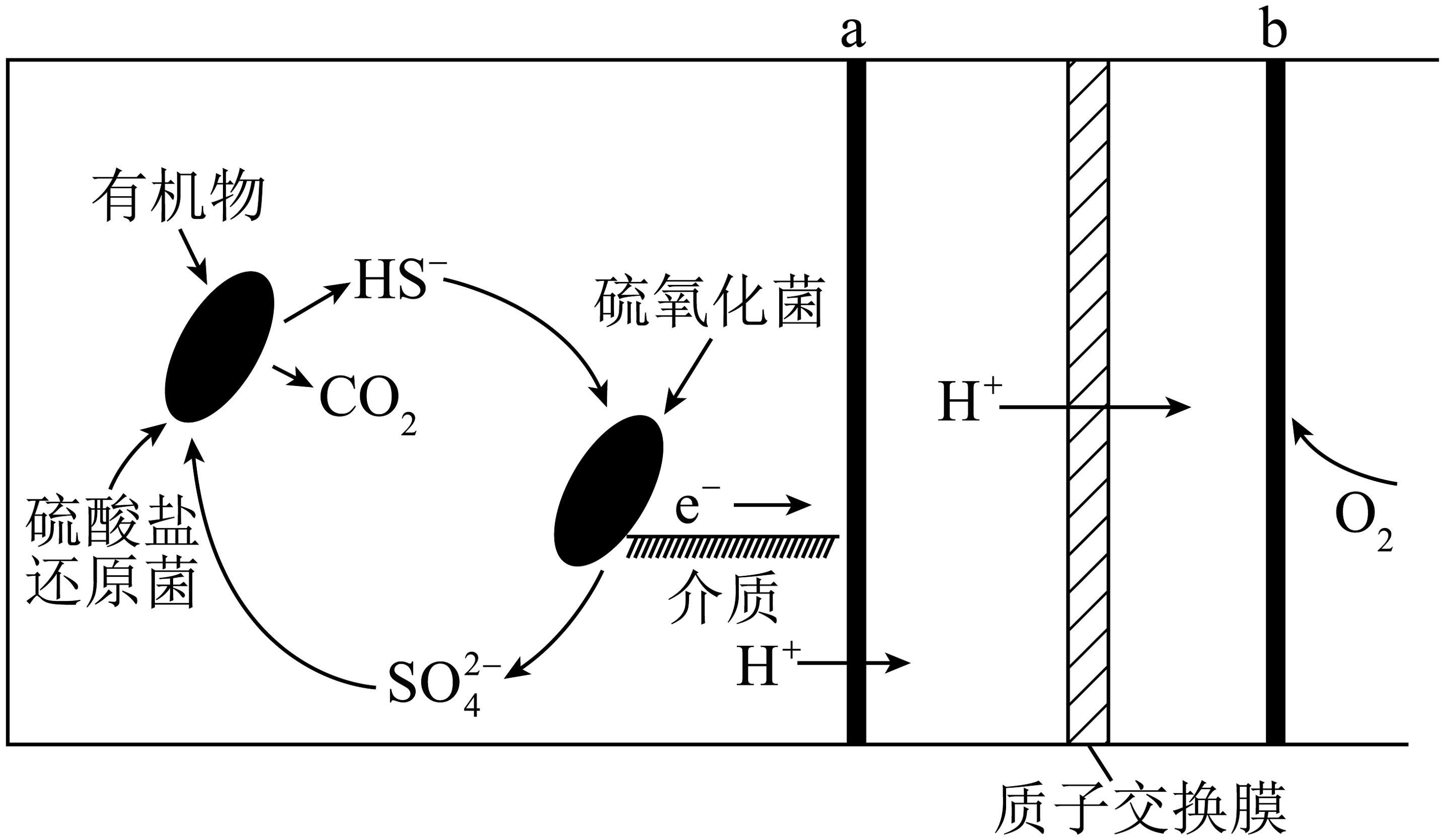 A、若该电池电路中有0.4mol电子发生转移,则有通过质子交换膜 B、该电池在高温条件下效率更高 C、如果将反应物直接燃烧,能量的利用率不会变化 D、在硫氧化菌作用下转化为的反应式:
A、若该电池电路中有0.4mol电子发生转移,则有通过质子交换膜 B、该电池在高温条件下效率更高 C、如果将反应物直接燃烧,能量的利用率不会变化 D、在硫氧化菌作用下转化为的反应式: -
13、时,下列说法不正确的是A、氢硫酸的电离平衡常数为: , 。氢硫酸中: B、pH相等的盐酸、溶液, , C、的番茄汁中是的牛奶中的倍 D、的溶液加水稀释至 , 稀释后溶液体积大于原溶液体积的10倍
-
14、普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜( 阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是
 A、电极a为粗铜,电极b为精铜 B、甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 C、乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 D、当电路中通过1mol电子时,可生成32g精铜
A、电极a为粗铜,电极b为精铜 B、甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 C、乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 D、当电路中通过1mol电子时,可生成32g精铜 -
15、受热分解是实验室制取氧气的一种方法。受热分解的能量变化如图所示。实验测得第一放热峰温度为 , 第二放热峰温度为。下列说法正确的是
 A、 B、时热分解的产物是KCl和 C、若用作催化剂热分解温度大于 D、曲线Ⅰ的活化能大于曲线Ⅱ,所以比稳定
A、 B、时热分解的产物是KCl和 C、若用作催化剂热分解温度大于 D、曲线Ⅰ的活化能大于曲线Ⅱ,所以比稳定 -
16、我国科研工作者研究与作用最终生成与的物质相对能量-反应进程曲线如下图,下列叙述不正确的是
 A、该反应过程中是催化剂 B、中间体比更稳定 C、该反应进程中的最大能垒(活化能)为 D、总反应的热化学方程式:
A、该反应过程中是催化剂 B、中间体比更稳定 C、该反应进程中的最大能垒(活化能)为 D、总反应的热化学方程式: -
17、铅蓄电池、镍镉碱性充电电池都是重要的二次电池。已知:铅蓄电池总的化学方程式为:;镍镉碱性充电电池放电时,正极反应为: , 负极反应式:。下列有关说法不正确的是A、放电时,在两个电极上生成 B、若用铅蓄电池为镍镉电池充电,则电极与电极相连接且两者的值均增大 C、镍镉碱性充电电池在充电时的反应为 D、放电一段时间后铅蓄电池其内阻明显增大,镍镉碱性电池内阻几乎不变
-
18、“中国芯”的主要原料是单晶硅,“精炼硅”反应历程中的能量变化如下图所示。下列有关描述正确的是
 A、历程Ⅰ,Ⅲ都是放热反应 B、历程Ⅱ的热化学方程式是: C、历程Ⅲ的热化学方程式是: D、实际工业生产中,粗硅变为精硅的过程中能量不损耗
A、历程Ⅰ,Ⅲ都是放热反应 B、历程Ⅱ的热化学方程式是: C、历程Ⅲ的热化学方程式是: D、实际工业生产中,粗硅变为精硅的过程中能量不损耗 -
19、下列有关电化学的装置与阐述正确的是
 A、图甲:负极的电极反应式为 B、图乙中A极为阳极,B极为阴极 C、图丙中高硅铸铁作为耗损阳极材料发挥作用 D、图丁是模仿氯碱工业验证溶液(含酚酞)的电解产物
A、图甲:负极的电极反应式为 B、图乙中A极为阳极,B极为阴极 C、图丙中高硅铸铁作为耗损阳极材料发挥作用 D、图丁是模仿氯碱工业验证溶液(含酚酞)的电解产物 -
20、下列事实不能用勒夏特列原理解释的有
①新制的氯水放置一段时间,溶液的pH会减小
②在配制硫酸亚铁溶液时往往要加入少量铁粉
③恒容容器中反应 达到平衡后,升高温度,气体颜色变深
④增大压强,有利于与反应生成
⑤检验:取少量待测液于试管中,加入浓溶液,加热,将湿润的红色石蕊试纸放在试管口
⑥除去中的:用酸性溶液洗气
⑦将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
⑧乙醇与乙酸反应制备乙酸乙酯时常加入稍过量的乙醇
A、3个 B、4个 C、5个 D、6个