相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、明代诗人于谦的《石灰吟》是一首托物言志诗。下列反应类型与诗句“千锤万凿出深山,烈火焚烧若等闲”没有关联的是A、吸热反应 B、复分解反应 C、分解反应 D、熵增反应
-
2、某化学学习小组测定草酸晶体()的纯度,方法如下:
步骤I:用托盘天平称取草酸晶体样品10.0g,配制成250mL溶液;
步骤Ⅱ:每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定。
数据记录如下:
(已知:①在酸性环境下的还原产物是;②草酸是二元弱酸)
滴定次数
溶液起始读数/mL
溶液终点读数/mL
消耗溶液/mL
第一次
0.00
24.03
第二次
1.00
24.97
第三次
a
(1)、上述溶液与酸性溶液反应的离子方程式为。(2)、滴定时,将酸性标准液装在如图中的中(填“甲”或“乙”)滴定管中;第三次滴定时,若滴定开始和结束时,滴定管中的液面如图所示,则。
 (3)、滴定终点的现象为。(4)、草酸晶体的纯度为。(5)、标准溶液滴定样品溶液前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→___→___→排除滴定管中气泡→___→___→开始滴定;。
(3)、滴定终点的现象为。(4)、草酸晶体的纯度为。(5)、标准溶液滴定样品溶液前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→___→___→排除滴定管中气泡→___→___→开始滴定;。a.用标准溶液润洗2至3次 b.记录起始读数
c.调整标准液液面至零刻度或零刻度以下 d.装入标准液至碱式滴定管零刻度以上
e.装入标准液至酸式滴定管零刻度以上 f.用草酸溶液润洗2至3次
(6)、下列操作中可能使所测草酸晶体纯度偏低的是___________(填字母)。A、滴定管未用标准液润洗就直接注入标准液 B、读取标准液时,开始仰视读数,滴定结束时俯视读数 C、滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡 D、滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 -
3、研究之间的转化具有重要意义。(1)、已知: , 将一定量气体充入恒容的密闭容器中,控制反应温度为。
①该反应自发的条件是。
②下列可以作为反应达到平衡的判据是。
A.气体的压强不变 B. C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
③在恒温恒压(压强为p)容器中加入 , 经过t min反应达到平衡,气体的平衡转化率为75%,则该反应的平衡常数(无需带单位,用含p的式子表示)。
已知:对于气相反应,用组分B的平衡压强p(B)代替物质的量浓度c(B)也可以表示平衡常数作 , 如 , p为平衡压强,为平衡系统中B的物质的量分数。
④在温度为、时,平衡体系中的体积分数随压强变化曲线如图所示。

由状态B到状态A,可以选择方法是(填“升高”或“降低”)温度。比较A、C两点气体的颜色,A比C(填“深”、“浅”或“一样”)。
(2)、NO氧化反应:分两步进行,其反应过程能量变化示意图如图。I:
II:

在恒容的密闭容器中充入一定量的NO和气体,保持其它条件不变,控制反应温度分别为和(),测得随t(时间)的变化曲线如下图。转化相同量的NO,在温度(填“”或“”)下消耗的时间较长,试结合反应过程能量图分析其原因。

-
4、工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。(1)、工业合成氨反应为: , 下列说法正确的是___________。A、采用高温以提高反应的平衡转化率 B、采用高压以加快反应速率,提高的产量 C、为提高转化率,可适当增大的浓度 D、生产过程中将液化分离,有利于氨的合成(2)、水体中氨氮处理:在微生物作用下,废水中经两步反应被氧化成:
则全部氧化成的热化学方程式是。
(3)、利用反应构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,B电极的电极反应式为。 (4)、肼()是一种二元弱碱,在水中的电离方式与相似。盐酸肼()属于离子化合物,易溶于水,溶液呈酸性,水解原理与类似。
(4)、肼()是一种二元弱碱,在水中的电离方式与相似。盐酸肼()属于离子化合物,易溶于水,溶液呈酸性,水解原理与类似。①盐酸肼第一步水解反应的离子方程式。
②盐酸肼水溶液中离子浓度的排列顺序正确的是(选填编号)
A.
B.
C.
D.
-
5、物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,根据所学知识回答下列问题:(1)、下列方法中,可以使溶液中值增大的措施是(填序号)。
a.加水稀释 b.加入少量固体 c.加少量烧碱溶液
(2)、常温下,将的某酸HA溶液和的NaOH溶液等体积混合后,混合溶液的。由此可知,酸HA是(填“强”或“弱”)酸,该混合溶液中mol/L(填数值)。(3)、25℃下,有浓度均为0.1mol/L的三种溶液;a.;b.NaClO;c.。(已知25℃时电离常数: , , HClO , )①25℃时,相同浓度的、、结合的能力由强到弱的顺序为。
②溶液a的pH大于8,则溶液中(填“”、“”或“”)。
③计算溶液c的。(已知)
-
6、根据下列实验操作,其现象和结论均正确的是
选项
实验操作
现象
结论
A
取两份新制氯水,分别滴加溶液和淀粉KI溶液
前者有白色沉淀,后者溶液变蓝色
氯气与水的反应存在限度
B
向溶液中先滴加4滴0.1mol/L KCl溶液,再滴加4滴0.1mol/L KI溶液
先产生白色沉淀,再产生黄色沉淀
C
将充满的密闭玻璃球浸泡在热水中
玻璃球中红棕色加深
反应的
D
在KSCN与的混合液中再加入KCl固体
溶液红色变浅
增大生成物浓度,平衡逆向移动
A、A B、B C、C D、D -
7、温度为T℃时,向体积不等的恒容密闭容器中均充入1mol气体X,发生反应:X(g) Y(g)+Z(g) ΔH,反应相同时间,测得各容器中X的转化率与容器体积的关系如图所示。下列说法正确的是
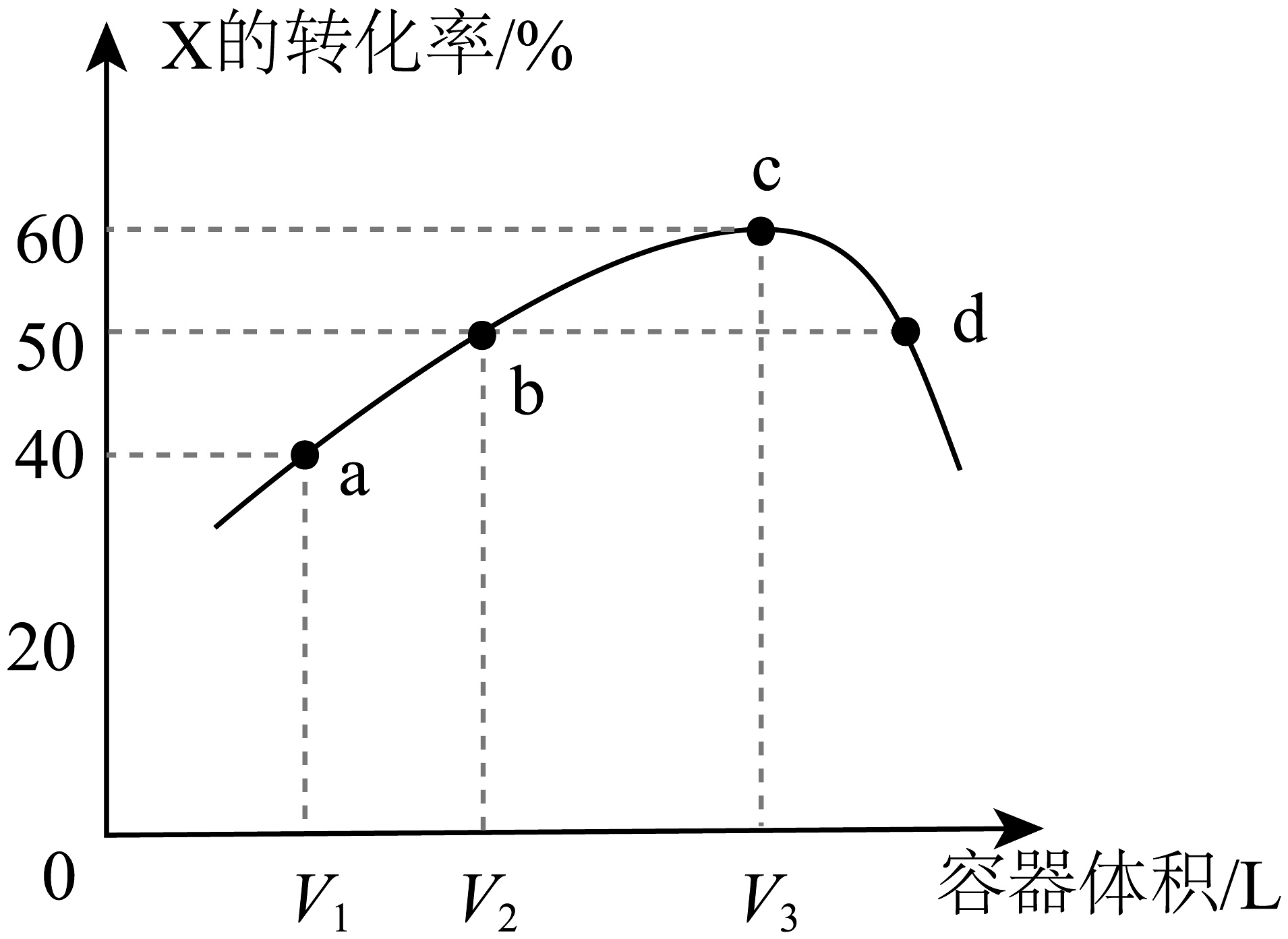 A、a点对应X的平衡转化率大于40% B、b、c两点V2:V3=5:9 C、d点有v正=v逆 D、正反应速率v(b)=v(d)
A、a点对应X的平衡转化率大于40% B、b、c两点V2:V3=5:9 C、d点有v正=v逆 D、正反应速率v(b)=v(d) -
8、常温下,乙二酸()在不同pH环境中的不同形态的粒子分布系数如图所示,下列说法错误的是
 A、该温度下,溶液的pH小于7 B、b点对应溶液的pH约为2.79 C、将等物质的量的和溶于水可得到c点溶液 D、a、b、c三点对应溶液中,水的电离程度最大的为c点
A、该温度下,溶液的pH小于7 B、b点对应溶液的pH约为2.79 C、将等物质的量的和溶于水可得到c点溶液 D、a、b、c三点对应溶液中,水的电离程度最大的为c点 -
9、常温时,某酸HA的 , 醋酸的。下列说法正确的是A、相同温度下,等pH的NaA和溶液中, B、将浓度均为0.10mol/L的NaA和NaOH溶液加热,两种溶液的pH均变大 C、常温时,HA溶液与NaOH溶液混合,测得 , 则此时溶液中 D、常温时,0.10mol/L的HA溶液中加少量NaA固体,水的电离程度变小
-
10、以四甲基氯化铵[]的水溶液为原料,通过电解法可以制备四甲基氢氧化铵[]装置如图所示。下列说法不正确的是
 A、阳极发生氧化反应生成氯气 B、溶液从a处进,NaOH溶液从d处出 C、该离子交换膜为阳离子交换膜 D、电解总反应:
A、阳极发生氧化反应生成氯气 B、溶液从a处进,NaOH溶液从d处出 C、该离子交换膜为阳离子交换膜 D、电解总反应: -
11、漂白液常用于杀菌消毒,其有效成分是NaClO,现取100mL漂白液暴露在空气中足够长时间(体积变化忽略不计)。已知:的 , , HClO的。下列说法正确的是A、漂白液的碱性增强 B、发生反应: C、溶液中一定增大 D、为了测定原漂白液的pH值,用洁净的玻璃棒蘸取漂白液滴在pH试纸上,待变色后与标准比色卡对照
-
12、下列反应的离子方程式表述不正确的是A、氯化铝溶液与过量浓氨水混合: B、碳酸氢钠在水溶液中电离: C、硫酸铜遇到难溶的PbS,慢慢转变为铜蓝(CuS): D、亚硫酸氢钠的水解:
-
13、工业上常用接触法制备硫酸,其中关键步是:SO2在V2O5催化作用下与空气中O2在接触室发生可逆反应,其热化学方程式为:2SO2(g)+O2(g)2SO3(g) ΔH=-196kJ·mol-1。下列关于SO2催化氧化生成SO3的能量角度,有关说法正确的是A、反应物总能量小于生成物总能量 B、反应物键能总和大于生成物键能总和 C、V2O5的使用降低了该反应的焓变 D、反应消耗1mol SO2时放出热量为98 kJ
-
14、下列事实能用勒夏特列原理解释的是A、热的纯碱溶液去污能力更强 B、已知工业合成氨是放热反应,反应条件选择高温 C、催化氧化时,使用催化剂加快化学反应速率 D、 , 平衡后压缩容器,体系颜色加深
-
15、常温下,某浓度溶液的 , 其中水电离的为A、 B、 C、 D、无法确定
-
16、下列属于放热反应的是A、浓硫酸溶于水放热 B、盐酸与碳酸氢钠反应 C、Al与氧化铁反应 D、和反应
-
17、下列溶液一定显碱性的是A、能与硫酸反应的溶液 B、滴加甲基橙显黄色的溶液 C、的溶液 D、的溶液
-
18、下列物质中属于弱电解质的是A、 B、 C、 D、
-
19、二氧化碳催化加氢制甲醇有利于减少温室气体排放。涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
(1)、 , 该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是(填标号)。A.
 B.
B.
C.
 D.
D. (2)、一定条件下,恒容密闭容器中和发生上述反应。下列说法正确的是________A、当混合气体密度不变时说明体系达到平衡状态 B、反应达到平衡状态后通入氦气,体系压强增大,反应速率不变,平衡不移动 C、使用高效催化剂,可提高甲醇的生产效率,但不能改变甲醇的平衡产率 D、实际生产中温度越低越有利于甲醇的合成(3)、不同压强下,按照投料,实验测得的平衡转化率和的平衡产率随温度的变化关系如下图所示。
(2)、一定条件下,恒容密闭容器中和发生上述反应。下列说法正确的是________A、当混合气体密度不变时说明体系达到平衡状态 B、反应达到平衡状态后通入氦气,体系压强增大,反应速率不变,平衡不移动 C、使用高效催化剂,可提高甲醇的生产效率,但不能改变甲醇的平衡产率 D、实际生产中温度越低越有利于甲醇的合成(3)、不同压强下,按照投料,实验测得的平衡转化率和的平衡产率随温度的变化关系如下图所示。
已知:的平衡转化率 , 的平衡产率其中纵坐标表示平衡转化率的是图(填“甲”或“乙”),压强、、由大到小的顺序为 , 图乙中温度时,三条曲线几乎交于一点的原因是。
(4)、一定条件下,向体积为1L的恒容密闭容器中通入1mol和3mol发生上述反应,经10分钟达到平衡,此时的转化率为80%,且体系中。的平均反应速率 , 反应Ⅱ的平衡常数。(5)、我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
写出该历程中决速步骤的化学方程式:。
-
20、
某学习小组为了探究一定温度下(简写为HAc)电离平衡的影响因素,进行了如下实验。
Ⅰ.【实验一】测定HAc的浓度。
(1)用(填仪器名称)准确移取20.00mL HAc溶液,转移至锥形瓶,加入2滴。(填“酚酞”“石蕊”或“甲基橙”)作指示剂,用0.1000mol/L NaOH溶液滴定,平行测定4次,消耗NaOH溶液的体积分别为20.05mL、20.00mL、18.40mL、19.95mL,则。
(2)①实验操作中,滴定管盛装NaOH溶液后排气泡动作正确的是(填字母,下同)。
A.
 B.
B.  C.
C.
②下列有关实验操作的说法错误的是。
A.锥形瓶盛装HAc溶液前未干燥,对测定结果无影响
B.滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视滴定管中的液面变化
C.滴定前仰视读数,滴定后读数正确,测得醋酸浓度偏低
D.接近终点时,改为滴加半滴NaOH溶液,溶液出现颜色变化,即达到滴定终点
(3)滴定醋酸溶液的过程中:
①时,溶液 , 则其中离子浓度由大到小的顺序为。
②当时,溶液pH7(填“”、“”或“”)。
Ⅱ.【实验二】探究25℃下HAc电离平衡的影响因素。
将实验一中的HAc溶液和与其等浓度的(简写为NaAc)溶液按一定体积比混合,测pH。
序号
pH
Ⅰ
40.00
/
0
2.86
Ⅱ
4.00
a
b
0
3.36
Ⅶ
4.00
c
d
4.53
Ⅷ
4.00
4.00
32.00
4.65
(4)根据表中信息,补充数据: , 。
(5)对比实验Ⅰ和Ⅱ可得结论:稀释HAc溶液,电离平衡正向移动;结合表中数据,给出判断理由:;由实验Ⅱ~Ⅷ可知,增大浓度,HAc电离平衡向移动(填“正”、“逆”)。
(6)25℃时,醋酸;次氯酸;碳酸 , ;亚硫酸 , 。、、和中结合能力最强的是。往NaClO溶液中通入少量 , 离子方程式为:。