相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、
Ⅰ.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如表,请回答下列问题。
实验
编号
反应
温度
加入0.1mol/L
Na2S2O3溶液的体积
加入0.1mol/L
硫酸溶液的体积
加入水
的体积
出现浑浊
的时间
℃
mL
mL
mL
s
①
20
2
2
0
t1
②
40
2
V1
0
t2
③
20
1
2
V2
t3
(1)实验①②研究的是对化学反应速率的影响,V1=。
(2)实验①③研究的是对化学反应速率的影响,V2=。
(3) t1、t2、t3由大到小的顺序是。
Ⅱ.某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示:

(4)由图中所给数据进行分析,该反应的化学方程式为。
(5)若上述反应中X、Y、Z分别为H2、N2、NH3 , 某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2 , 一段时间后反应达平衡状态,实验数据如表所示:
t/s
0
50
150
250
350
n(NH3)/mol
0
0.24
0.36
0.40
0.40
50—150s内的平均反应速率v(N2)= 。
(6)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A (g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中ΔH=。反应达到(5)中的平衡状态时,对应的能量变化的数值为kJ。
(7)为加快反应速率,可以采取的措施是。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
-
2、
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以和为原料合成尿素的反应为: , 该反应为放热反应。
(1)上述反应中,有利于提高平衡转化率的措施是_______(填序号)。
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压 (2)研究发现,合成尿素反应分两步完成,其能量变化如图所示:

第一步:
第二步:
①合成尿素总反应的热化学方程式为________。
②第一步反应速率较快的理由是________。
Ⅱ.以和催化重整制备合成气: , 在密闭容器中通入物质的量均为的和在一定条件下发生反应: , 的平衡转化率随温度、压强的变化关系如图所示。
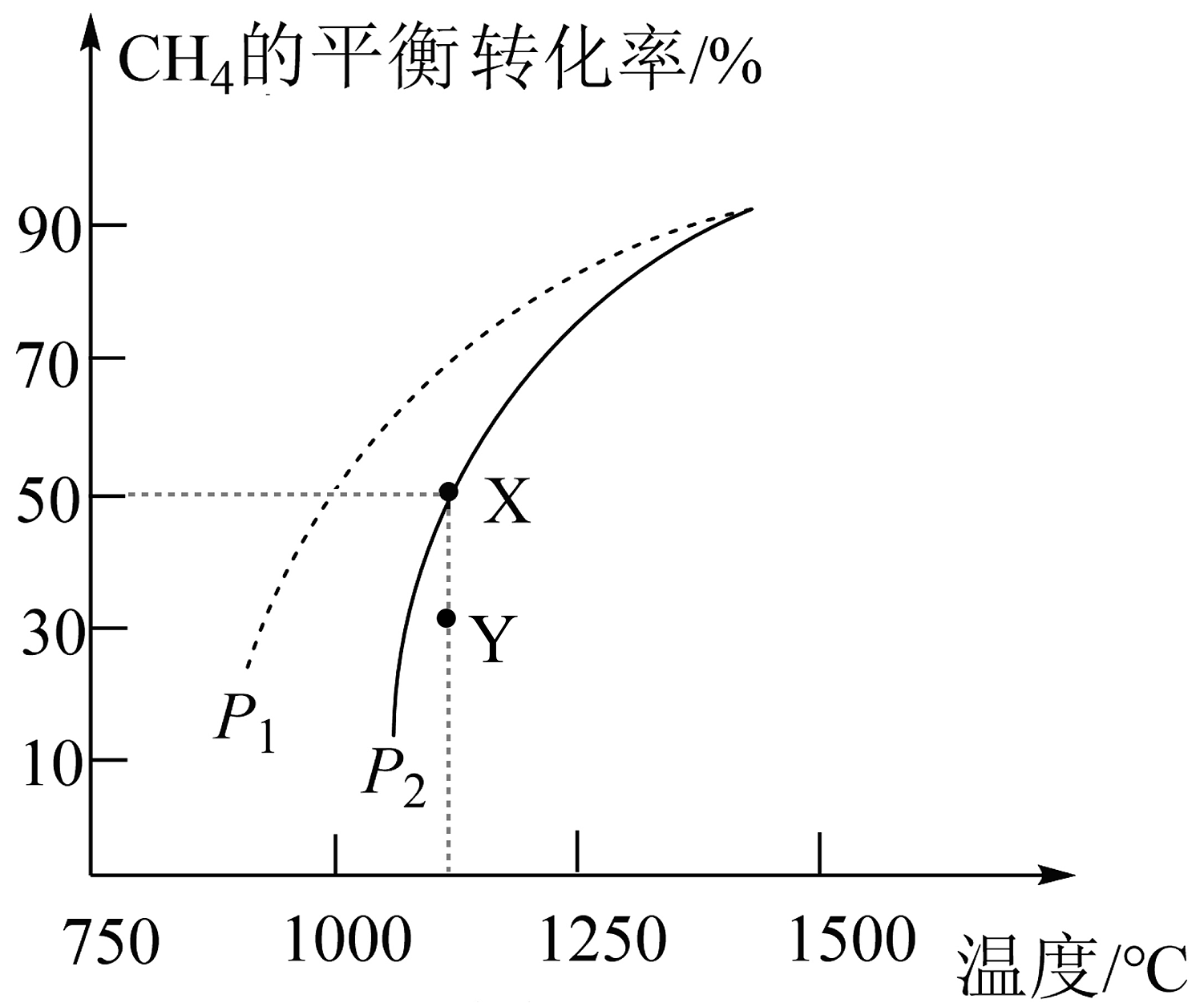
(3)若反应在恒温、恒容密闭容器中进行,能说明反应到达平衡状态的是_______(填序号)。
A. 反应速率: B. 同时断裂键和键 C. 容器内混合气体的压强保持不变 D. 容器中混合气体的密度保持不变 (4)由图可知,Y点速率________(填“>”、“<”或“=”,下同);容器内压强________。
-
3、一种储能电池的工作原理如下图所示。下列说法正确的是
 A、放电时电子由多孔碳流向电极 B、放电时多孔碳电极反应: C、储能时电极发生氧化反应 D、储能时总反应
A、放电时电子由多孔碳流向电极 B、放电时多孔碳电极反应: C、储能时电极发生氧化反应 D、储能时总反应 -
4、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
工业用电解熔融NaCl制备金属钠
金属钠的还原性很强
B
装有NO2的密闭烧瓶冷却后颜色变浅
NO2转化为N2O4的反应吸热
C
高温,高压下,H2和N2在催化剂作用下合成氨
升高温度、增大压强均可使反应物分子中活化分子的百分数增加
D
1 mol/LNaCl溶液导电性比同浓度醋酸强
NaCl溶液的pH比醋酸的高
A、A B、B C、C D、D -
5、可活化制得 , 其反应历程如下图所示:下列说法不正确的是
 A、总反应为 B、总反应的速率由“中间体2→中间体3”决定 C、选用高效催化剂、可以降低反应的 D、降低温度可增大乙烷的平衡转化率
A、总反应为 B、总反应的速率由“中间体2→中间体3”决定 C、选用高效催化剂、可以降低反应的 D、降低温度可增大乙烷的平衡转化率 -
6、在反应中,表示反应速率最快的是A、 mol⋅L-1⋅min-1 B、 mol⋅L-1⋅min-1 C、 mol⋅L-1⋅s-1 D、 mol⋅L-1⋅min-1
-
7、在蒸发皿中蒸干并灼烧下列溶液,可以获得原溶液溶质固体的是A、溶液 B、溶液 C、溶液 D、溶液
-
8、常温下用0.1000 mol∙L−1盐酸滴定25mL0.1000 mol∙L−1Na2CO3溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法正确的是
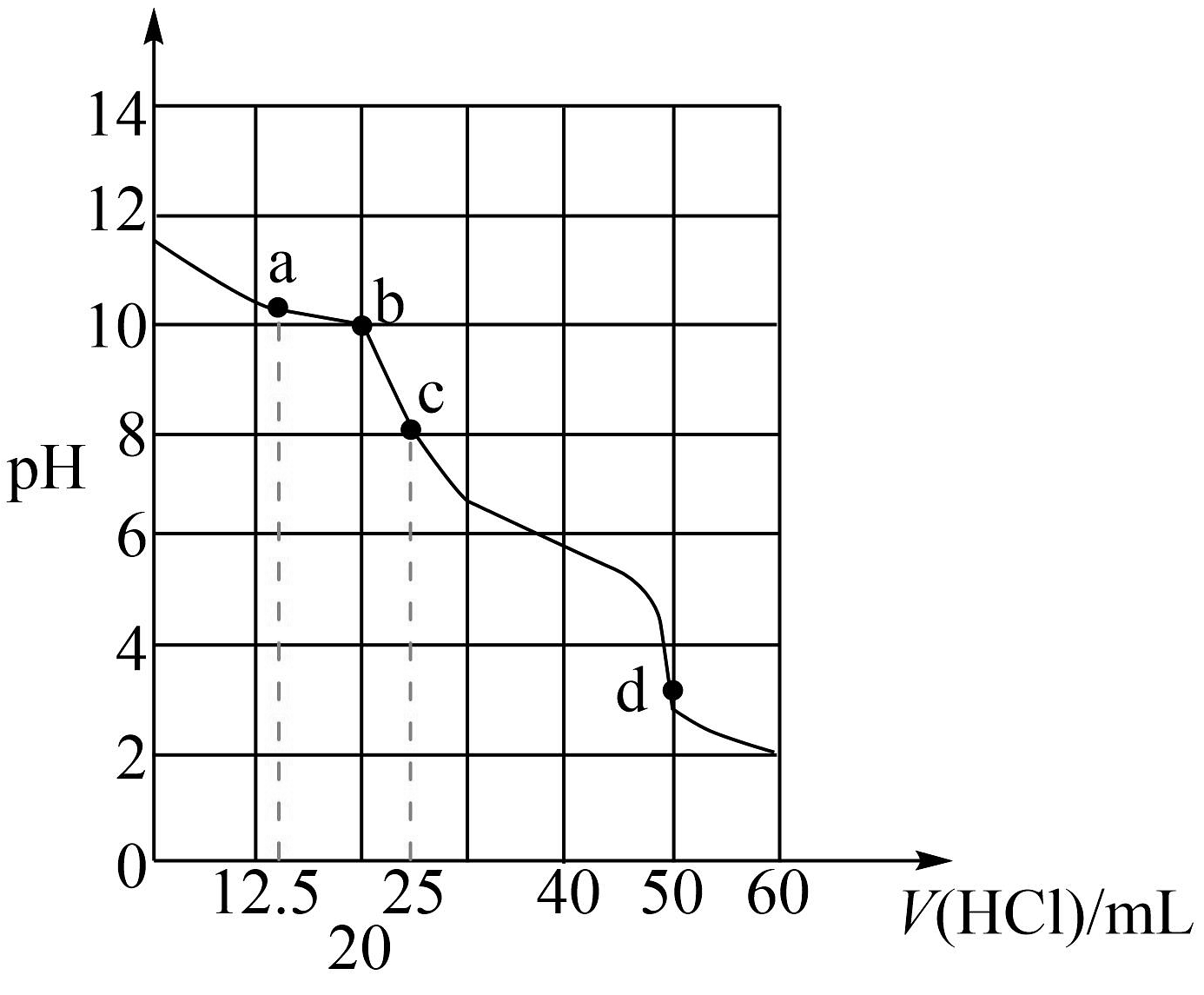 A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-)
A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-) -
9、在一定温度下的恒容密闭容器中,当下列各项不再发生变化时,表明反应已经达到化学平衡状态的有
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤
⑥与的比值为2:1
⑦单位时间内生成的同时生成的B
⑧混合气体的平均相对分子质量
A、②③⑦⑧ B、①③④⑦ C、③⑥⑦⑧ D、①③⑥⑧ -
10、下列应用中涉及到氧化还原反应的是A、用生铁炼钢 B、用活性炭除去冰箱中的异味 C、用热碱水清洗餐具上残留的油污 D、用食醋除去热水壶内壁的水垢
-
11、NbO的立方晶胞如图,晶胞参数为anm,P的分数坐标为(0,0,0),阿伏加德罗常数的值M为NA , 下列说法正确的是
 A、Nb的配位数是6 B、Nb和O最短距离为anm C、晶体密度 D、M的分数坐标为
A、Nb的配位数是6 B、Nb和O最短距离为anm C、晶体密度 D、M的分数坐标为 -
12、某新材料阳离子为W36X18Y2Z6M+。W、X、Y、Z和M是原子序数依次增大的前20号主族元素,前四周期中M原子半径最大,X、Y、Z同周期。X6W6分子含有大π键(),XZ2分子呈直线形。下列说法正确的是A、WYZ2是强酸 B、MZW是强碱 C、M2Z2是共价化合物 D、X2W2是离子化合物
-
13、蛇孢菌素(X)是一种具有抗癌活性的天然植物毒素。下列关于X说法正确的是
 A、含有4种官能团,8个手性碳原子 B、1mol X最多可以和3mol H2发生加成反应 C、只有1种消去产物 D、可与新制的Cu(OH)2反应生成砖红色沉淀
A、含有4种官能团,8个手性碳原子 B、1mol X最多可以和3mol H2发生加成反应 C、只有1种消去产物 D、可与新制的Cu(OH)2反应生成砖红色沉淀 -
14、二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)CH3COOCH3(g) ΔH1=a kJ/mol;
反应Ⅱ:CH3COOCH3(g)+2H2(g)CH3CH2OH(g)+CH3OH(g) ΔH2=b kJ/mol。
反应Ⅰ、Ⅱ的平衡常数的对数lgK1、lgK2与温度的关系如图甲所示;固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图乙所示。下列说法正确的是
 A、a>0 B、测得X点CH3CH2OH的物质的量分数是10%,则X点反应Ⅱ有:v正<v逆 C、由CH3COOCH3的曲线知,600 K后升高温度对反应Ⅰ的影响程度小于反应Ⅱ D、曲线B表示CO或CH3OCH3的物质的量分数随温度的变化
A、a>0 B、测得X点CH3CH2OH的物质的量分数是10%,则X点反应Ⅱ有:v正<v逆 C、由CH3COOCH3的曲线知,600 K后升高温度对反应Ⅰ的影响程度小于反应Ⅱ D、曲线B表示CO或CH3OCH3的物质的量分数随温度的变化 -
15、
钠及其化合物在生产生活中具有广泛的作用。
Ⅰ.化工专家侯德榜发明的侯氏制碱法,其工艺流程图如下:

已知:氯化铵在加热条件下生成氨气和氯化氢。
(1)由工艺流程图可知可以循环使用的物质有(填化学式)。
(2)写出碳酸化过程中发生反应的化学方程式:。
(3)欲除去制得的碳酸钠中的碳酸氢钠可用加热的方法,用化学方程式表示其原理。
(4)若在(3)中加热的时间较短,分解不完全。取加热了一段时间的固体样品若干克,完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中某离子的物质的量的变化如下图所示,则M点的溶质成分是。

Ⅱ.高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A、F为非金属单质气体,B为常见金属单质,E为生活中最常见的调味品,F在标准状况下密度为。

请回答下列问题:
(5)反应①~⑤中,属于氧化还原反应的有个。
(6)写出反应⑤的化学方程式,并用单线桥标明电子转移的方向和数目:。
-
16、无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡与氯气反应制备SnCl4 , 装置如下图所示。
已知:SnCl4熔点为-30℃,沸点为114℃,室温下为无色液体,在空气中极易水解;Cl2易溶于SnCl4。请回答下列问题:
 (1)、已知实验室中可以用KMnO4代替MnO2制备氯气,最终产物也是MnCl2 , 则A装置中发生的离子方程式是:。(2)、下列关于实验装置的说法正确的是___________。A、整套实验装置先检漏,再连接,再添加药品,最后检查气密性 B、A中盛放KMnO4晶体的仪器名称为圆底烧瓶 C、B中盛放饱和食盐水,C中盛放浓硫酸 D、装置E中上方冷水的作用是冷凝回流SnCl4至收集器中(3)、收集器中收集到的液体略显黄色,原因是。(4)、F装置内应该盛放的试剂为 , G装置内应该盛放的试剂为。F与G两个装置可用球型干燥管代替,则球型干燥管中应盛放(填写干燥剂名称)。
(1)、已知实验室中可以用KMnO4代替MnO2制备氯气,最终产物也是MnCl2 , 则A装置中发生的离子方程式是:。(2)、下列关于实验装置的说法正确的是___________。A、整套实验装置先检漏,再连接,再添加药品,最后检查气密性 B、A中盛放KMnO4晶体的仪器名称为圆底烧瓶 C、B中盛放饱和食盐水,C中盛放浓硫酸 D、装置E中上方冷水的作用是冷凝回流SnCl4至收集器中(3)、收集器中收集到的液体略显黄色,原因是。(4)、F装置内应该盛放的试剂为 , G装置内应该盛放的试剂为。F与G两个装置可用球型干燥管代替,则球型干燥管中应盛放(填写干燥剂名称)。 -
17、某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如下。

实验步骤:
①装好实验装置;
②_______;
③把适量高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为ag;
④加热,开始反应,直到产生一定量的气体;
⑤停止加热;
⑥测量收集到的气体的体积;
⑦准确称量试管和残留物的质量为bg;
⑧测量实验室的温度。
请回答下列问题:
(1)、实验步骤的第②步是。(2)、以下是测量收集到的气体的体积时必须包括的几个步骤:①调整量气管高度,使其液面高度与水准管液面高度相平;
②使装置内的气体都冷却至室温;
③读取量气管中气体的体积;
这三步操作的正确顺序是→→③(请填写步骤代号)。
(3)、如果实验中得到的氧气体积是cL,水蒸气的影响忽略不计,则室温下气体摩尔体积的计算式为L/mol(含a、b、c)。(4)、假定其他操作均正确,分析下列因素对实验结果的影响。①高锰酸钾未完全分解:(填“偏大”、“偏小”或“无影响”,下同);
②实验前未将装置内的空气排出:;
③未恢复至室温就读数:。
-
18、有十种物质①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩液态氯化氢。(1)、①的一种同素异形体是(填物质的名称)。(2)、属于氧化物的有(填物质的序号,下同)。(3)、其中能导电的是;属于非电解质的是。(4)、等质量④和⑤中分子的数目之比为;若④和⑤中所含氢原子数相等,则同温同压下,④和⑤的体积之比为。(5)、写出⑥在水中的电离方程式。
-
19、利用NaClO和尿素[CO(NH2)2]反应制备N2H4·H2O (水合肼)的实验流程如图所示:

已知:①氯气与烧碱溶液的反应是放热反应;②N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。下列说法错误的是
A、步骤I中为避免温度过高,可采用冰水浴 B、步骤I制备NaClO溶液时,若溶液中NaClO与副产物NaClO3的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 C、步骤II生成水合肼反应中NaClO作为氧化剂 D、步骤II中可将尿素水溶液逐滴滴入NaClO碱性溶液中 -
20、硫化氢的转化是资源利用和环境保护的重要研究课题。Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图所示。下列说法正确的是
 A、反应Ⅰ中H2S被还原 B、反应过程中,Fe3+是催化剂 C、反应Ⅱ的离子方程式为: D、脱除1molH2S,标准状况下消耗氧气的体积为22.4L
A、反应Ⅰ中H2S被还原 B、反应过程中,Fe3+是催化剂 C、反应Ⅱ的离子方程式为: D、脱除1molH2S,标准状况下消耗氧气的体积为22.4L