相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、下列实验操作,现象及结论都正确的是
选项
实验操作和现象
结论
A
向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体
溶液中一定含
B
对某碱性溶液进行焰色试验,火焰颜色为黄色
该溶液为NaOH溶液
C
向FeCl2溶液中滴加新制氯水,溶液变成棕黄色
新制氯水中含HClO
D
向溶液中加入过量硝酸酸化的AgNO3溶液,有白色沉淀生成
该溶液中含Cl-
A、A B、B C、C D、D -
2、氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:下列有关该反应的说法中,正确的是A、该反应属于置换反应 B、H2O中的氢元素都被还原 C、NaH 被氧化, 作还原剂 D、每生成标况下22.4L H2 , 转移2mol电子
-
3、下列单、双线桥的表示方法正确的是A、
 B、
B、 C、
C、 D、
D、
-
4、下列离子方程式正确的是A、新制氯水光照后发生变化: B、二氧化碳通入氯化钙溶液: C、氢氧化钡溶液与硫酸溶液: D、将铁片放入醋酸溶液中:
-
5、设NA为阿伏加德罗常数的值。下列说法正确的是A、同温同压下,原子数相同的SO2与O2 , 体积比为 B、常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA C、钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为NA D、过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.4NA
-
6、下列物质的性质与用途不具有对应关系的是A、漂白粉中次氯酸盐具有强氧化性,漂白粉既可作漂白剂,又可作消毒剂 B、钠单质的熔点较低,常用于冶炼金属钛 C、过氧化钠可与H2O和CO2反应生成氧气,可用在呼吸面具中作为氧气的来源 D、碳酸氢钠能与盐酸反应,可用于治疗胃酸过多
-
7、下列物质间的转化中,不能一步实现的是A、 B、 C、 D、
-
8、下列说法中正确的有
①焰色试验是化学变化;
②利用焰色试验不能区分与固体;
③进行焰色试验时,须用稀硫酸清洗做试验的铂丝(或铁丝);
④胶体的微粒直径在之间;
⑤胶体区别于其他分散系的本质特征是能够产生丁达尔效应;
⑥胶体能够使水中悬浮的固体颗粒沉降,达到净水目的。
A、②④⑥ B、①④⑥ C、②④⑤ D、①③⑥ -
9、“铜绿”是铜和空气中的水蒸气、CO2、O2作用产生的, 其化学式为Cu2(OH)2CO3 , 从物质分类标准看,“铜绿”属于A、酸 B、碱 C、盐 D、氧化物
-
10、化学与生产、生活、科技等方面密切相关,下列说法正确的是A、实现“碳中和”具有直接贡献的一种措施:研发催化剂将转化为甲醇 , 其中碳元素化合价为-2价),该过程中发生了氧化反应 B、维生素又称“抗坏血酸”,能帮助人体将食物中摄取的、不易吸收的转变为易吸收的 , 这说明维生素具有氧化性 C、德尔塔新冠病毒有可能在空气中以气溶胶的形式传播,气溶胶属于胶体 D、河道中的垃圾回收分类后,进行无害化处理,该处理过程中没有涉及化学变化
-
11、碱式氯化铜制备需要的CuCl2可用Fe3+作催化剂得到,其催化原理如图所示。下列有关说法正确的是
 A、图中M、N分别为Fe2+、Fe3+ B、上述转化过程中Cu2+与O2个数比1:1 C、N参加的反应离子方程式为: D、a、b、c之间的关系式为:a=b+c
A、图中M、N分别为Fe2+、Fe3+ B、上述转化过程中Cu2+与O2个数比1:1 C、N参加的反应离子方程式为: D、a、b、c之间的关系式为:a=b+c -
12、已知:
 。
。参照上述合成路线,以丙醛和
 为原料,设计制备
为原料,设计制备 的合成路线。
的合成路线。 -
13、已知:醛在一定条件下可以两分子间反应
 , 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛(
, 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛( )合成兔耳草醛的路线如下:
)合成兔耳草醛的路线如下: (1)、枯茗醛的核磁共振氢谱有组峰;A→B的反应类型是。(2)、B中含有的官能团是(写结构式);检验B中含氧官能团的试剂是。(3)、写出C→兔耳草醛的化学方程式:。
(1)、枯茗醛的核磁共振氢谱有组峰;A→B的反应类型是。(2)、B中含有的官能团是(写结构式);检验B中含氧官能团的试剂是。(3)、写出C→兔耳草醛的化学方程式:。 -
14、苹果醋是由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸(A)是这种饮料中的主要酸性物质。已知:在下列有关苹果酸(A)的转化关系中,B能使溴的四氯化碳溶液褪色。回答下列问题:
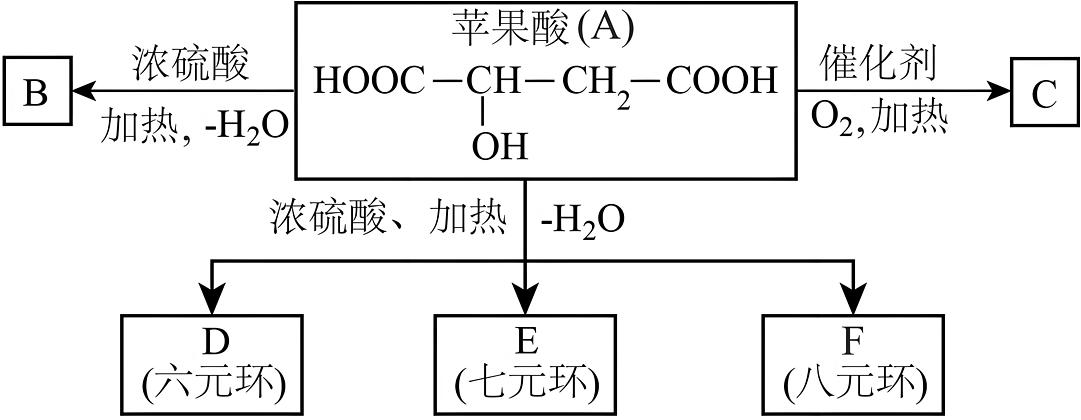 (1)、苹果酸分子中所含官能团的名称是。(2)、苹果酸不能发生的反应有(填序号)。
(1)、苹果酸分子中所含官能团的名称是。(2)、苹果酸不能发生的反应有(填序号)。①加成反应 ②酯化反应 ③加聚反应 ④氧化反应 ⑤消去反应 ⑥取代反应
(3)、B的结构简式:;C的结构简式:;F的分子式:。(4)、写出A→D的化学方程式:。 -
15、1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O,F的结构简式为
 。该烃A在不同条件下能发生如下所示的一系列变化:
。该烃A在不同条件下能发生如下所示的一系列变化:
(1)A的化学式 , A的结构简式。
(2)上述反应中,①是反应,⑦是反应(填反应类型)。
(3)写出下列物质的结构简式:
C , D , E , H。
(4)写出D→F反应的化学方程式:。
-
16、1,4-环己二醇可通过下图所示路线合成(某些反应的反应物和反应条件未标出):
 (1)、A的结构简式是。(2)、写出反应④、⑦的化学方程式。
(1)、A的结构简式是。(2)、写出反应④、⑦的化学方程式。反应④:。
反应⑦:。
(3)、属于取代反应的是 , 属于加成反应的是。(填序号)(4)、环己烷的二氯取代产物有种。 -
17、我国自主研发对二甲苯的绿色合成路线如下图所示,有关说法不正确的是
 A、过程①发生了加成反应 B、过程②有C-H键、C-O键、C-C键的断裂和形成 C、该反应的副产物可能有间二甲苯 D、M的结构简式为
A、过程①发生了加成反应 B、过程②有C-H键、C-O键、C-C键的断裂和形成 C、该反应的副产物可能有间二甲苯 D、M的结构简式为
-
18、化合物(如图)是一种重要的材料中间体,下列有关化合物的说法中正确的是
 A、分子中含有三种官能团 B、可与乙醇、乙酸反应 C、所有碳原子一定处于同一平面 D、可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
A、分子中含有三种官能团 B、可与乙醇、乙酸反应 C、所有碳原子一定处于同一平面 D、可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 -
19、格氏试剂(RMgX)与醛、酮反应是制备醇的重要途径。Z的一种制备方法如下:

下列说法不正确的是
A、中碳负离子的杂化轨道类型为 B、Y分子与Z分子中均含有手性碳原子 C、Z易溶于水是因为Z分子与水分子之间能形成氢键 D、以、和水为原料也可制得Z -
20、某二元醇的键线式为
 , 下列关于该有机物的说法不正确的是 A、系统命名:5-甲基-2,5-庚二醇 B、该有机物可通过催化氧化得到含有酮羰基官能团的物质 C、1mol该有机物能与足量金属反应产生22.4L D、该有机物通过消去反应能得到6种不同结构的二烯烃(不包括立体异构)
, 下列关于该有机物的说法不正确的是 A、系统命名:5-甲基-2,5-庚二醇 B、该有机物可通过催化氧化得到含有酮羰基官能团的物质 C、1mol该有机物能与足量金属反应产生22.4L D、该有机物通过消去反应能得到6种不同结构的二烯烃(不包括立体异构)