相关试卷
- 江苏省如皋中学2025-2026学年高三上学期测试(一)化学试题
- 广西壮族自治区来宾市多校2025-2026学年高二上学期11月期中联考 化学试题
- 江苏省苏州市吴江区汾湖高级中学2025-2026学年高二上学期9月月考化学试题
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 江苏省泰州市靖江高级中学2025-2026学年高一上学期9月月考化学试题
- 2026届广东省六校联盟高三年级第一次联考化学试题
- 四川省大数据智学领航联盟2026届高三上学期一模考试 化学试题
- 广西南宁市名校联盟2026届高三上学期8月一模化学试题
- 江苏省徐州市第七中学2025-2026学年高二上学期9月月考 化学试卷
-
1、 利用CaS循环再生可将燃煤尾气中的SO,转化生产单质硫,涉及的主要反应如下:
I . CaS(s) +2SO2(g) =CaSO4(s)+S2(g) ΔH1
II. CaSO4(s) +4H2(g)=CaS(s)+ 4H2O(g) ΔH2
III. SO2(g)+3H2(g)=H,S(g)+2H2O(g) ΔH3
恒容条件下,按1mol CaS,1mol SO2和0.1mol H2投料反应。平衡体系中,各气态物种的lg n随温度的变化关系如图所示,n为气态物种物质的量的值。
已知:图示温度范围内反应Ⅱ平衡常数K=108基本不变。

回答下列问题:
(1)、 反应的焓变ΔH =((用含ΔH1 , ΔH2的代数式表示)。(2)、乙线所示物种为(填化学式)。反应Ⅲ的焓变ΔH30 (填“>”“<”或“=”)。(3)、T温度下,体系达平衡时,乙线、丙线所示物种的物质的量相等,若丁线所示物种为a mol,则S2为mol(用含a的代数式表示);此时,CaS与CaSO4物质的量的差值n(CaS)-n(CaSO4)=mol(用含a的最简代数式表示)。(4)、T2温度下,体系达平衡后,压缩容器体积S2产率增大。与压缩前相比,重新达平衡时,H2S与H2物质的量之比(填“增大”“减小”或“不变”), H2O 物质的量n(H2O)(填“增大”“减小”或“不变”)。 -
2、麻醉药布比卡因(1)的两条合成路线如下:

已知:①
 ②
②
回答下列问题:
(1)、 A 结构简式为;B中含氧官能团名称为(2)、 C→D反应类型为;D+E→H化学方程式为(3)、G的同分异构体中,同时满足下列条件的结构简式为(写出一种即可)。①含-NH2含2个苯环③含4种不同化学环境的氢原子
(4)、H中存在酰胺基N原子(a)和杂环N原子(b),N原子电子云密度越大,碱性越强,则碱性较强的N原子是(填“a”或“b”)。(5)、结合路线信息,用H2/PtO2催化加氢时,下列有机物中最难反应的是____(填标号)。A、苯( )
B、吡啶(
)
B、吡啶( )
C、环已-1,3-二烯(
)
C、环已-1,3-二烯( )
D、环己-1,4二烯(
)
D、环己-1,4二烯( )
(6)、 以
)
(6)、 以 ,
,  为主要原料合成
为主要原料合成 利用上述信息补全合成路线。
利用上述信息补全合成路线。
-
3、如下不饱和聚酯可用于制备玻璃钢。

实验室制备该聚酯的相关信息和装置示意图如下(加热及夹持装置略):
原料
结构简式
熔点/℃
沸点/℃
顺丁烯二酸酐

52.6
202.2
邻苯二甲酸酐

130.8
295.0
丙-1,2-二醇

-60.0
187.6

实验过程:
①在装置A中加入上述三种原料,缓慢通入N2。搅拌下加热,两种酸酐分别与丙-1,2-二醇发生醇解反应,主要生成
 和
和 。然后逐步升温至190~200℃,醇解产物发生缩聚反应生成聚酯。
。然后逐步升温至190~200℃,醇解产物发生缩聚反应生成聚酯。②缩聚反应后期,每隔一段时间从装置A中取样并测量其酸值,直至酸值达到聚合度要求(酸值:中和1克样品所消耗KOH的毫克数)。
回答下列问题:
(1)、理论上,原料物质的量投料比n(顺丁烯二酸酐):n(邻苯二甲酸酐):n(丙-1,2-二醇)=(2)、装置B的作用是;仪器C的名称是;反应过程中,应保持温度计2示数处于一定范围,合理的是(填标号)。
A.55~60℃ B.100~105° C.190~195℃(3)、为测定酸值,取a g样品配制250.00mL溶液.移取25.00mL溶液,用c mol·L-1 KOH一乙醇标准溶液滴定至终点,重复实验,数据如下:序号
1
2
3
4
5
滴定前读数/mL
0.00
24.98
0.00
0.00
0.00
滴定后读数/mL
24.98
49.78
24.10
25.00
25.02
应舍弃的数据为(填序号);测得该样品的酸值为(用含a,c的代数式表示)。若测得酸值高于聚合度要求,可采取的措施为(填标号)。
A.立即停止加热 B.排出装置D内的液体 C.增大N2的流速(4)、实验中未另加催化剂的原因是 -
4、 采用两段焙烧—水浸法从铁锰氧化矿(要含Fe2O3MnO2及Co,Cu,Ca,Si等元素的氧化物)分离提取Cu,Co,Mn等元素,工艺流程如下:

已知:该工艺条件下,(NH4)2SO4低温分解生成NH4HSO4 , 高温则完全分解为气体;Fe2(SO4)3在650℃完全分解,其他金属硫酸盐分解温度均高于700℃。
回答下列问题:
(1)、“低温焙烧”时金属氧化物均转化为硫酸盐。MnO2与NH4HSO4反应转化为MnSO4时有N2生成,该反应的化学方程式为.。“高温焙烧”温度为650℃,“水浸”所得滤渣主要成分除SiO2外还含有(填化学式)。(2)、在(NH4)2SO4投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸”时金属元素的浸出率(填“增大”“减小”或“不变”)。(3)、HR萃取Cu2+反应为:。“反萃取”时加入的试剂为(填化学式)。(4)、“沉钴”中,pH=4时Co2+恰好沉淀完全[c(Co2+)=1×10-5mol·L'],则此时溶液中c(H2S)=mol-1L"。已知:Ka1(H2S)=1x10-7 , Ka2(H2S)=1x10-13 , Ksp(CoS) =4x10-21。
CoS“溶解”时发生反应的离子方程式为
(5)、“沉锰”所得滤液并入“吸收”液中,经处理后所得产品导入(填操作单元名称)循环利用。 -
5、Fe单质及其化合物应用广泛。回答下列问题:(1)、在元素周期表中,Fe位于第周期族。基态Fe原子与基态Fe3+离子未成对电子数之比为(2)、尿素分子(H2NCONH2)与Fe3+形成配离子的硝酸盐[Fe(H2NCONH2)6](NO3)3俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素C,N,O中,第一电离能最大的是 , 电负性最大的是
②尿素分子中,C原子采取的轨道杂化方式为
③八面体配离子[Fe(H2NCONH2)6]3+中Fe3+的配位数为6,碳氮键的键长均相等,则与Fe2+配位的原子是(填元素符号)。
(3)、α-Fe可用作合成氨催化剂、其体心立方晶胞如图所示(晶胞边长为apm)。①α-Fe晶胞中Fe原子的半径为pm。
②研究发现,α一Fe晶胞中阴影所示m,n两个截面的催化活性不同,截面单位面积含有Fe原子个数越多,催化活性越低。m,n截面中,催化活性较低的是 , 该截面单位面积含有的Fe原子为个·pm-2。

-
6、常温下,假设1L水溶液中Co2+和C2O42-初始物质的量浓度均为0.01mol·L-1。平衡条件下,体系中全部四种含碳物种的摩尔分数随pH的变化关系如图所示(忽略溶液体积变化)。
已知:体系中含钴物种的存在形式为Co2+ , CoC2O4(s)和Co(OH)2(s);Ksp (CoC2O4)= 6.0x10°,Ksp[Co(OH)2]=5.9x10-15。
下列说法正确的是( )
 A、甲线所示物种为HC2O4- B、H2C2O4的电离平衡常数Ka2=10-8 C、pH =a时,Co2+物质的量浓度为1.6x10-3mol·L' D、pH=b时,物质的量浓度: c(OH-)<c(C2O42-)
A、甲线所示物种为HC2O4- B、H2C2O4的电离平衡常数Ka2=10-8 C、pH =a时,Co2+物质的量浓度为1.6x10-3mol·L' D、pH=b时,物质的量浓度: c(OH-)<c(C2O42-) -
7、以异丁醛(M)为原料制备化合物Q的合成路线如下,下列说法错误的是( )
 A、M系统命名为2-甲基丙醛 B、若M+X→N原子利用率为100%,则X是甲醛 C、用酸性KMnO4溶液可鉴别N 和Q D、P→Q过程中有CH3COOH生成
A、M系统命名为2-甲基丙醛 B、若M+X→N原子利用率为100%,则X是甲醛 C、用酸性KMnO4溶液可鉴别N 和Q D、P→Q过程中有CH3COOH生成 -
8、 钢渣中富含CaO,SiO2 , FeO,Fe2O3等氧化物,实验室利用酸碱协同法分离钢渣中的Ca,Si,Fe元素,流程如下。已知:Fe2(C2O4),能溶于水; Ksp(CaC2O4)=2.3x10-9 , Kp(FeC2O4)=3.2x10-7。
下列说法错误的是( )
 A、试剂X可选用Fe粉 B、试剂Y可选用盐酸 C、“分离”后Fe元素主要存在于滤液Ⅱ中 D、“酸浸”后滤液Ⅰ的pH过小会导致滤渣Ⅱ质量减少
A、试剂X可选用Fe粉 B、试剂Y可选用盐酸 C、“分离”后Fe元素主要存在于滤液Ⅱ中 D、“酸浸”后滤液Ⅰ的pH过小会导致滤渣Ⅱ质量减少 -
9、全铁液流电池工作原理如图所示,两电极分别为石墨电极和负载铁的石墨电极。下列说法正确的是( )
 A、隔膜为阳离子交换膜 B、放电时,a极为负极 C、充电时,隔膜两侧溶液Fe2浓度均减小 D、理论上,Fe3+每减少1mol,Fe2+总量相应增加2mol
A、隔膜为阳离子交换膜 B、放电时,a极为负极 C、充电时,隔膜两侧溶液Fe2浓度均减小 D、理论上,Fe3+每减少1mol,Fe2+总量相应增加2mol -
10、完成下列实验所用部分仪器或材料选择正确的是( )
实验内容
仪器或材料
A
灼烧海带
坩埚、泥三角
B
加热浓缩NaCl溶液
表面皿、玻璃棒
C
称量5.0gNaOH 固体
电子天平、称量纸
D
量取25.00mL稀H2SO4
25mL移液管、锥形瓶
A、A B、B C、C D、D -
11、在恒容密闭容器中,Na2SiF6(s)热解反应所得固相产物和气相产物均为含氟化合物。平衡体系中各组分物质的量随温度的变化关系(实线部分)如图所示。已知:T2温度时,Na2SiF6(s)完全分解;体系中气相产物在T1T3温度时的分压分别为p1 , p3。下列说法错误的是( )
 A、a线所示物种为固相产物 B、T1温度时,向容器中通入N2 , 气相产物分压仍为p1 C、p3小于T3温度时热解反应的平衡常数Kp。 D、T1温度时、向容器中加入b线所示物种,重新达平衡时逆反应速率增大
A、a线所示物种为固相产物 B、T1温度时,向容器中通入N2 , 气相产物分压仍为p1 C、p3小于T3温度时热解反应的平衡常数Kp。 D、T1温度时、向容器中加入b线所示物种,重新达平衡时逆反应速率增大 -
12、用肼(N2H4)的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量CuSO4 , 反应原理如图所示。下列说法正确的是( )
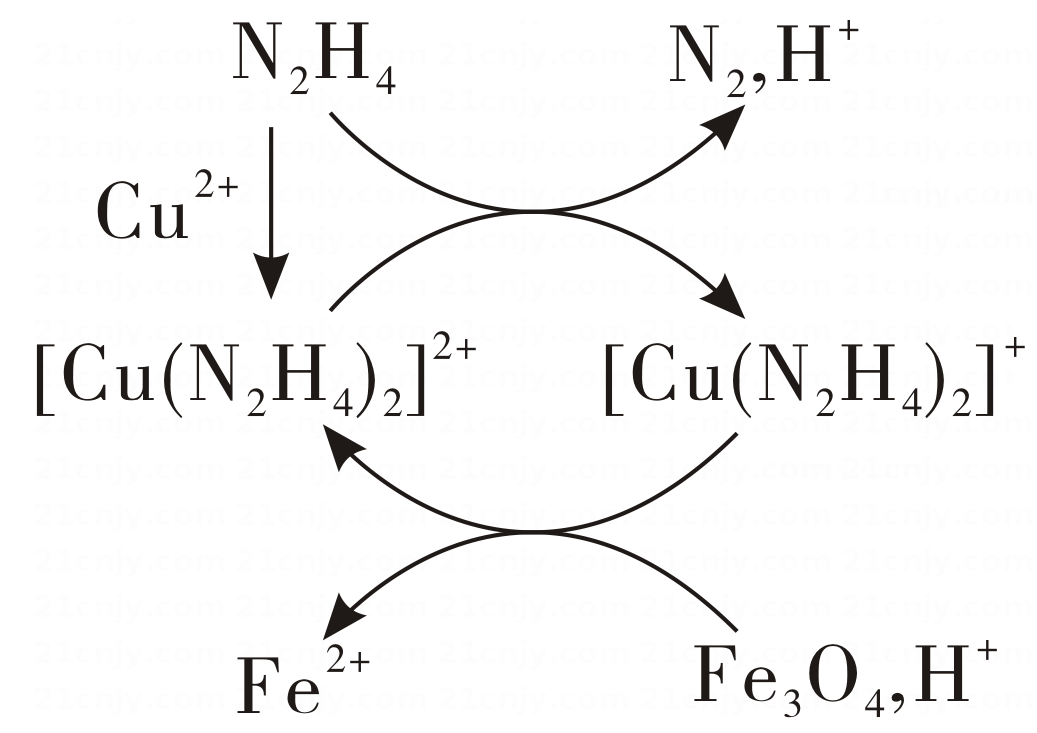 A、N2是还原反应的产物 B、还原性:N2H4<Fe2+ C、处理后溶液的pH增大 D、图示反应过程中起催化作用的是Cu2+
A、N2是还原反应的产物 B、还原性:N2H4<Fe2+ C、处理后溶液的pH增大 D、图示反应过程中起催化作用的是Cu2+ -
13、物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是( )
性质差异
主要原因
A
沸点:H2O>H2S
电离能:O>S
B
酸性:HClO>HBrO
电负性:Cl>Br
C
硬度:金刚石>晶体硅
原子半径:Si>C
D
熔点:MgO>NaF
离子电荷: Mg2+ >Na+ , O2- >F-
A、A B、B C、C D、D -
14、用硫酸和NaN3可制备一元弱酸HN3。下列说法错误的是( )A、NaN3的水溶液显碱性 B、N3-的空间构型为V形 C、NaN3为含有共价键的离子化合物 D、N3-的中心N原子所有价电子均参与成键
-
15、 第70号元素镱(Yb)的基态原子价电子排布式为4f146s2。下列说法正确的是( )A、Yb的中子数与质子数之差为 104 B、Yb与°Yb是同一种核素 C、基态Yb原子核外共有10个d电子 D、Yb位于元素周期表中第6周期
-
16、下列实验涉及反应的离子方程式书写正确的是( )A、用NaOH 溶液吸收少量SO2:SO2+ OH" = HSO3- B、用Na2O2和水制备少量O2: Na2O2+H2O =2Na++2O2↑ C、用MnO2和浓盐酸制备Cl2: D、用稀硝酸溶解少量Cu粉:3Cu+8H++8NO3-= 3Cu(NO3)2+2NO↑+4H2O
-
17、 称取1.6g 固体 NaOH 配制400mL浓度约为0.1mol·L-1的NaOH 溶液,下列仪器中不需要使用的是( )A、100mL烧杯 B、500mL容量瓶 C、500mL量筒 D、500mL细口试剂瓶(具橡胶塞)
-
18、实验室中,下列试剂保存方法正确的是( )A、液溴加水封保存在广口试剂瓶中 B、硝酸银溶液保存在棕色细口试剂瓶中 C、高锰酸钾与苯酚存放在同一药品柜中 D、金属锂保存在盛有煤油的广口试剂瓶中
-
19、化学应用体现在生活的方方面面,下列用法不合理的是( )A、用明矾净化黄河水 B、用漂白粉漂白蚕丝制品 C、用食醋去除水壶中水垢 D、用小苏打作烘焙糕点膨松剂
-
20、下列在化学史上产生重要影响的成果中,不涉及氧化还原反应的是( )A、侯德榜发明了以NH3CO2和NaCl为原料的联合制碱法 B、戴维电解盐酸得到H2和CI2 , 从而提出了酸的含氢学说 C、拉瓦锡基于金属和O2的反应提出了燃烧的氧化学说 D、哈伯发明了以N2和H2为原料合成氨的方法