相关试卷
- 江苏省如皋中学2025-2026学年高三上学期测试(一)化学试题
- 广西壮族自治区来宾市多校2025-2026学年高二上学期11月期中联考 化学试题
- 江苏省苏州市吴江区汾湖高级中学2025-2026学年高二上学期9月月考化学试题
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 江苏省泰州市靖江高级中学2025-2026学年高一上学期9月月考化学试题
- 2026届广东省六校联盟高三年级第一次联考化学试题
- 四川省大数据智学领航联盟2026届高三上学期一模考试 化学试题
- 广西南宁市名校联盟2026届高三上学期8月一模化学试题
- 江苏省徐州市第七中学2025-2026学年高二上学期9月月考 化学试卷
-
1、物质类别和价态是认识物质最重要的两个视角,下列有关氯的价-类二维图说法错误的是
 A、和在一定条件下可反应生成 B、C常用于自来水的杀菌消毒 C、和均具有较强的稳定性 D、的阴离子空间构型为三角锥形
A、和在一定条件下可反应生成 B、C常用于自来水的杀菌消毒 C、和均具有较强的稳定性 D、的阴离子空间构型为三角锥形 -
2、维格列汀常用于治疗2-型糖尿病,其结构简式如图所示,下列有关说法错误的是
 A、存在手性碳原子 B、在碱性溶液中能稳定存在 C、同分异构体中存在含苯环的羧酸类化合物 D、能与氢溴酸发生取代反应
A、存在手性碳原子 B、在碱性溶液中能稳定存在 C、同分异构体中存在含苯环的羧酸类化合物 D、能与氢溴酸发生取代反应 -
3、类比迁移思想能帮助我们掌握元素及其化合物的性质。下列有关类比迁移结果错误的是A、分子间存在氢键,则间也存在氢键 B、浓硫酸能使Al钝化,则浓硝酸也能使Al钝化 C、金属钠可保存在煤油中,则金属钾也可保存在煤油中 D、分子的空间结构为正四面体,则分子的空间结构也为正四面体
-
4、实验是科学研究的摇篮。下列化学实验装置或操作能达到实验目的的是


A.实验室制取乙酸乙酯
B.用NaOH标准溶液滴定未知浓度的醋酸


C.验证与的反应为放热反应
D.验证有乙炔生成
A、A B、B C、C D、D -
5、劳动最光荣。下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
家务劳动:利用稀醋酸溶液清洗杯子水垢
CH3COOH的酸性强于H2CO3
B
环保行动:用FeS除去废水中的Hg2+
溶度积:Ksp(FeS)>Ksp(HgS)
C
学农活动:用熟石灰改良酸性土壤
Ca(OH)2为碱性物质
D
技术人员:将金属钠制成高压钠灯
钠具有强还原性
A、A B、B C、C D、D -
6、潮汕美食享誉海内外。下列有关说法错误的是A、肠粉——米浆在炊熟过程中发生化学变化 B、生腌——生蚝腌制时加入高度白酒使蛋白质发生盐析 C、蚝烙——煎制所用猪油含有饱和高级脂肪酸甘油酯,能发生水解反应 D、鸭母捻——制作时加入的蔗糖无法发生银镜反应
-
7、现代生活处处有化学,下列有关说法正确的是A、“校服净”(主要含)可用于漂白衣物是因为其具有强氧化性 B、草木灰与氨态氮肥(含)混合使用可增强其肥效 C、霓虹灯呈现出五颜六色的光是因为发生电子从基态跃迁到激发态 D、非遗文化“打铁花”时铁水化作无数银花,该过程中涉及焰色试验
-
8、自主创新是我国攀登世界科技高峰的必由之路。下列有关说法错误的是A、“天问一号”使用的热控保温材料——纳米气凝胶,能产生丁达尔效应 B、“深地塔科”钻探井使用的金刚石钻头,金刚石与石墨互为同素异形体 C、东风弹道导弹弹体使用的复合材料碳纤维属于纤维素 D、“C919”大飞机使用的航空有机玻璃,其成分为混合物
-
9、下列化学用语表述错误的是A、甲酸的结构式:
 B、HF中的s-p键示意图:
B、HF中的s-p键示意图: C、顺-2-丁烯的分子结构模型:
C、顺-2-丁烯的分子结构模型: D、3-甲基-1-丁醇的键线式:
D、3-甲基-1-丁醇的键线式:
-
10、中国是礼仪之邦,礼器承载着国家尊严与荣光。下列有关礼器主要成分不同于其余三个的是


A.四羊方尊
B.良渚玉琮


C.西周利簋
D.商青铜觚
A、A B、B C、C D、D -
11、酸性溶液主要组成为与(与会络合为),其具有溶铜速率快、稳定、易控制及易再生等优点,常应用于印刷线路板(PCB)的刻蚀。刻蚀原理为 ,(1)、CuCl中基态亚铜离子的价层电子轨道表示式为。(2)、溶液中存在平衡: , 下列说法不正确的是_______(填序号)。A、加入几滴溶液,平衡逆向移动 B、加热溶液,溶液由蓝绿色变为黄绿色,平衡常数增大 C、加水稀释,的比值会减小 D、加入少量固体,平衡正向移动,转化率增大(3)、盐酸的浓度会影响刻蚀速率,浓度相同,盐酸浓度分别为、、时,随时间的变化曲线如图所示,中间速率变缓慢的可能原因是。
时,在内,的平均生成速率为。
 (4)、能形成多种配合物。铜氨溶液具有显著的抗菌作用。往溶液中通入氨气,测得和铜氨各级配合物的物质的量分数与平衡体系的浓度的负对数)的关系如图所示。
(4)、能形成多种配合物。铜氨溶液具有显著的抗菌作用。往溶液中通入氨气,测得和铜氨各级配合物的物质的量分数与平衡体系的浓度的负对数)的关系如图所示。
①曲线5代表的含铜微粒为。
②b点的纵坐标为。
③结合图像信息,计算反应的平衡常数。(已知的 , 写出计算过程)
-
12、锗单质在光纤通信、国防科技、航空航天技术和半导体材料等领域的应用日趋广泛。工业上一种以冶锌废渣(主要为Zn、Fe、Ge等的氧化物)为原料制备锗的流程如图所示。

已知:①25℃时, , ;
②当离子浓度小于等于时认为该离子已沉淀完全。
③溶浸中元素形式存在回答下列问题:
(1)、“溶浸”时要先把废渣粉碎过筛,目的是;加入的作用是。(2)、在实验室进行“沉锗”后分离得到操作所需的玻璃仪器有。(3)、“氧化”时反应(氧化产物标准状况下为气态)的氧化剂和还原剂的物质的量之比为。(4)、选择氢气还原氧化锗,而不是焦炭,原因可能是(答出一条即可);写出该步骤反应的化学方程式:。(5)、若采用加入氨水沉淀法获得 , 当溶液中恰好完全沉淀时,此时沉淀后溶液中(填“>”“<”或“=”)。(6)、通过掺杂硅可将锗单质转化为不同掺杂比例的硅锗合金,某种硅锗合金的立方晶胞结构如图所示。图中①指示的锗原子的分数坐标为;若该合金的密度为 , 则阿伏加德罗常数(用含、的代数式表示)。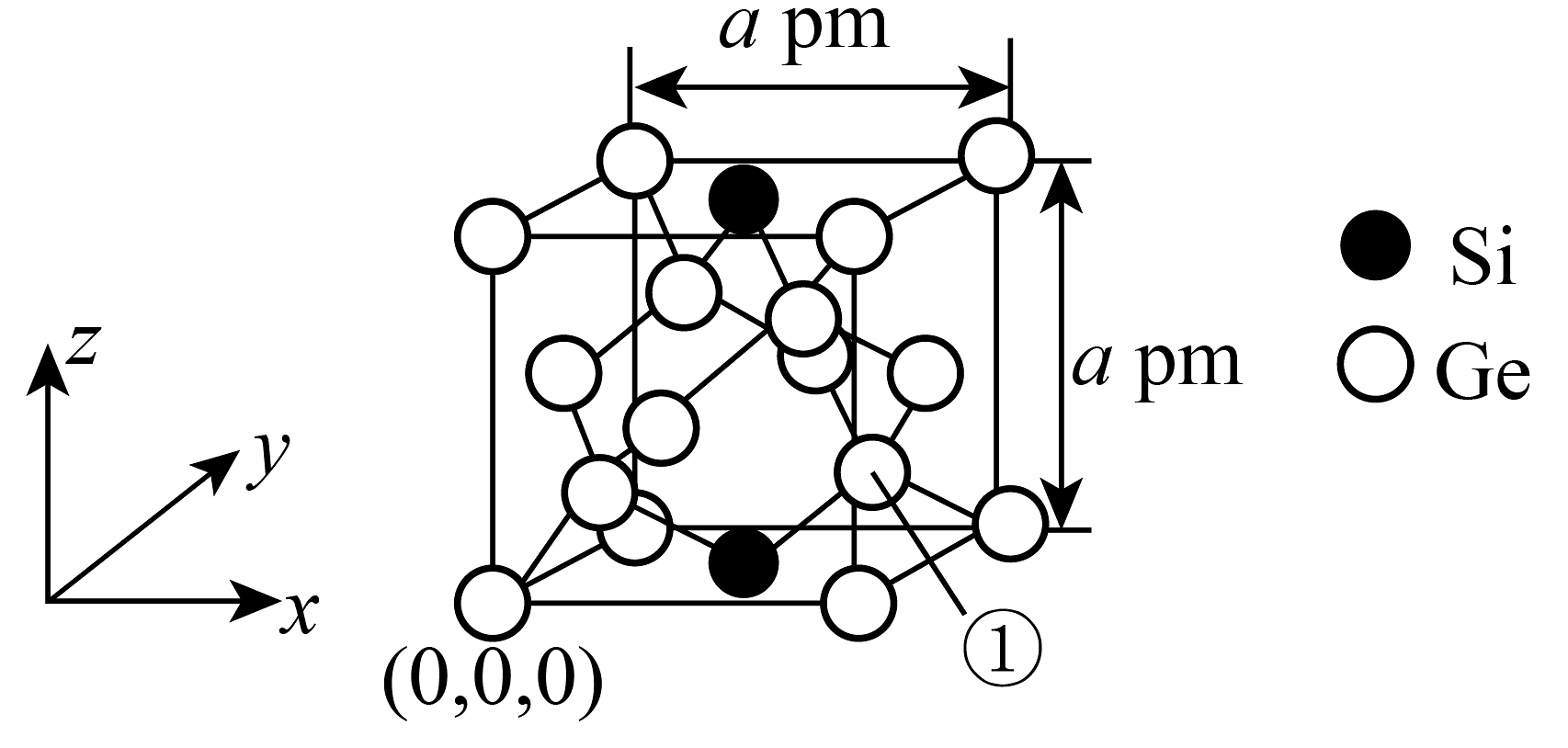
-
13、
I.关于氨的研究学习
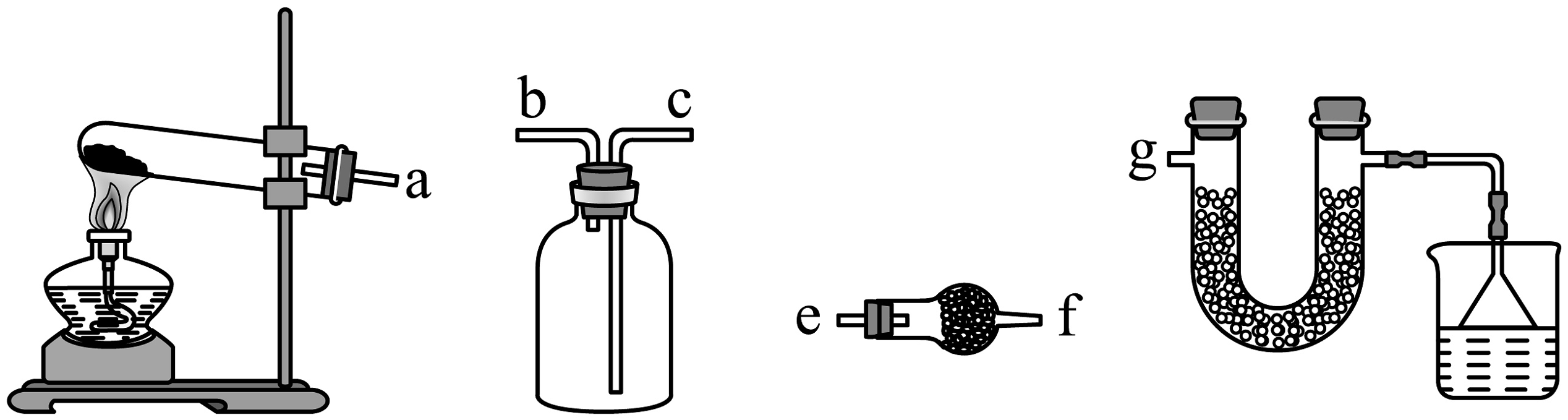
(1)氨气制备装置如下图
①利用上图装置进行实验室制备NH3 , 反应的化学方程式为。
②制取并收集纯净干燥NH3 , 连接装置:ag(填接口字母)。
③球形干燥管和U形管中装干燥剂,下列干燥剂可以选择的是。
A.P2O5 B.碱石灰 C.无水CaCl2
(2)检验某盐溶液中是否含有 , 实验操作和现象:取少量该溶液于试管中,(完成该实验操作、现象和结论)。
(3)用氨水洗涤离心试管中残留的AgCl固体,离子方程式:。
Ⅱ.探究银氨溶液与醛基的反应
实验1:往20mL0.1mol/LAgNO3溶液中滴加3滴乙醛,水浴加热。无明显现象。
实验2:往20mL0.1mol/L银氨溶液中滴加3滴乙醛,水浴加热。出现光亮的银镜。
针对上述实验甲同学基于氧化还原的知识提出以下假设:
假设1:乙醛在碱性条件下还原性增强。假设2:……
为验证以上假设,甲同学设计了如图所示的电化学装置,并进行了以下四组实验。每组实验中,溶液A和溶液B体积均为20mL,浓度均为0.1mol/L,向溶液B中滴加3滴乙醛后,测得电压表读数如表所示。
已知:参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大。
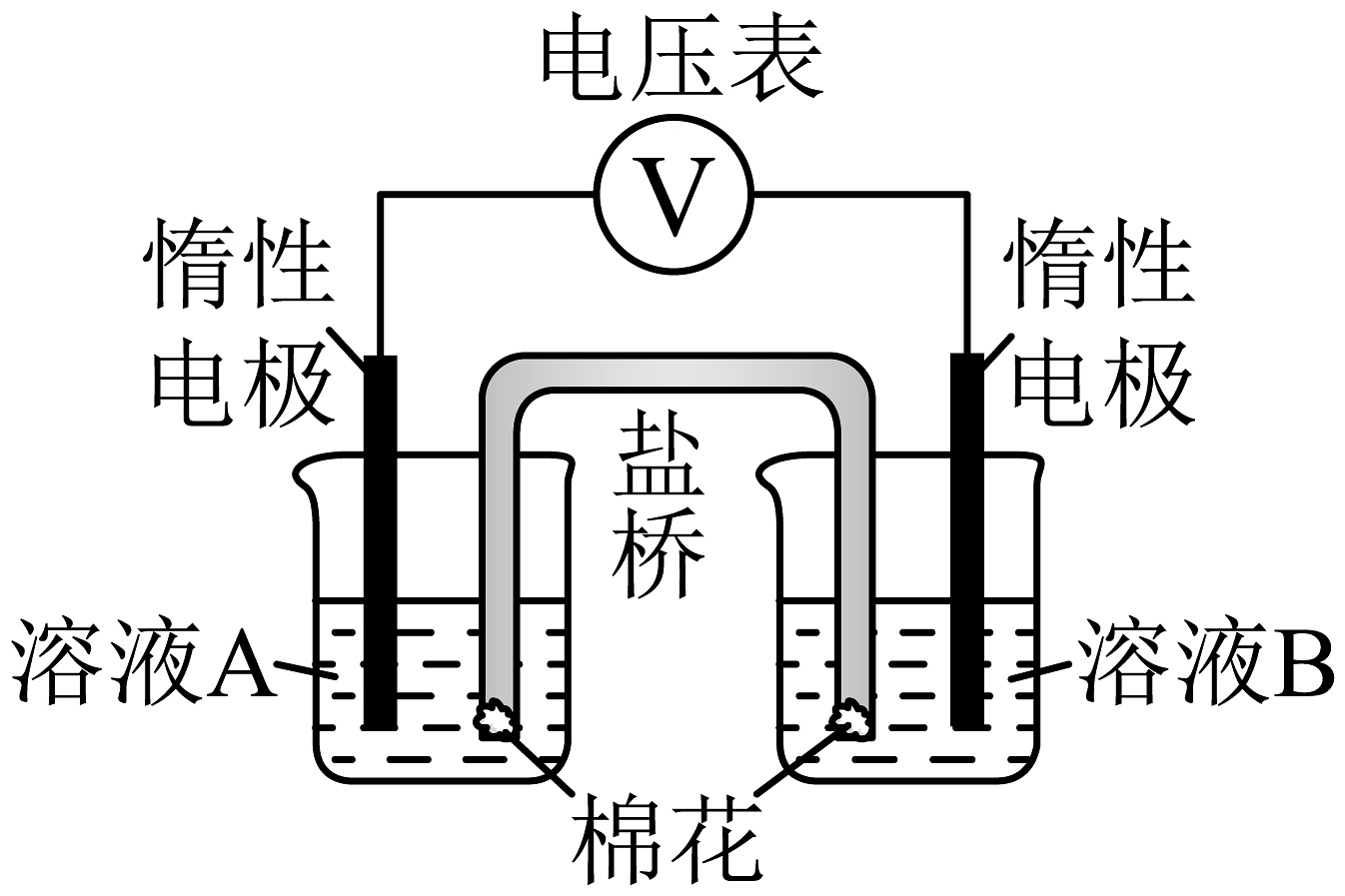
编号
溶液A
溶液B
电压表读数
ⅰ
AgNO3溶液
NaCl溶液
U1
ⅱ
AgNO3溶液
NaOH溶液
U2
ⅲ
银氨溶液
NaCl溶液
U3
ⅳ
银氨溶液
溶液
U4
(4)实验ⅰ和实验ⅲ中,溶液B选用NaCl溶液,而不使用蒸馏水的原因是。
(5)①由实验数据可知假设1成立。假设1成立的判断依据是:。
②碱性条件下,乙醛发生氧化反应的电极方程式为:。
(6)甲同学分别对比了实验ⅰ和实验ⅲ、实验ⅱ和实验ⅳ数据,你认为甲同学想研究的问题是:
(7)乙同学使用pH计测得0.1mol/LAgNO3溶液的pH=6,并指出:在酸性环境,也可能氧化乙醛;这会影响数据的测定和实验结果的判断。
针对该质疑,甲同学在实验ⅰ的基础上进行改进和优化,增设了一组实验v,测得电压表读数远小于U1,因此实验中的影响可忽略。请你简述该改进和优化的方案:。
-
14、某实验小组尝试设计如下装置,利用光伏发电,以甲苯为原料通过间接氧化法制取苯甲酸并实现储能,反应原理如下图所示。下列有关说法错误的是
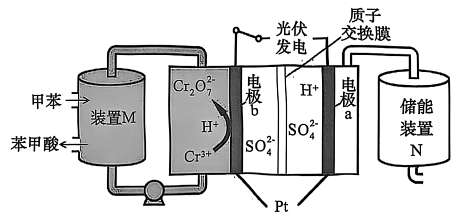 A、电极a为阴极,通过质子交换膜移向a极 B、装置中发生反应:
A、电极a为阴极,通过质子交换膜移向a极 B、装置中发生反应: C、每生成 , 理论上装置中可获得苯甲酸
D、电极发生电极反应为
C、每生成 , 理论上装置中可获得苯甲酸
D、电极发生电极反应为
-
15、部分含硫元素或氮元素物质的类别与相应化合价关系如图所示。

下列描述不合理的是
A、在自然界中存在c,说明该元素非金属性较弱 B、一定条件下,b与e可发生反应转化为c C、f、g为常见的强酸,常温下其浓溶液可用铁制容器储运 D、a、b分子中中心原子的VSEPR模型相同 -
16、已知:甲酸可以分解制取;某学习小组设计实验制取并验证其性质的装置如图所示(部分夹持装置略),下列说法不正确的是
 A、浓硫酸的作用为催化剂、脱水剂 B、碱石灰可吸收水蒸气和甲酸蒸气以及可能产生的和 C、该装置可验证具有还原性 D、可用NaOH溶液吸收尾气,防止污染空气
A、浓硫酸的作用为催化剂、脱水剂 B、碱石灰可吸收水蒸气和甲酸蒸气以及可能产生的和 C、该装置可验证具有还原性 D、可用NaOH溶液吸收尾气,防止污染空气 -
17、酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法错误的是
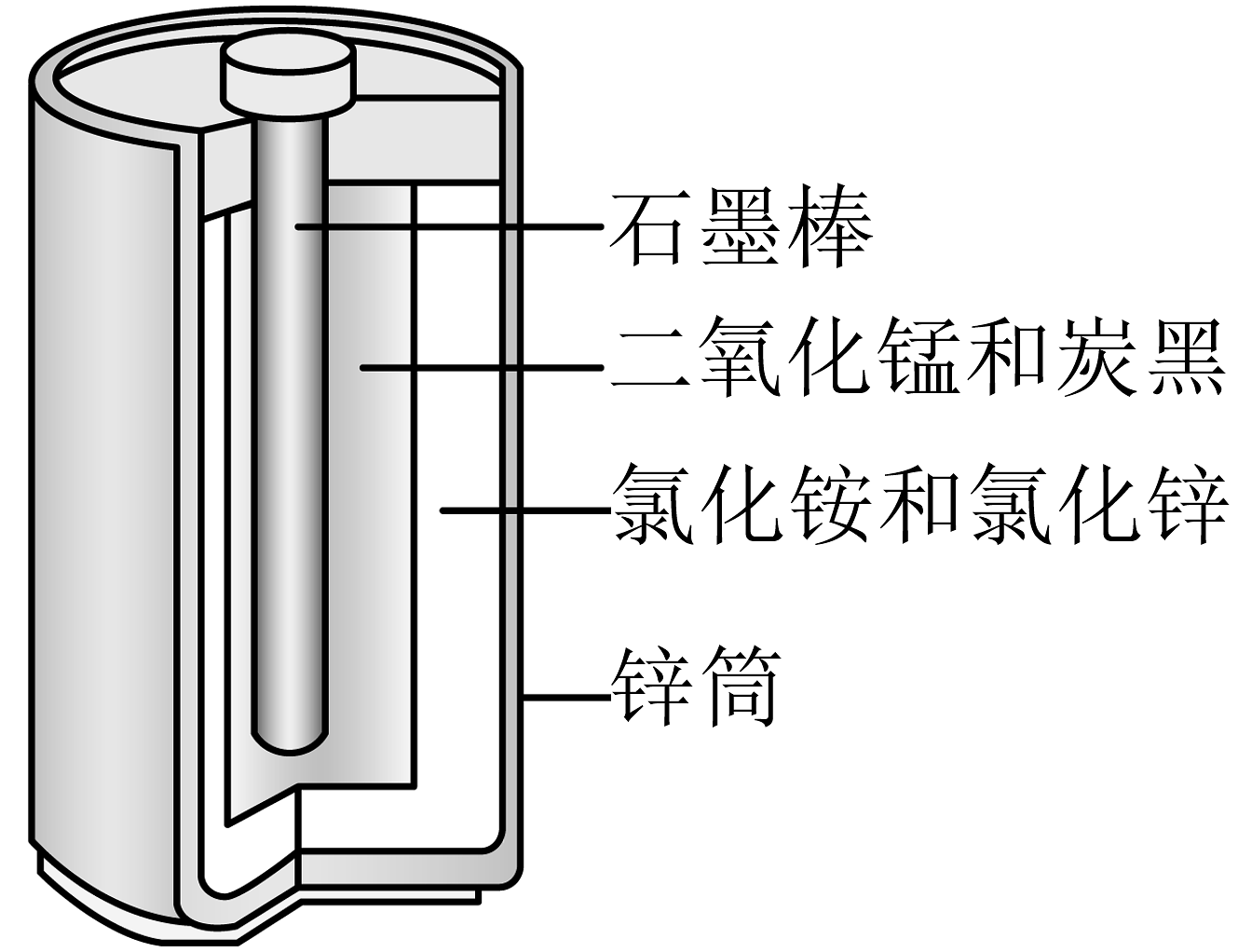 A、石墨作电池的正极材料 B、电池工作时,向正极方向移动 C、发生氧化反应 D、锌筒发生的电极反应为
A、石墨作电池的正极材料 B、电池工作时,向正极方向移动 C、发生氧化反应 D、锌筒发生的电极反应为 -
18、提纯混有少量苯甲酸的苯甲醇(常温为液态,微溶于水)过程如图所示,其中操作为
 A、冷却结晶 B、蒸发结晶 C、蒸馏 D、萃取分液
A、冷却结晶 B、蒸发结晶 C、蒸馏 D、萃取分液 -
19、劳动开创未来,下列劳动项目与所述的化学知识有关联的是
选项
劳动项目
化学知识
A
做水果罐头时加入维生素C
维生素C受热易分解
B
用固体疏通剂处理管道堵塞
C
用除去废水中的
具有很强的还原性
D
用氢氟酸雕刻玻璃花纹
氢氟酸具有弱酸性
A、A B、B C、C D、D -
20、1774年舍勒发现了氯气。下列有关氯气制备的实验装置不正确的是

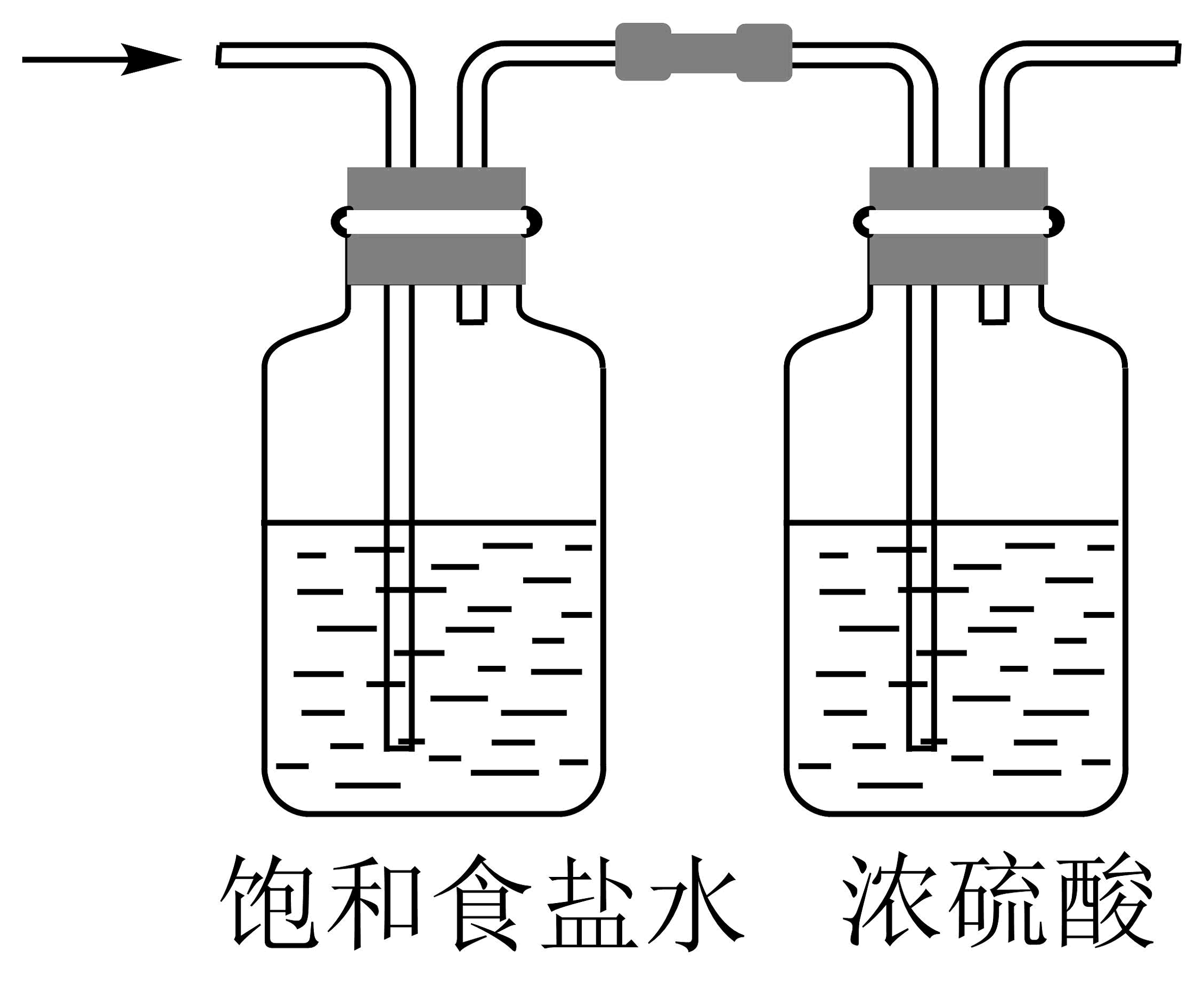
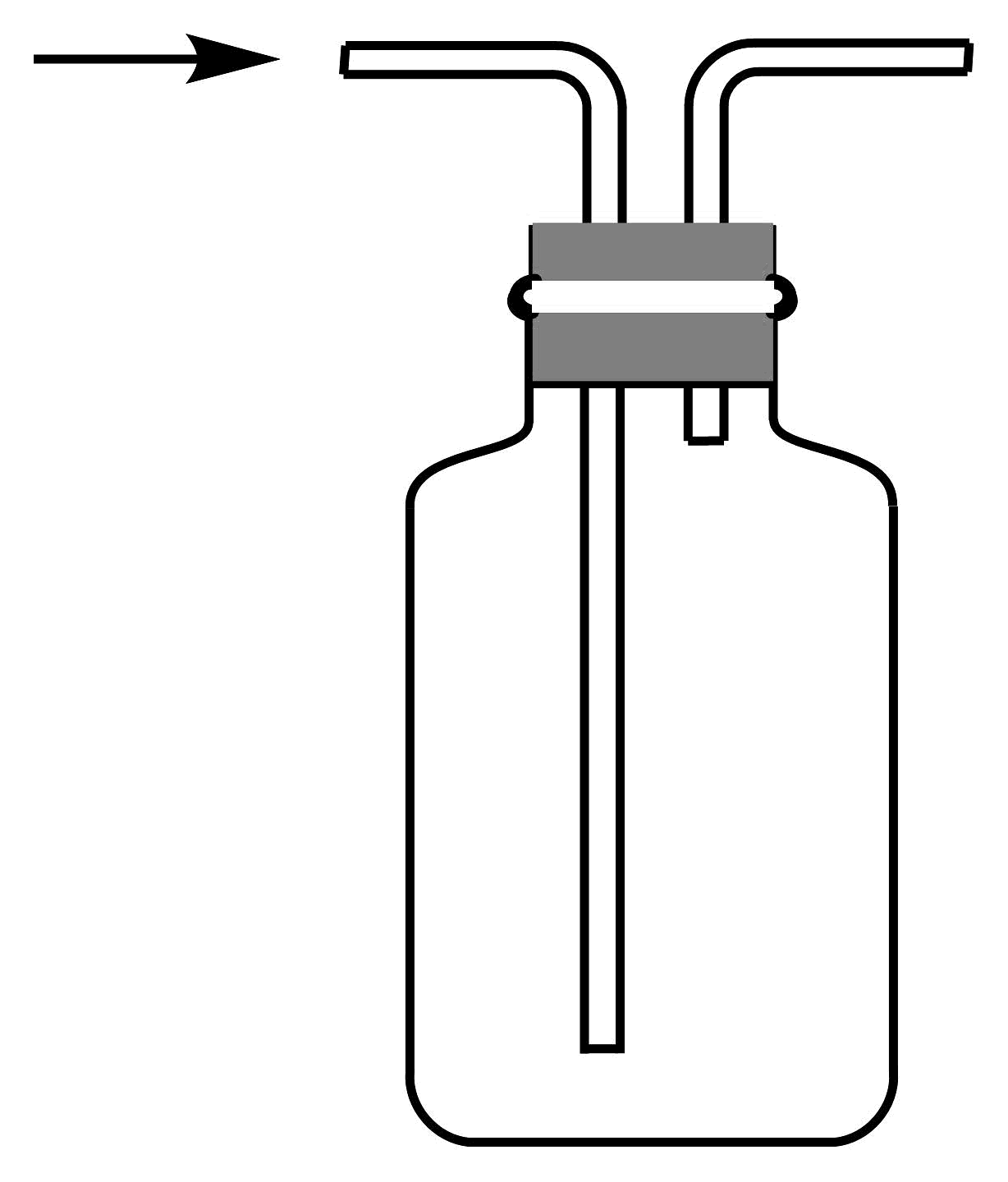

A.制备氯气
B.净化氯气
C.收集氯气
D.尾气处理
A、A B、B C、C D、D