-
1、下列关于药品使用说法错误的是( )A、用于治疗胃酸过多症 B、阿司匹林用于解热镇痛 C、碳酸钡制剂用作“钡餐” D、葡萄糖用于缓解低血糖症状
-
2、《梦溪笔谈》是北宋科学家沈括的著作,书中详细记载了我国劳动人民在科学技术方面的卓越贡献和他自己的研究成果,被称为“中国科学史的里程碑”,沈括则被称为“中国整部科学史中的卓越人物”.下列工艺不可能被记载的是( )A、湿法炼铜 B、炼铁 C、电解法冶炼铝 D、海水晒盐
-
3、垃圾是放错位置的资源,下列有关垃圾的说法正确的是( )A、废旧金属可回收利用,重新用于冶炼金属 B、废玻璃的主要成分为硅酸盐,没有回收价值 C、过期牛奶加热杀菌后仍可以继续食用 D、废聚氯乙烯塑料不易降解,应焚烧处理
-
4、我国提出2030年前实现“碳达峰”,2060年实现“碳中和”,体现了大国担当.下列发电方式不利于实现“碳达峰”和“碳中和”的是( )A、太阳能发电 B、风力发电 C、火力发电 D、潮汐能发电
-
5、珊瑚的形成与保护
已知:①
②
③
(1)、以下能判断总反应达到平衡状态的是____。A B.
A、钙离子浓度保持不变 B、保持不变 C、 D、(2)、增大有利于珊瑚的形成,请解释原因。(3)、已知的 , 为。当时,开始产生沉淀。(4)、根据如图,写出电极a的电极反应式。 (5)、关于上述电化学反应过程,描述正确的是____。A、该装置实现电能转化为化学能 B、电极b是负极 C、电子从电极a经过负载到电极b再经过水体回到电极a D、每参与反应时,转移电子(6)、解释在溶液中氧气的浓度变大后,为何有利于的除去,但不利于硝酸根的除去。。
(5)、关于上述电化学反应过程,描述正确的是____。A、该装置实现电能转化为化学能 B、电极b是负极 C、电子从电极a经过负载到电极b再经过水体回到电极a D、每参与反应时,转移电子(6)、解释在溶液中氧气的浓度变大后,为何有利于的除去,但不利于硝酸根的除去。。 -
6、瑞格列奈的制备。
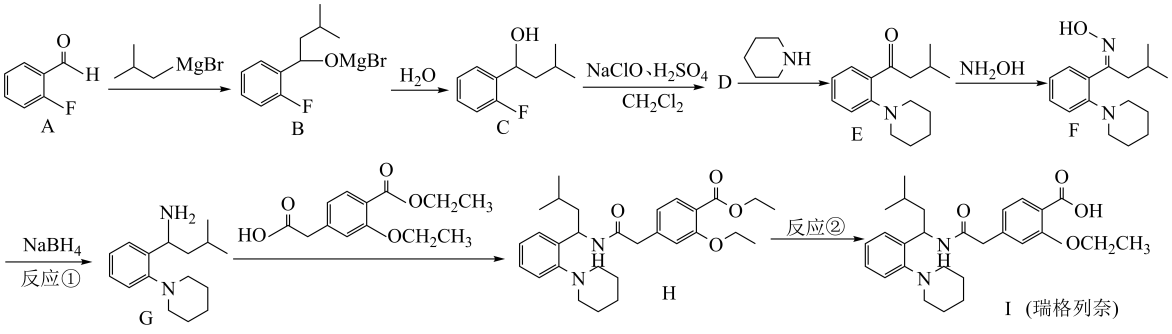 (1)、瑞格列奈中的含氧官能团除了羧基、醚键,还存在。(2)、反应①的反应类型为____。A、还原反应 B、消去反应 C、取代反应 D、氧化反应(3)、反应②的试剂和条件是。(4)、D的分子式是 , 画出D的结构简式。(5)、化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式。
(1)、瑞格列奈中的含氧官能团除了羧基、醚键,还存在。(2)、反应①的反应类型为____。A、还原反应 B、消去反应 C、取代反应 D、氧化反应(3)、反应②的试剂和条件是。(4)、D的分子式是 , 画出D的结构简式。(5)、化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式。i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为。
(6)、G对映异构体分离后才能发生下一步反应①G中有个手性碳
②已知
 , 用
, 用 和谷氨酸可制备
和谷氨酸可制备 , 该物质可用于分离对映异构体。谷氨酸的结构简式为:。检验谷氨酸的试剂是。
, 该物质可用于分离对映异构体。谷氨酸的结构简式为:。检验谷氨酸的试剂是。A.硝酸 B.茚三酮 C. D.
(7)、用 与G可直接制取H但产率变低,请分析原因。 (8)、以
与G可直接制取H但产率变低,请分析原因。 (8)、以 和合成
和合成 。
。 -
7、I.铝的三种化合物的沸点如下表所示:
铝的卤化物
沸点
1500
370
430
(1)、解释三种卤化物沸点差异的原因。(2)、已知反应。①
②
③
④
⑤
则。
(3)、由图可知,若该反应自发,则该反应的____。 A、 B、 C、 D、(4)、II.已如的晶胞如图所示(已知结构为平行六面体,各棱长不相等,在棱心)
A、 B、 C、 D、(4)、II.已如的晶胞如图所示(已知结构为平行六面体,各棱长不相等,在棱心)
该晶体中,每个 , 距离其最近的有____个。
A、4 B、5 C、8 D、12(5)、已知 , 一个晶胞的体积。求的晶胞密度。(6)、水解可得胶体,请解释用可净水的原因。(7)、用上述制得的胶体做电泳实验时,有某种胶体粒子向阴极移动,该粒子可能是____。A、 B、 C、 D、 -
8、已知可二聚为下图的二聚体:
 (1)、该二聚体中存在的化学键类型为____。A、极性键 B、非极性键 C、离子键 D、金属键(2)、将该二聚体溶于生成(结构如图所示),已知其配离子为四面体形,中心原子杂化方式为 , 其中配体是 , 该配合物中有键。
(1)、该二聚体中存在的化学键类型为____。A、极性键 B、非极性键 C、离子键 D、金属键(2)、将该二聚体溶于生成(结构如图所示),已知其配离子为四面体形,中心原子杂化方式为 , 其中配体是 , 该配合物中有键。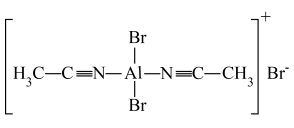
-
9、粗盐水的精制
粗盐中含有等杂质离子,实验室按下面的流程进行精制:
已知:和的溶解度如图所示:
 (1)、步骤①中要稍过量。请描述检验是否过量的方法:。(2)、若加后不先过滤就加氢氧化钠和碳酸钠,会导致____。A、不能完全去除 B、消耗更多 C、不能完全去除 D、消耗更多(3)、过滤操作中需要的玻璃仪器。除烧杯和玻璃棒外,还需要____。A、分液漏斗 B、漏斗 C、容量瓶 D、蒸发皿(4)、步骤④中用盐酸调节pH至3~4,除去的离子有。(5)、“一系列操作”是指____。A、蒸发至晶膜形成后,趁热过滤 B、蒸发至晶膜形成后,冷却结晶 C、 蒸发至大量晶体析出后,趁热过滤 D、蒸发至大量晶体析出后,冷却结晶(6)、请用离子方程式表示加入盐酸后发生的反应。
(1)、步骤①中要稍过量。请描述检验是否过量的方法:。(2)、若加后不先过滤就加氢氧化钠和碳酸钠,会导致____。A、不能完全去除 B、消耗更多 C、不能完全去除 D、消耗更多(3)、过滤操作中需要的玻璃仪器。除烧杯和玻璃棒外,还需要____。A、分液漏斗 B、漏斗 C、容量瓶 D、蒸发皿(4)、步骤④中用盐酸调节pH至3~4,除去的离子有。(5)、“一系列操作”是指____。A、蒸发至晶膜形成后,趁热过滤 B、蒸发至晶膜形成后,冷却结晶 C、 蒸发至大量晶体析出后,趁热过滤 D、蒸发至大量晶体析出后,冷却结晶(6)、请用离子方程式表示加入盐酸后发生的反应。另有两种方案选行粗盐提纯。
方案2:向粗盐水中加入石灰乳[主要成分为]除去 , 再通入含的工业废气除去;
方案3:向粗盐水中加入石灰乳除去 , 再加入碳酸钠溶液除去。
(7)、相比于方案3,方案2的优点是。(8)、已知粗盐水中含量为 , 含量为 , 现用方案3提纯10L该粗盐水,求需要加入石灰乳(视为)和碳酸钠的物质的量。 -
10、氟元素及其化合物具有广泛用途。(1)、下列关于氟元素的性质说法正确的是( )A、原子半径最小 B、原子第一电离能最大 C、元素的电负性最强 D、最高正化合价为+7(2)、下列关于与说法正确的是( )A、是同种核素 B、是同素异形体 C、比多一个电子 D、比多一个中子(3)、萤石()与浓硫酸共热可制备HF气体,写出该反应的化学方程式: , 该反应中体现浓硫酸的性质是。
A.强氧化性 B.难挥发性 C.吸水性 D.脱水性
(4)、液态氟化氢(HF)的电离方式为: , 其中X为。的结构为 , 其中与HF依靠相连接。(5)、回答下列问题:氟单质常温下能腐蚀等金属,但工业上却可用制容器储存,其原因是。
是极强的氧化剂,用和可制备稀有气体离子化合物,六氟合铂氙的制备方式如图所示
 (6)、上述反应中的催化剂为____。A、 B、 C、 D、(7)、上述过程中属于氧化还原反应的是____。A、② B、③ C、④ D、⑤(8)、氟气通入氙(Xe)会产生三种氟化物气体。现将的和的同时通入的容器中,反应后,测得容器内共有气体,且三种氟化物的比例为 , 则内的速率 。
(6)、上述反应中的催化剂为____。A、 B、 C、 D、(7)、上述过程中属于氧化还原反应的是____。A、② B、③ C、④ D、⑤(8)、氟气通入氙(Xe)会产生三种氟化物气体。现将的和的同时通入的容器中,反应后,测得容器内共有气体,且三种氟化物的比例为 , 则内的速率 。 -
11、[化学—选修5:有机化学基础]
白藜芦醇(化合物I)具有抗肿瘤、抗氧化、消炎等功效。以下是某课题组合成化合物I的路线。
回答下列问题:
(1)、A中的官能团名称为。(2)、B的结构简式为。(3)、由C生成D的反应类型为。(4)、由E生成F的化学方程式为。(5)、已知G可以发生银镜反应,G的化学名称为。(6)、选用一种鉴别H和I的试剂并描述实验现象。(7)、I的同分异构体中,同时满足下列条件的共有种(不考虑立体异构)。①含有手性碳(连有4个不同的原子或基团的碳为手性碳);
②含有两个苯环;③含有两个酚羟基;④可发生银镜反应。
-
12、[化学—选修3:物质结构与性质]
ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:(1)、该族元素基态原子核外未成对电子数为 , 在与其他元素形成化合物时,呈现的最高化合价为。(2)、俗称电石,该化合物中不存在的化学键类型为(填标号)。a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)、一种光刻胶薄膜成分为聚甲基硅烷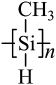 , 其中电负性最大的元素是 , 硅原子的杂化轨道类型为。 (4)、早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:。
, 其中电负性最大的元素是 , 硅原子的杂化轨道类型为。 (4)、早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:。物质
熔点/
442
29
143
(5)、结晶型可作为放射性探测器元件材料,其立方晶胞如图所示。其中的配位数为。设为阿伏加德罗常数的值,则该晶体密度为(列出计算式)。
-
13、甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯()的研究所获得的部分数据如下。回答下列问题:(1)、已知如下热化学方程式:
计算反应的。
(2)、与反应生成 , 部分会进一步溴化。将和。通入密闭容器,平衡时,、与温度的关系见下图(假设反应后的含碳物质只有、和)。
(i)图中的曲线是(填“a”或“b”)。
(ii)时,的转化 , 。
(iii)时,反应的平衡常数。
(3)、少量可提高生成的选择性。时,分别在有和无的条件下,将和 , 通入密闭容器,溴代甲烷的物质的量(n)随时间(t)的变化关系见下图。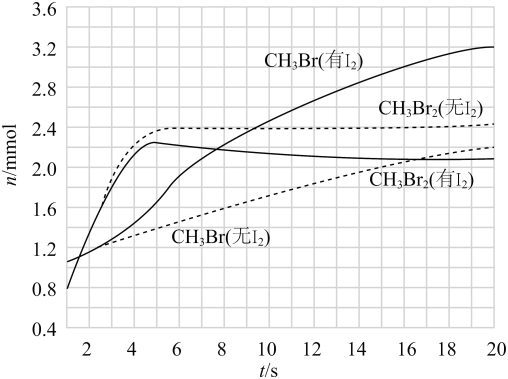
(i)在之间,有和无时的生成速率之比。
(ii)从图中找出提高了选择性的证据:。
(ⅲ)研究表明,参与反应的可能机理如下:
①
②
③
④
⑤
⑥
根据上述机理,分析提高选择性的原因:。
-
14、(俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢制取,反应方程式如下:
(一)过氧化脲的合成
烧杯中分别加入、蒸馏水和尿素,搅拌溶解。下反应 , 冷却结晶、过滤、干燥,得白色针状晶体。
(二)过氧化脲性质检测
I.过氧化脲溶液用稀酸化后,滴加溶液,紫红色消失。
Ⅱ.过氧化脲溶液用稀酸化后,加入溶液和四氯化碳,振荡,静置。
(三)产品纯度测定
溶液配制:称取一定量产品,用蒸馏水溶解后配制成溶液。
滴定分析:量取过氧化脲溶液至锥形瓶中,加入一定量稀 , 用准确浓度的溶液滴定至微红色,记录滴定体积,计算纯度。
回答下列问题:
(1)、过滤中使用到的玻璃仪器有(写出两种即可)。(2)、过氧化脲的产率为。(3)、性质检测Ⅱ中的现象为。性质检则I和Ⅱ分别说明过氧化脲具有的性质是。(4)、下图为“溶液配制”的部分过程,操作a应重复3次,目的是 , 定容后还需要的操作为。 (5)、“滴定分析”步骤中,下列操作错误的是____(填标号)。A、溶液置于酸式滴定管中 B、用量筒量取过氧化脲溶液 C、滴定近终点时,用洗瓶冲洗锥形瓶内壁 D、锥形瓶内溶液变色后,立即记录滴定管液面刻度(6)、以下操作导致氧化脲纯度测定结果偏低的是____(填标号)。A、容量瓶中液面超过刻度线 B、滴定管水洗后未用溶液润洗 C、摇动锥形瓶时溶液滴到锥形瓶外 D、滴定前滴定管尖嘴处有气泡,滴定后气泡消失
(5)、“滴定分析”步骤中,下列操作错误的是____(填标号)。A、溶液置于酸式滴定管中 B、用量筒量取过氧化脲溶液 C、滴定近终点时,用洗瓶冲洗锥形瓶内壁 D、锥形瓶内溶液变色后,立即记录滴定管液面刻度(6)、以下操作导致氧化脲纯度测定结果偏低的是____(填标号)。A、容量瓶中液面超过刻度线 B、滴定管水洗后未用溶液润洗 C、摇动锥形瓶时溶液滴到锥形瓶外 D、滴定前滴定管尖嘴处有气泡,滴定后气泡消失 -
15、钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。

注:加沉淀剂使一种金属离子浓度小于等于 , 其他金属离子不沉淀,即认为完全分离。
已知:①。
②以氢氧化物形式沉淀时,和溶液的关系如图所示。
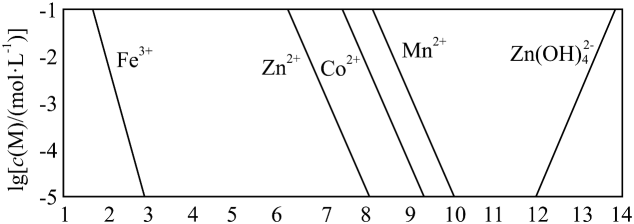
回答下列问题:
(1)、“酸浸”前,需将废渣磨碎,其目的是。(2)、“酸浸”步骤中,发生反应的化学方程式是。(3)、假设“沉铜”后得到的滤液中和均为 , 向其中加入至沉淀完全,此时溶液中 , 据此判断能否实现和的完全分离(填“能”或“不能”)。(4)、“沉锰”步骤中,生成 , 产生的物质的量为。(5)、“沉淀”步骤中,用调 , 分离出的滤渣是。(6)、“沉钴”步骤中,控制溶液 , 加入适量的氧化 , 其反应的离子方程式为。(7)、根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是。 -
16、将配制成悬浊液,向其中滴加的溶液。(M代表、或)随加入溶液体积(V)的变化关系如图所示。

下列叙述正确的是( )
A、交点a处: B、 C、时,不变 D、 -
17、科学家使用研制了一种可充电电池(如图所示)。电池工作一段时间后,电极上检测到和少量。下列叙述正确的是( )
 A、充电时,向阳极方向迁移 B、充电时,会发生反应 C、放电时,正极反应有 D、放电时,电极质量减少 , 电极生成了
A、充电时,向阳极方向迁移 B、充电时,会发生反应 C、放电时,正极反应有 D、放电时,电极质量减少 , 电极生成了 -
18、W、X、Y、Z为原子序数依次增大的短周期元素。W和X原子序数之和等于的核外电子数,化合物可用作化学电源的电解质。下列叙述正确的是( )A、X和Z属于同一主族 B、非属性: C、气态氢化物的稳定性: D、原子半径:
-
19、四瓶无色溶液 , 它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是( )
 A、a呈弱碱性 B、f可溶于过量的b中 C、c中通入过量的e可得到无色溶液 D、b和d反应生成的沉淀不溶于稀硝酸
A、a呈弱碱性 B、f可溶于过量的b中 C、c中通入过量的e可得到无色溶液 D、b和d反应生成的沉淀不溶于稀硝酸 -
20、我国化学工作者开发了一种回收利用聚乳酸(PLA)高分子材料的方法,其转化路线如下所示。

下列叙述错误的是( )
A、PLA在碱性条件下可发生降解反应 B、MP的化学名称是丙酸甲酯 C、MP的同分异构体中含羧基的有3种 D、MMA可加聚生成高分子