-
1、下列说法正确的是( )A、聚异戊二烯和聚乙烯均能使溴水褪色 B、蔗糖水解的最终产物可以发生银镜反应 C、某有机物完全燃烧后生成和 , 说明该有机物中一定含有C、H、O三种元素 D、1 mol先与发生加成反应,再与发生取代反应,最多消耗 3 mol
-
2、一定温度下,有反应 , 现将1 mol充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )A、
 B、
B、 C、
C、 D、
D、
-
3、下列热化学方程式书写正确的是( )A、 kJ·mol(反应热) B、 kJ⋅mol(反应热) C、 kJ⋅mol(燃烧热) D、 kJ⋅mol(中和反应反应热)
-
4、分子式为能与Na反应放出气体并且能催化氧化生成醛的有机物有(不含立体结构)( )A、4种 B、5种 C、6种 D、7种
-
5、下列有关同分异构体与同系物说法正确的是( )A、组成元素相同,各元素质量分数也相同的两种化合物一定互为同分异构体 B、相对分子质量相同但结构不同的化合物一定互为同分异构体 C、凡是分子组成相差一个或若干个原子团的物质.一定互为同系物 D、符合通式的两种烃不一定互为同系物
-
6、下列有关官能团和物质类别的关系说法不正确的是( )A、有机物分子中含有
 , 则该有机物不一定为烯烃类
B、的官能团为(羟基),属于醇类
C、和分子中都含有(醛基),则两者同属于醛类
D、可以看作的一个氢原子被一个溴原子取代后的产物,因此属于烃的衍生物
, 则该有机物不一定为烯烃类
B、的官能团为(羟基),属于醇类
C、和分子中都含有(醛基),则两者同属于醛类
D、可以看作的一个氢原子被一个溴原子取代后的产物,因此属于烃的衍生物
-
7、下列化学用语正确的是( )A、乙醇的球棍模型:
 B、一氯甲烷的电子式:
B、一氯甲烷的电子式: C、乙烯的结构式:
D、乙酸的最简式:
C、乙烯的结构式:
D、乙酸的最简式:
-
8、化学与人类生产、生活和社会可持续发展密切相关,下列说法正确的是( )A、油脂、纤维素、聚乙烯和蛋白质都是高分子化合物 B、重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒 C、滚丙烯腈纤维可用于制毛线,聚丙烯腈纤维是有机高分子材料 D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
-
9、工业上可溶性的钡盐常用重晶石()与焦炭在高温下还原得到,按物质的量之比1∶3投料。主要发生如下反应:
①
②
③
④
请回答下列问题:
(1)、已知碳的燃烧热 , 表示CO燃烧热的热化学方程式为。(2)、若在某密闭容器中只发生反应: , 达到平衡后,压缩体积为原来的一半,化学平衡移动方向是(填“正向”“逆向”或“不移动”),达到新的平衡后,的浓度(填“增大”“减小”或“不变”)。(3)、一定温度下,若在某2L恒容密闭容器中加入1mol 、1mol 发生反应:和 , 达到平衡后的浓度是 , 剩余C的物质的量是y mol,反应的化学平衡常数(用含x、y的代数式表示)。
(4)、T℃温度下,碳热还原硫酸钡反应经过t min达到平衡时(反应①②③④均发生),混合气体的总压强为p Pa,其中CO的物质的量分数为 , 若反应①的速率用单位时间内气体的分压变化表示,用表示的化学反应速率是(用含p、、t的代数式表示);平衡后,保持温度不变,加压达到新的平衡时(填“增大”“减小”或“不变”)。(5)、常压下,不同反应温度下碳热还原硫酸钡反应体系中各物质的组成如图所示。温度大于400℃发生的主要反应是(填反应序号)。
-
10、弱电解质电离平衡和盐类水解平衡都与生命活动、日常生活息息相关。
Ⅰ.已知、、HClO的电离平衡常数如下表所示。
弱酸
HClO
电离平衡常数
(1)、三种弱酸的酸性由强到弱的顺序为(用化学式表示)。(2)、HClO的电离方程式为。(3)、相同温度下,同浓度的溶液和溶液中pH较大的是。(4)、将少量通入NaClO溶液中,反应的离子方程式为。(5)、Ⅱ.有同学认为,溶液中水解程度大于其电离程度,因此溶液中 , 某课题组先利用pH数字传感器对不同浓度的溶液进行pH测定,结果如下表所示,再计算出溶液中各离子的浓度,绘制出不同浓度溶液中部分离子浓度的关系如图所示。溶液的浓度/
0.1
pH(25℃)
8.30
8.29
7.84
7.65

关于上述不同浓度的溶液,下列说法正确的是____(填字母)。
A、加入3滴甲基橙,溶液均呈黄色 B、溶液中始终存在 C、溶液中存在(6)、随着溶液浓度增加,pH升高的可能原因是。(7)、25℃时,0.1的溶液中(已知)。 -
11、我国科学家开发铁、镍、氮单原子催化剂实现催化还原制备附加值高的系列产品,如图所示。

回答下列问题:
(1)、基态Fe原子的价层电子排布式为。基态N原子核外电子占据个轨道。(2)、图中涉及的分子中,属于直线形分子的有(填化学式)。(3)、丁分子中C原子的杂化类型是。(4)、等物质的量的甲、乙分子中,σ键数目之比为。(5)、已知:的平衡常数;的平衡常数。的中心离子的配位数为。稳定性:(填“>”“<”或“=”),判断依据是。
(6)、Ni形成的一种立方晶系的晶胞结构如图所示。已知晶胞参数为a pm,为阿伏加德罗常数的值,该晶体中Mg、Ni、C的原子个数之比为 , 该晶体的密度为(用含a、的代数式表示)。
-
12、环己烯是合成赖氨酸、环己酮苯酚、聚环烯树脂等的原料,还可用作催化剂溶剂,和石油萃取剂、高辛烷值汽油稳定剂。环己烯可通过环己醇脱水得到,原理如下:

相关物质的性质如下表:
物质
熔点/℃
沸点/℃
密度/()
溶解性
相对分子质量
环己烯
-103.7
83.0
0.81
不溶于水
82
环己醇
25.9
160.8
0.96
微溶于水
100
硫酸
10.4
337
1.83
与水互溶,能共沸产生白雾
Ⅰ.环己烯粗品的制备。实验装置(加热和夹持装置已略)和步骤如下:

实验步骤:
ⅰ.按图示连接好仪器,并进行气密性检验。
ⅱ.在干燥的仪器A中加入几粒颗粒物,再将B中液体加入到A中。
ⅲ.将仪器A在陶土网上用小火慢慢加热,并不断搅拌,控制加热速度,使分馏柱上端的温度不超过90℃,慢慢的蒸出生成的环己烯和水,直到蒸馏完全,停止蒸馏。
(1)、仪器A的名称是。步骤ⅱ仪器A中放入颗粒物的作用是。(2)、装置D中冷凝水从(填“a”或“b”)口进入。(3)、A中的反应液温度较高(130℃左右)时会产生副产物(填结构简式)。(4)、Ⅱ.环己烯的精制。①将C中的蒸馏液加入精盐,然后加入3~4mL 5%的碳酸钠溶液。
②将此液体倒入分液漏斗中,振荡后静置分层……并加入1~2g无水氯化钙。
③将②中含环己烯的混合物滤入干燥的蒸馏烧瓶中进行蒸馏。
步骤①中加入3~4mL5%的碳酸钠溶液的目的是。
(5)、步骤②中分液的具体操作是打开分液漏斗上方的玻璃塞和下方的活塞,。(6)、若得到的产品为4.6g,则本实验中产品的产率是(结果保留两位有效数字)。 -
13、常温下,某混合溶液中 , 、、、和随pH变化的关系如图所示(不考虑溶液体积的变化)。下列说法正确的是( )
 A、1线表示随溶液pH变化的关系 B、常温下,的第一步电离常数为 C、P点时, D、当混合溶液呈中性时,
A、1线表示随溶液pH变化的关系 B、常温下,的第一步电离常数为 C、P点时, D、当混合溶液呈中性时, -
14、MTP是一类重要的药物中间体,可以由TOME经环化后合成,其反应原理如图所示:

为了提高TOME的转化率,反应进行时需及时从溶液体系中移出部分甲醇,此过程中TOME的转化率随反应时间的变化如图所示。设TOME的初始浓度为 , 反应过程中的液体体积变化忽略不计。下列说法正确的是( )
 A、X点: B、X、Y两点该反应的化学平衡常数相等 C、Z点溶液中: D、反应物的消耗速率:Y点大于Z点
A、X点: B、X、Y两点该反应的化学平衡常数相等 C、Z点溶液中: D、反应物的消耗速率:Y点大于Z点 -
15、尿素[]是一种重要的化工原料,也是环境污染物之一,尿素废水对环境的影响会造成土地碱性化植物枯萎死亡等。因此,各国化学家都在致力“变废为宝”。科学家研发出一体化——双池处理尿素的装置如图所示。已知电极材料均为石墨。下列说法错误的是( )
 A、左侧装置为原电池,a口排出的是、 B、丙电极是阳极,电极反应式为 C、若左侧装置的电解质溶液是硫酸,工作一段时间后,负极室溶液pH变小 D、若装置中生成标准状况下6.72L氢气时,消耗尿素的总质量为12g
A、左侧装置为原电池,a口排出的是、 B、丙电极是阳极,电极反应式为 C、若左侧装置的电解质溶液是硫酸,工作一段时间后,负极室溶液pH变小 D、若装置中生成标准状况下6.72L氢气时,消耗尿素的总质量为12g -
16、下列合成高分子的单体种数、反应类型均正确的是( )
选项
高分子
单体种数
反应类型
A

1
加聚
B

2
缩聚
C

2
缩聚
D

2
缩聚
A、A B、B C、C D、D -
17、异丁酸香兰酯是食品用香料,用于配制香精的各香料成分,其合成反应的化学方程式如图所示:

下列叙述错误的是( )
A、该反应属于取代反应 B、X分子的结构简式为 C、香兰素和异丁酸香兰酯都能与NaOH溶液反应 D、物质的量相同的香兰系和异丁酸香兰酯与足量的反应,消耗的质量相同 -
18、的光催化还原机理以及部分相对能量如图所示。下列说法正确的是( )
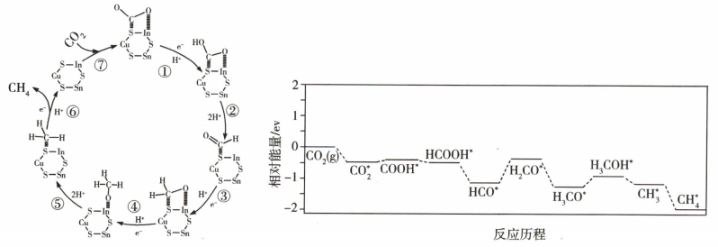 A、该机理总反应的化学方程式为 B、①~⑦过程中只有两个步骤中有生成 C、该历程存在9个基元反应 D、该过程有双键的形成与非极性键的断裂
A、该机理总反应的化学方程式为 B、①~⑦过程中只有两个步骤中有生成 C、该历程存在9个基元反应 D、该过程有双键的形成与非极性键的断裂 -
19、异甘草素用作化妆品助剂、食品添加剂等,其结构如图所示。下列有关异甘草素的叙述正确的是( )
 A、分子式为 B、与足量发生加成反应后的物质不含手性碳原子 C、该物质属于芳香烃 D、分子中含3种官能团
A、分子式为 B、与足量发生加成反应后的物质不含手性碳原子 C、该物质属于芳香烃 D、分子中含3种官能团 -
20、由下列实验操作和现象可得出相应正确结论的是( )
选项
实验操作
现象
结论
A
向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制
无砖红色沉淀
蔗糖未发生水解
B
将苯与足量浓硝酸、浓硫酸混合在50~60℃下充分反应后,再倒入水中
水的底部有油状液体
硝基苯的密度比水大、不溶于水
C
乙醇与浓硫酸混合在170℃下反应,将产生的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
乙烯具有还原性
D
加热试管中的聚氯乙烯薄膜碎片,在试管口用湿润的蓝色石蕊试纸检验
薄膜焦化,石蕊试纸变红
聚氯乙烯热分解的产物只有烃和HCl
A、A B、B C、C D、D