-
1、 Ⅰ.金属矿物资源以及海水资源的利用有着非常重要的意义。工业海水淡化及从海水中提取溴的过程如下:

请回答下列问题:
(1)、海水淡化的方法有法、反渗透法和电渗析法等。(2)、从海水中可以得到食盐,为了除去粗盐中的 , 可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量溶液③加适量盐酸④加过量溶液⑤加过量溶液。正确的操作顺序是____(填字母)。A、⑤④②③① B、⑤④②①③ C、④⑤②①③ D、⑤②④①③(3)、步骤Ⅱ用水溶液吸收 , 反应的离子方程式为。(4)、步骤Ⅱ吹出的Br2还可以用纯碱吸收,发生的反应3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3。当吸收0.3molBr2时,反应中转移电子的物质的量是mol。(5)、工业上电解饱和食盐水制Cl2的化学方程式。(6)、Ⅱ.金属矿物冶炼得到的铁屑和海带中提取的碘可以用于生产KI,工艺流程如图所示: 请回答下列问题:
请回答下列问题:KI的溶解度随温度变化比较大,操作A包括、冷却结晶、过滤。
(7)、请设计一种检验水溶液中是否含有碘单质的方法:。 -
2、 已知:A(分子式为:C2H4)是来自石油的重要有机化工原料,B、D是厨房中常见的两种有机物,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。请完成下列空白。
 (1)、A的电子式为 , D分子中的官能团名称是。(2)、①的反应类型为 , ③的反应类型为。(3)、写出反应E的结构简式。(4)、乙烯与氢气反应得到乙烷,下列物质与乙烷互为同系物的有____。(填字母)A、CH2=CH2 B、HOCH2CH2OH C、CH3CH2CH3 D、CH3-CH2--CH3(5)、写出反应②的化学方程式:。
(1)、A的电子式为 , D分子中的官能团名称是。(2)、①的反应类型为 , ③的反应类型为。(3)、写出反应E的结构简式。(4)、乙烯与氢气反应得到乙烷,下列物质与乙烷互为同系物的有____。(填字母)A、CH2=CH2 B、HOCH2CH2OH C、CH3CH2CH3 D、CH3-CH2--CH3(5)、写出反应②的化学方程式:。 -
3、 短周期元素W、X、Y、Z的原子序数依次增大。W是地壳中含量最高的元素,Z的次外层电子数是最外层电子数的2倍,常温下,Y的单质遇浓硝酸时会发生钝化,X的质子数比Y的少2。下列说法正确的是( )A、金属性:X<Y B、化合物ZW2中仅含共价键 C、原子半径:Z>Y>X>W D、Y2W3为碱性氧化物
-
4、 从黑铜矿(主要含有Cu2S、FeS和少量SiO2杂质),利用黑铜矿湿法炼铜并制取硫酸亚铁溶液的工艺流程如图:

下列说法错误的是( )
A、黑铜矿在“高温煅烧”前需要经过粉碎处理 B、“高温煅烧”时,矿石中的硫元素被氧化 C、酸浸时,稀硫酸也可以用稀盐酸代替 D、固体X可以为铁粉,试剂Y可以为CuSO4溶液 -
5、 丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是( )A、能与乙醇在一定条件下发生酯化反应 B、能与溴水发生取代反应 C、能与新制的Cu(OH)2悬浊液反应 D、能通过加成聚合反应生成高分子化合物
-
6、 下列说法中正确的是( )
①石油裂化得到的汽油是纯净物;
②石油裂解能得到乙烯,乙烯是生产聚乙烯的原料;
③天然气是一种清洁的化石燃料;
④用酸性高锰酸钾溶液可以鉴别乙烯和甲烷气体;
⑤煤的干馏是物理变化。
A、①②③ B、①③④ C、③⑤ D、②③④ -
7、 如图为某锌-铜原电池示意图。下列说法正确的是( )
 A、电子由铜片通过导线流向锌片 B、溶液中的Cu2+向铜电极移动 C、负极电极反应式: D、电路中每转移0.2mol电子,理论上电解质溶液的质量增加6.5g
A、电子由铜片通过导线流向锌片 B、溶液中的Cu2+向铜电极移动 C、负极电极反应式: D、电路中每转移0.2mol电子,理论上电解质溶液的质量增加6.5g -
8、 在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如图所示。下列有关说法正确的是( )
 A、t1时刻,反应逆向进行 B、t2时刻,正反应速率大于逆反应速率 C、t3时刻,达到反应进行的限度 D、t4时刻,反应处于平衡状态,反应停止
A、t1时刻,反应逆向进行 B、t2时刻,正反应速率大于逆反应速率 C、t3时刻,达到反应进行的限度 D、t4时刻,反应处于平衡状态,反应停止 -
9、 下列实验操作、现象及得出的结论均正确的是( )
选项
实验操作和现象
实验结论
A
碳和浓硫酸加热所得气体产物依次通过品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊
气体产物中含有和
B
向溶液X中滴加稀溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝
溶液X中无
C
向酸性高锰酸钾溶液加入适量的氯化亚铁溶液,酸性高锰酸钾溶液褪色
具有还原性
D
将浓硫酸滴入蔗糖中并搅拌,得到黑色蓬松的固体,并产生刺激性气味的气体
浓硫酸体现了脱水性和强氧化性
A、A B、B C、C D、D -
10、 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过如下反应制得:。下列对该反应的说法正确的是( )A、氮化硅中氮元素化合价为+3价 B、该反应的氧化剂是SiO2和N2 C、该反应的还原剂为C单质 D、上述反应中每生成1molSi3N4转移24mol电子
-
11、 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标况下4.48LCH3CH2OH所含的分子数为0.2NA B、56g铁粉与1molCl2充分反应,转移的电子数为3NA C、0.1molNa2O2固体中含有的离子数目为0.3NA D、1molCl2与足量的NaOH溶液反应,转移的电子数为2NA
-
12、 下列离子方程式书写正确的是( )A、铁片插入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ B、往BaCl2溶液中通入少量的CO2: C、铜与稀硝酸反应:3Cu+2NO-+8H+═3Cu2++2NO↑+4H2O D、一小块金属Na投入水中:Na+H2O═Na++OH-+H2↑
-
13、 下列各组离子在溶液中一定能够大量共存的是( )A、在强酸性溶液中:K+、HCO3-、SO42-、Cl- B、在含有大量OH-的溶液中:NO3-、Na+、Cl-、[Al(OH)4]- C、在含有大量SO42-的溶液中:Ba2+、Na+、Cu2+、Cl- D、在含有大量Fe2+的溶液中:OH-、Na+、Cl-、NO3-
-
14、 下列表示相关微粒的化学用语正确的是( )A、Cl-的结构示意图:
 B、氯化氢的电子式为:H+[
B、氯化氢的电子式为:H+[ ]-
C、碳酸钾的电离方程式K2CO3=2K++CO32-
D、中子数为9的氮原子:N
]-
C、碳酸钾的电离方程式K2CO3=2K++CO32-
D、中子数为9的氮原子:N
-
15、 将下列各组物质分类正确的是( )A、酸:硫酸、醋酸、NaHSO4、硝酸 B、同素异形体:金刚石、石墨、C60 C、盐:生石灰、硝酸钾、CaCO3 D、碱:烧碱、纯碱、熟石灰
-
16、 当光束通过下列分散系时,会出现丁达尔效应的是( )A、FeCl3溶液 B、云、雾 C、CuSO4溶液 D、蔗糖溶液
-
17、我国提出2060年前实现碳中和,通过“CO2→高附加值产品”的工艺路线,可有效实现CO2的资源化利用。请回答下列问题:(1)、CO2—CH4通过催化重整反应转化为合成气(CO、H2)时发生下列反应:
水蒸气重整:
水煤气变换:
写出CO2—CH4通过催化重整反应的热化学方程式 , 该反应在(填“高温”、“低温”或“任意温度”)下能自发进行。
(2)、CO2在一定条件下催化加氢生成CH3OH,主要反应如下:反应Ⅰ.
反应Ⅱ.
反应Ⅲ.
在2L恒容密闭容器中充入4.0molCO2和10.6molH2 , 测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:
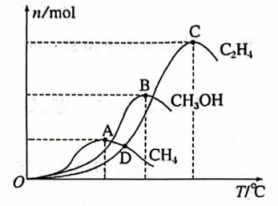
①该催化剂在较低温度时主要选择反应(填“Ⅰ”“Ⅱ”或“Ⅲ”)。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是。
②在一定温度下达到平衡,此时CO2的转化率为70%。测得容器中部分物质的含量为 , 。则该温度下反应Ⅰ的平衡常数(结果保留两位小数)。
③对于上述CO2加氢合成CH3OH的体系,下列说法正确的是(填标号)。
A.增大H2浓度有利于提高CO2的转化率
B.若气体的平均相对分子质量保持不变,说明反应体系已达平衡
C.选用合适的催化剂可以提高CH3OH在单位时间内的产量
(3)、科学家利用电化学装置实现CO2和CH4两种分子的耦合转化,其原理如图所示。若生成的乙烯和乙烷的体积比为2:1,则阳极的电极反应式为。
-
18、我国科学家从甘西鼠尾草分离出的二萜类化合物可用于治疗心血管疾病,目前已实现人工合成,其中间体K的一条合成路线如下.

已知:
(1)、A中官能团的结构简式为。(2)、M的名称为。(3)、E→G的化学方程式为。(4)、Ⅰ为醛类化合物,Ⅰ的结构简式是。(5)、关于H→J的反应: 的羰基相邻碳原子上的C—H键极性强,易断裂,原因是。 (6)、K中有个手性碳原子。(7)、A与H2发生加成反应的有机产物为R。在R的同分异构体中,可发生银镜反应,核磁共振氢谱有4组峰的有机物有种。
的羰基相邻碳原子上的C—H键极性强,易断裂,原因是。 (6)、K中有个手性碳原子。(7)、A与H2发生加成反应的有机产物为R。在R的同分异构体中,可发生银镜反应,核磁共振氢谱有4组峰的有机物有种。 -
19、三苯甲醇[(C6H5)3COH]是一种重要的有机合成中间体,实验室制备流程如下:

已知:
①格氏试剂(RMgBr,R-表示烃基)性质活泼,可与水、卤代烃、醛、酮等物质反应。如:
②ROMgBr可发生水解,产物之一Mg(OH)Br难溶于水。
③几种物质的物理性质如下表:(*表示溴苯与水形成的共沸物沸点)
物质
相对分子质量
沸点(℃)
溶解性
乙醚
74
34.6
微溶于水
溴苯
157
156.2(92.8*)
难溶于水的液体,溶于乙醚
二苯酮
182
305.4
难溶于水的晶体,溶于乙醚
三苯甲醇
260
380.0
难溶于水的晶体,溶于乙醇、乙醚
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的共沸点
实验装置如下(加热及夹持装置略)。

回答下列问题:
(1)、图1中仪器a的名称为。(2)、干燥管内的试剂为。(3)、制备格氏试剂时,加入一小粒碘可加快反应速率,推测I2对反应①活化能的影响是(填“升高”、“降低”或“不变”)。(4)、制备三苯甲醇过程中,饱和NH4Cl溶液与中间产物C反应的离子方程式为;此步骤中不用蒸馏水的目的是。(5)、水蒸气蒸馏能除去溴苯的原因是。(6)、下列说法不正确的是____。A、水蒸气蒸馏结束时,粗产品应在图2的甲装置中 B、水蒸气蒸馏时若出现堵塞,应先撤去热源,再打开活塞K C、得到的粗产品中可能还有少量氯化铵,可选择蒸馏水洗涤 D、重结晶是将粗产品溶于乙醚后,慢慢滴加水,得到颗粒较细的晶体(7)、计算产率:反应中投加1.5g镁屑、7mL溴苯(约0.065mol),10.92g二苯酮,经纯化、干燥后得到10.0g产品,则三苯甲醉的产率是(保留两位有效数字)。 -
20、由铝土矿生产氧化铝的过程中产生的废渣(赤泥)中含有Al2O3、Fe2O3、TiO2和微量的稀土元素化合物。可以通过下列工艺将各金数元素回收利用。(1)、Ⅰ.Al和Fe的回收
焦炭的作用是(填“氧化剂”或“还原剂”)。 (2)、写出锻烧时生成NaAlO2的化学方程式。(3)、Ⅱ.萃取法回收Ti和稀土元素
(2)、写出锻烧时生成NaAlO2的化学方程式。(3)、Ⅱ.萃取法回收Ti和稀土元素
已知:
①萃取剂HA是一种有机弱酸,易溶于有机溶剂,水溶液中能发生电离;
②可以与钛、铁和稀土金属等元素的离子络合,形成易溶于有机溶剂的配合物。
⑥的实验操作名称是。
(4)、HA对钛和铁的萃取率(进入有机相的离子占投料离子的质量分数)随pH变化如图。
ⅰ.结合右图说明⑤通入SO2目的是。
ⅱ.pH<1时,HA对钛的提取率明显降低,结合平衡移动原理解释原因。
ⅲ.提取过程中控制溶液的最佳pH约为。
(5)、写出⑦中有机相中的TiOA2转化成水相中TiO(OH)2沉淀的离子方程式(已知酸性)(6)、该流程中稀土元素可在中富集。(填“水相”或“煤焦油相”)