相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、已知反应: , 将一定量的充入注射器后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
 A、b点的操作为拉伸注射器 B、c点与a点相比,增大,减小 C、d点平衡逆向移动 D、d点与c点相比,混合气体密度更大
A、b点的操作为拉伸注射器 B、c点与a点相比,增大,减小 C、d点平衡逆向移动 D、d点与c点相比,混合气体密度更大 -
2、某温度下,在2L恒容密闭容器中投入一定量的A、B,发生反应: , 12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
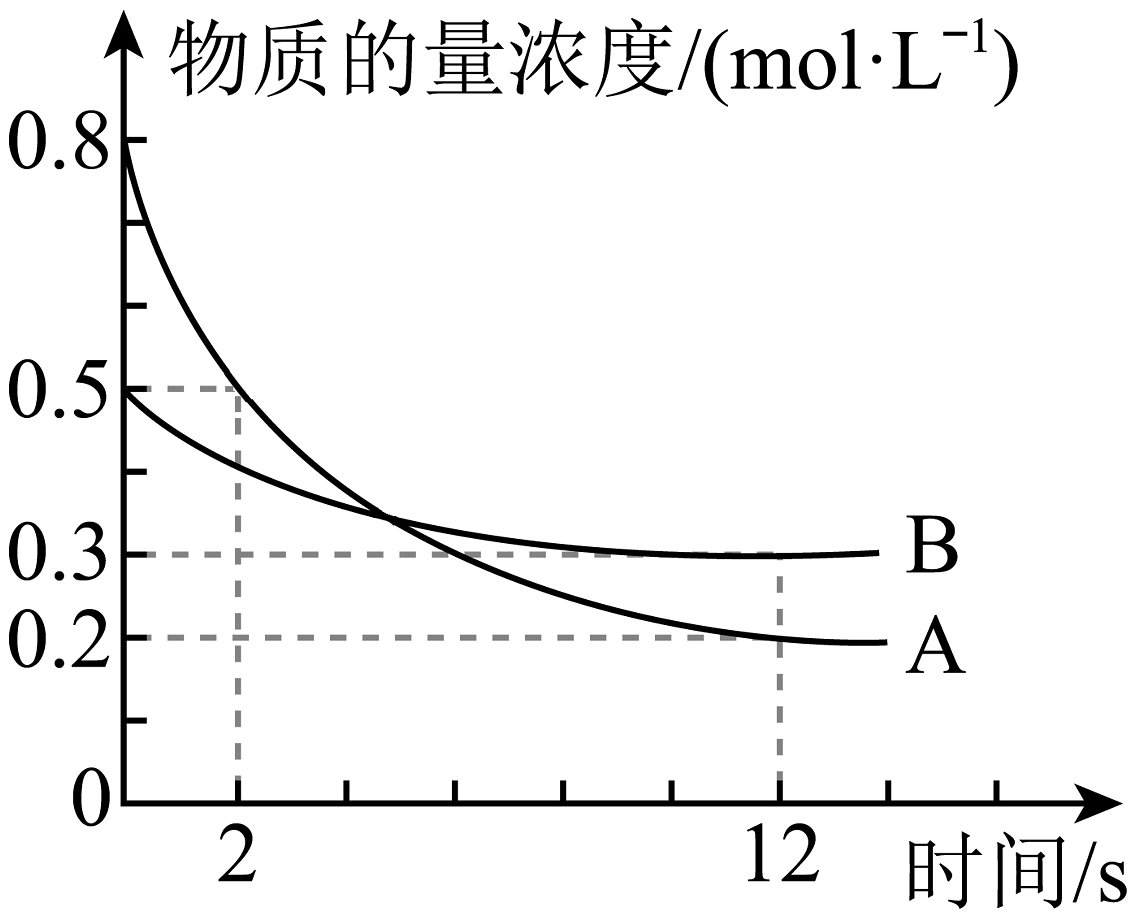 A、0~2s,D的平均反应速率为0.1mol/(L·s) B、化学计量系数之比b:c=1:2 C、12s时,A的转化率为25% D、图中两曲线相交时,A的消耗速率等于A的生成速率
A、0~2s,D的平均反应速率为0.1mol/(L·s) B、化学计量系数之比b:c=1:2 C、12s时,A的转化率为25% D、图中两曲线相交时,A的消耗速率等于A的生成速率 -
3、下列化学实验现象与反应原理的离子方程式均正确且有因果关系的是
选项
化学实验现象
离子方程式
A
加热溶液,得到绿色溶液
(黄色)
B
向2mL重铬酸钾溶液中加入10滴6的硫酸,溶液变黄色
C
混合2mL、0.005mol/L的溶液与KSCN溶液后,继续加入5滴1mol/L的KSCN溶液,混合物体系红色加深
D
向0.1mol·L-¹硫代硫酸钠溶液中加入过量1的硫酸,闻到刺激性气味
A、A B、B C、C D、D -
4、已知: , 下列说法正确的是A、逆反应的活化能大于46.6kJ/mol B、反应生成2mol AB(l)时, C、其他条件不变时,1mol AB(g)在密闭容器中充分分解,反应前后吸收的热量为23.3kJ D、1mol (g)与1mol (g)的化学键键能总和大于2mol AB(g)的化学键键能
-
5、下列化学用语表示正确的是A、乙烯的结构简式: B、的空间填充模型:
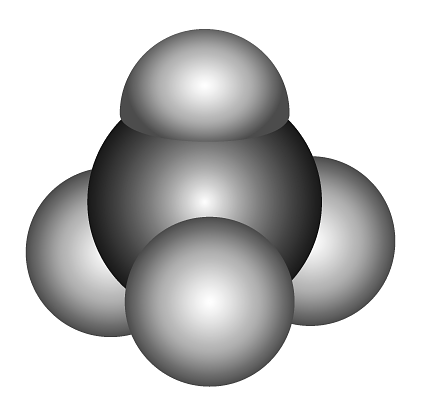 C、HClO的结构式:H—Cl—O
D、羟基的电子式:
C、HClO的结构式:H—Cl—O
D、羟基的电子式:
-
6、2024年9月25日,中国人民解放军火箭军成功发射了一枚搭载训练模拟弹头的洲际弹道导弹。该导弹准确地落入了原定落点——太平洋相关公海海域,圆满完成预定任务。该洲际弹道导弹疑似为东风-31AG型导弹,采用的固体燃料为羟基聚丁二烯,燃料推进剂为高氯酸铵(我国早期的火箭燃料为液体燃料肼、偏二甲肼等)。下列有关说法错误的是A、该导弹固体燃料燃烧时能量转化主要形式为:化学能→热能→机械能 B、该导弹固体燃料羟基聚丁二烯属于有机高分子 C、表示肼燃烧热的热化学方程式为: D、该导弹发动机壳体使用的碳纤维材料属于新型无机非金属材料
-
7、电影《焚城》的创作灵感来自2016年的一则新闻事件,结合1987年巴西戈亚尼亚的灾难事故,提醒公众“洋垃圾”带来的社会现实问题。影片中不法商人为谋取高额利润,将电子垃圾偷偷从国外转卖至香港,导致一个大型垃圾回收场的医疗废弃设备发生放射性物质铯-137的泄漏,引发城市危机。下列说法正确的组合是
①进入高辐射区的人员必须穿防护服,戴防毒面具
②铯-137是质量数为137的一种铯的同位素原子
③铯与钠为同主族元素,预测溶液遇酚酞变红
④可通过用水溶解铯-137消除辐射污染
⑤7.8g 完全溶于水,转移的电子数为0.2(为阿伏加德罗常数的值)
A、①②③ B、①②④ C、①③④ D、①④⑤ -
8、人们在观察客观事物的运动时,必须掌握与运动速率相对应的时间分辨技术。化学家艾哈迈德·泽维尔(A.H。Zewail)开创了“飞秒化学”的新领域,采用了可以分辨分子、原子飞秒级变动图像的激光脉冲技术来测定ICN发生的光分解反应速率,跟踪反应过程,从而获得诺贝尔化学奖。下列说法中,错误的是A、激光脉冲技术能观察化学反应中反应物分子的分解 B、激光脉冲技术能检测化学反应中寿命极短的中间体或过渡态 C、人们通过化学反应可以制造出新物质、新元素 D、化学反应过程一定有能量的变化,有能量变化的过程不一定发生化学反应
-
9、茂名石油化工有限公司是我国生产规模最大的炼油化工企业之一,以石油为原料生产口罩的过程中涉及的下列过程,有一个过程与其他三个的本质不同的是


A.石油催化裂解得到丙烯
B.丙烯催化聚合得到聚丙烯


C.聚丙烯熔融后喷丝压成熔喷布
D.用环氧乙烷对熔喷布进行消毒杀菌
A、A B、B C、C D、D -
10、在给定条件下,下列制备过程涉及的物质转化均可实现的是A、工业制高纯Si: B、侯氏制碱法: C、工业制硝酸: D、海水中提取镁:
-
11、化合物Y是合成治疗过敏性疾病药物的中间体,可由下列反应制得。下列说法正确的是
 A、化合物X既能盐酸反应又能与氢氧化钠反应 B、化合物X与足量的氢气加成后分子中含有3个手性碳原子 C、化合物X中所有碳原子一定共面 D、能用浓溴水检验Y中是否含有X
A、化合物X既能盐酸反应又能与氢氧化钠反应 B、化合物X与足量的氢气加成后分子中含有3个手性碳原子 C、化合物X中所有碳原子一定共面 D、能用浓溴水检验Y中是否含有X -
12、某立方晶系的硫锰矿晶胞,沿c轴将原子投影到ab平面,投影图如下(设代表阿伏加德罗常数的值,括号中c数据为原子在c轴方向的原子坐标)。下列说法错误的是
 A、基态Mn的价电子排布式为 B、晶体中的配位数是6 C、Mn位于晶胞的顶角和面心 D、若晶体密度为 , 则最近的两个硫原子之间的距离为
A、基态Mn的价电子排布式为 B、晶体中的配位数是6 C、Mn位于晶胞的顶角和面心 D、若晶体密度为 , 则最近的两个硫原子之间的距离为 -
13、下列说法正确的是A、在、和组成的平衡体系加压后,混合气体颜色变深,该过程符合勒夏特列原理 B、将溶液蒸干并灼烧可以得到固体 C、向氯水中加入适量 , 可增强漂白效果 D、室温下,用电导率传感器分别测定醋酸和盐酸的电导率大小,可以判断醋酸是否为弱电解质
-
14、某溶液中存在大量的H+、Cl-、SO , 该溶液中还可能大量存在的是( )A、HCO B、Ba2+ C、Ag+ D、Al3+
-
15、太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFePO4LiFePO4+6C。下列说法正确的是
 A、放电时Li+从左边移向右边,从右边移向左边 B、放电时,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4 C、充电时M极连接电源的负极,电极反应式为6C+xe-= D、充电时电路中通过2.0mol电子,产生28gLi
A、放电时Li+从左边移向右边,从右边移向左边 B、放电时,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4 C、充电时M极连接电源的负极,电极反应式为6C+xe-= D、充电时电路中通过2.0mol电子,产生28gLi -
16、
Ⅰ.如图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。

回答下列问题:
(1)“纳米药物分子运输车”分散于水中所得的分散系________(填“属于”或“不属于”)胶体。
(2)“纳米药物分子运输车”的外壳属于有机物。酒精、蔗糖、醋酸这三种有机物中,属于电解质的是________。
(3)纳米级的是一种非常重要的磁性材料。
①铁与水蒸气反应生成 , 反应中每生成转移电子数目为________。
②铁的另外一种氧化物是红棕色粉末,写出其中一项用途________。
Ⅱ.配制的溶液用于洗涤器物。
(4)配制时,应用托盘天平称取的质量为________。某操作步骤如下图所示。

该操作应放在如下图所示的________(填序号)操作之间。

(5)下列说法错误的是_______(填字母)。
A. 称量固体的时间不宜过长 B. 待烧杯中溶液冷却至室温才进行转移 C. 定容时,仰视容量瓶刻度线会使配制的溶液浓度偏高 D. 容量瓶可存放配好的溶液 -
17、
高铁酸钾()是一种新型、高效、多功能水处理剂,且无二次污染。某学习小组设计了如图装置来制备。已知:具有强氧化性,在0~5℃碱性溶液中较稳定,在酸性或中性溶液中易发生反应。

I.氯气的制备:1774年的舍勒用软锰矿粉末(主要成分是)和浓盐酸混合加热制备氯气,该制取氯气的方法已沿用至今。
(1)装置A中发生反应的离子方程式为________。装置B中的试剂为________。
(2)用下列两种方法制取氯气,则所得氯气___________。
①用含氯化氢146克的浓盐酸与足量的二氧化锰反应
②用87克二氧化锰与足量的浓盐酸反应
A. ②比①多 B. ①比②多 C. 一样多 D. 无法比较 II.高铁酸钾()的制备:该方法利用、固体及过量KOH溶液为原料来制备高铁酸钾,且该反应放热。
(3)装置C制备时生成了两种盐,则该反应的化学方程式为:________;本实验表明,在该条件下氧化性:________(填“>”或“<”)。
(4)有同学提出装置C存在一定缺陷,改进的措施是________。
-
18、
在我们生活的多彩世界里,化学物质无处不在。过氧化物是一类特殊的氧化物,如、等广泛应用于生产生活。
I.现用如下图所示实验装置来测定试样(含杂质)的纯度,可供选用的反应物:固体、盐酸、硫酸溶液和蒸馏水。

(1)写出装置D中反应生成的化学方程式:。
(2)写出装置B中可能发生反应的离子方程式:。
(3)装置E的作用为:。
(4)某小组在探究与水反应的实验时,发现与水反应后的溶液可以使酸性溶液褪色,同时放出氧气。查阅资料:与水反应还可生成NaOH与。
①与水生成NaOH与的反应氧化还原反应(填“属于”或“不属于”)。
②为证明有生成,向反应后的溶液中加入(填该物质的化学式),立即产生能使带火星的木条复燃的气体。
II.过氧化钙()是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:不溶于水,在0℃时稳定。其制备工艺如下:

(5)上图中“沉淀”时发生的化学方程式是。
-
19、工业生产纯碱的工艺流程如图:
 (1)、为除去粗盐水中的、、等杂质离子,加入试剂顺序合理的是___________。A、碳酸钠、氢氧化钠、氯化钡 B、碳酸钠、氯化钡、氢氧化钠 C、氢氧化钠、碳酸钠、氯化钡 D、氯化钡、氢氧化钠、碳酸钠(2)、“侯氏制碱法”工艺中先氨化后碳酸化的目的是:。(3)、碳酸化后过滤时,所需的玻璃仪器有:;检验滤液A中主要阴离子的具体方法是:。(4)、部分盐的溶解度曲线如下图,溶解度曲线图中碳酸氢钠的溶解度在60℃后无数据的原因是:。
(1)、为除去粗盐水中的、、等杂质离子,加入试剂顺序合理的是___________。A、碳酸钠、氢氧化钠、氯化钡 B、碳酸钠、氯化钡、氢氧化钠 C、氢氧化钠、碳酸钠、氯化钡 D、氯化钡、氢氧化钠、碳酸钠(2)、“侯氏制碱法”工艺中先氨化后碳酸化的目的是:。(3)、碳酸化后过滤时,所需的玻璃仪器有:;检验滤液A中主要阴离子的具体方法是:。(4)、部分盐的溶解度曲线如下图,溶解度曲线图中碳酸氢钠的溶解度在60℃后无数据的原因是:。
-
20、分类是认识和研究物质及其变化的一种常用的科学方法。现有以下物质:
①②液氯③固体④硫酸⑤酒精⑥食盐水⑦铁⑧熔融硫酸钡⑨小苏打
(1)、是国际公认的高效安全灭菌消毒剂之一、能被水吸收制备次氯酸(HClO),其化学反应方程式为:;故从物质分类的角度看,属于(填“酸性氧化物”或“碱性氧化物”)。(2)、以上属于电解质的有(填序号,下同);属于非电解质有;上述条件下能导电的物质有。(3)、请写出③在水溶液中的电离方程式:。