相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、下列化学反应表示正确的是A、铅蓄电池放电时的负极反应式为;Pb-2e-=Pb2+ B、已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol C、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ/mol,则0.5L1mol/L的氨水与足量稀盐酸完全中和,放出的热量大于28.7 kJ D、以硫酸为电解质,通过催化电解可将N2转化为N2H4的阴极反应:N2+4H++4e-=N2H4
-
2、利用甲烷可以除去SO3 , 反应为8SO3(g)+6CH4(g)S8(g)+6CO2(g)+12H2O(g)。下列说法正确的是A、上述反应的△S<0 B、上述反应的化学平衡常数K= C、及时分离出H2O(g),正反应速率增大,平衡向正反应方向移动 D、上述反应中生成1molS8 , 转移电子的数目约为48×6.02×1023
-
3、全世界每年钢铁因锈蚀造成大量的损失,某城市拟用如图所示方法保护埋在弱碱性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
 A、钢质管道易被腐蚀是因为在潮湿的土壤中形成了原电池 B、这种方法称为牺牲阳极的阴极保护法 C、钢管上的电极反应式:O2+2H2O+4e-=4OH- D、也可用外接直流电源保护钢管,直流电源负极连接金属棒X
A、钢质管道易被腐蚀是因为在潮湿的土壤中形成了原电池 B、这种方法称为牺牲阳极的阴极保护法 C、钢管上的电极反应式:O2+2H2O+4e-=4OH- D、也可用外接直流电源保护钢管,直流电源负极连接金属棒X -
4、下列事实不能用勒夏特列原理解释的是A、工业上生产硫酸时,充入过量的空气以提高SO2的转化率 B、对CO(g)+NO2(g)CO2(g)+NO(g),达到平衡后,增大压强可使颜色变深 C、实验室可用排饱和食盐水的方法收集氯气 D、溴水中有化学平衡Br2+H2OHBr+HBrO,当加入少量AgNO3溶液后,溶液的颜色变浅
-
5、“碳达峰、碳中和”是我国社会发展重大战略之一。与经催化重整可制得CO和 , 相关反应为:
主反应:
副反应:Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.
其中,副反应Ⅱ、Ⅲ、Ⅳ形成的积碳易导致催化剂活性降低。
(1)、主反应的。(2)、的还原能力(R)可衡量转化效率,(同一时段内与的物质的量变化量之比)。常压下,将和按物质的量之比1:3投料,反应相同时间,和的转化率随温度变化如图所示。
①的转化率在800℃时远大于400℃时的原因是。
②400~600℃时,R值的变化情况为。
③1000℃时R值为(写出计算过程)。
(3)、在Pt-Ni合金或Sn-Ni合金催化下脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质)。
从化学反应速率角度分析,脱氢反应选择的催化剂为(填“Pt-Ni合金”或“Sn-Ni合金”),理由是。
(4)、催化与重整反应的路径甲和乙如图所示。研究表明,在催化剂中掺入可产生更多的氧空位,生成更多的可流动 , 能有效减少催化剂的积碳生成。①路径甲、乙中生成的不同中间产物为(填化学式)。
②反应路径中,减少催化剂积碳的反应为。

-
6、亚硝酰硫酸(NOSO4H)是有机合成中的常见试剂,常用于制造医药和染料。(1)、NOHSO4晶体是由NO+和硫酸氢根两种离子构成,NOHSO4易溶解在浓硫酸中,溶于水时会生成H2SO4、HNO3和NO。
①写出NOHSO4与水反应的化学方程式。
②每1molNOHSO4与水完全反应时转移电子的物质的量为。
(2)、实验室可以用如图所示装置制取亚硝酰硫酸溶液。装置Ⅰ制取SO2 , 装置Ⅲ用于制取亚硝酰硫酸。
①质量分数为70%,其密度为1.6g/cm-3的硫酸的物质的量浓度为mol/L(结果保留1位小数)。
②装置Ⅲ中使用20℃的冷水浴可以防止HNO3分解。若不使用冷水浴,实验中可观察到的现象是。
③碱石灰的作用。
(3)、可通过如下实验测定所得亚硝酰硫酸固体样品的质量分数。步骤Ⅰ:称取0.400g亚硝酰硫酸样品于锥形瓶中,加入22mL0.1000mol/LKMnO4溶液和少量稀硫酸,充分反应后溶液为紫红色;
步骤Ⅱ:向步骤Ⅰ所得溶液中滴加0.1000mol/LNa2C2O4标准溶液与过量的KMnO4溶液反应,恰好完全应时消耗Na2C2O4标准溶液25mL。滴定过程中发生反应:2+5+16H+=2Mn2++10CO2↑+8H2O。
①步骤Ⅰ反应后有Mn2+和等生成。写出NO+所发生反应的离子方程式:。
②计算亚硝酰硫酸样品的纯度(写出计算过程)。
-
7、铝是应用广泛的金属。以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)、“碱溶”时生成四羟基合铝酸钠Na[Al(OH)4]的离子方程式为。(2)、向“过滤所得滤液中加入NaHCO3溶液,生成Na2CO3和Al(OH)3 , 加入NaHCO3后溶液的pH(填“增大”、“不变”或“减小”)。已知:pH=-1gc(H+)。(3)、“电解”是电解熔融Al2O3 , 电解过程中作阳极的石墨易消耗,原因是。(4)、“电解”是电解Na2CO3溶液,原理如图所示。①阳极的电极反应式为 , ②阴极产生的物质A的化学式为。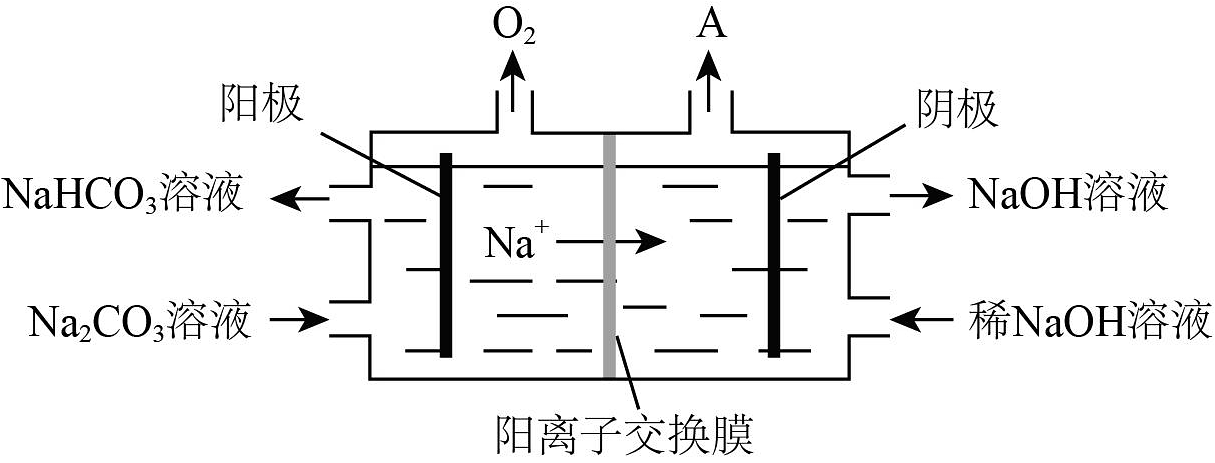 (5)、铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是。
(5)、铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是。 -
8、以软锰矿浆(主要成分MnO2 , 杂质为Fe、Al等元素的氧化物)和烟气(含有SO2、O2等)为原料可制备Mn2O3。(1)、向一定量软锰矿浆中匀速通入烟气,软锰矿浆能吸收烟气中SO2生成MnSO4 , 测得溶液中c(H2SO4)、c(MnSO4)随时间的变化如图所示。

随着吸收时间增加,溶液中c(H2SO4)的增加呈现由慢到快的趋势,其主要原因是。
(2)、常温下,向吸收后的混合溶液中增加c(H+)为1×10-10mol/L的氨水进行除杂。已知Kb(NH3·H2O)=1.8×10-5 , 该氨水的浓度为Y。(3)、向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀。①该过程的离子方程式是。
②将过滤得到的滤液蒸发浓缩、冷却结晶,可得到的晶体为(填化学式)。
③在氧气气氛中加热分解MnCO3 , 测得加热升温过程中固体的质量变化如图所示。加热分解MnCO3制备Mn2O3 , 需要控制的温度为。

-
9、室温下,下列实验探究方案能达到相应探究目的的是
选项
探究方案
探究目的
A
用电导率传感器分别测定等体积的CH3COOH溶液和盐酸的电导率,比较溶液的导电性强弱
探究CH3COOH是否为弱电解质
B
向圆底烧瓶中加入2.0gNaOH、15mL无水乙醇、碎瓷片和5mL1-溴丁烷,微热。将产生的气体通入酸性KMnO4溶液中,观察现象
探究1-溴丁烷的消去产物
C
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,观察溶液颜色变化
探究H2O2与Fe3+的氧化性强弱
D
以Zn、Fe为电极,以酸化的3%NaCl溶液作电解质溶液,连接成原电池装置,过一段时间,从Fe电极区域取少量溶液于试管中,检验是否存在Fe2+
探究金属的电化学保护法
A、A B、B C、C D、D -
10、根据下列图示所得出的结论正确的是
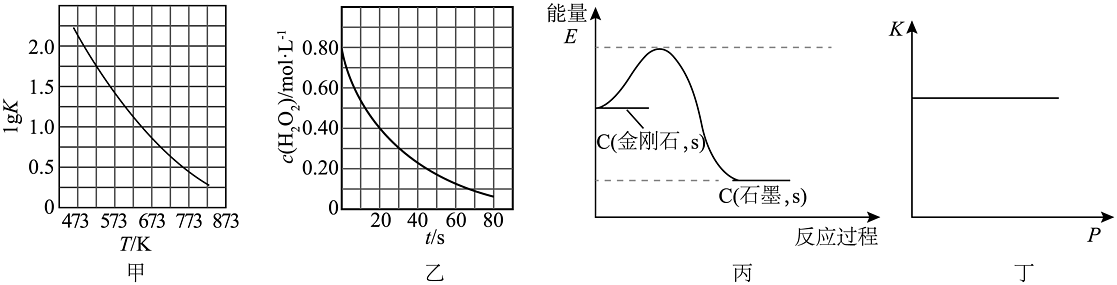 A、图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0 B、图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C、图丙为C(金刚石,s)=C(石墨,s)△H=-1.9kJ·mol-1反应过程的能量变化曲线,说明金刚石比石墨稳定 D、图丁是一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应反应前后气体体积一定不变
A、图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0 B、图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C、图丙为C(金刚石,s)=C(石墨,s)△H=-1.9kJ·mol-1反应过程的能量变化曲线,说明金刚石比石墨稳定 D、图丁是一定温度时某反应的平衡常数K随压强增大而保持不变,说明该反应反应前后气体体积一定不变 -
11、活性Fe3O4-x催化反应H2(g)+(aq)=HCOO-(aq)+H2O(l)的部分机理如图所示。下列说法正确的是
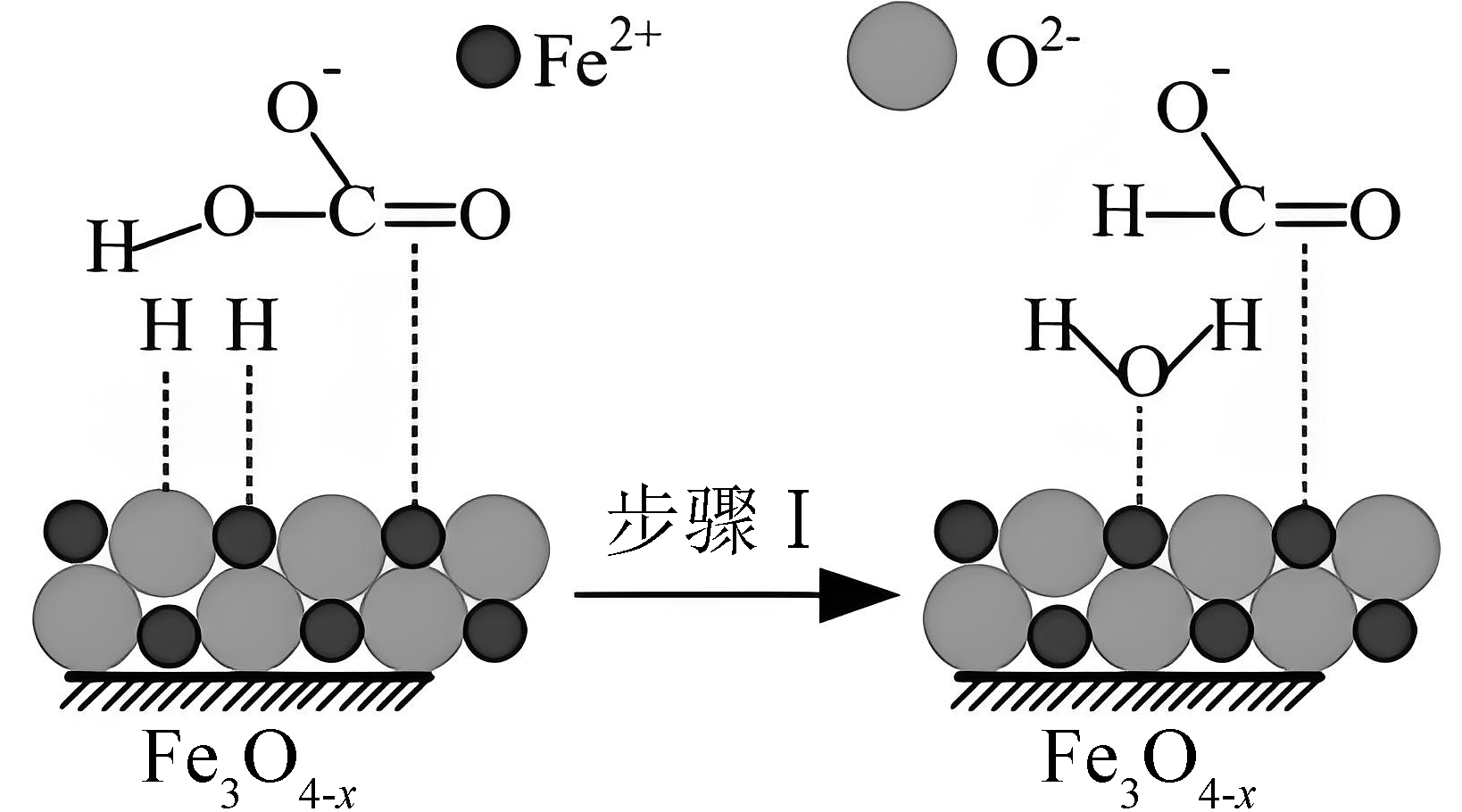 A、该反应的△H>0 B、该反应平衡常数K= C、反应前后碳原子被还原 D、步骤I中,吸附在Fe2+表面的H+与中的羟基结合生成水
A、该反应的△H>0 B、该反应平衡常数K= C、反应前后碳原子被还原 D、步骤I中,吸附在Fe2+表面的H+与中的羟基结合生成水 -
12、在给定条件下,下列物质转化或方程式正确的是A、工业制漂白粉:MnO2Cl2Ca(ClO)2 B、工业制FeCl3:Cl2HCl FeCl3 C、KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3+4OH-=2+3Cl-+5H2O D、电解饱和食盐水:2Cl-+2H+H2↑+Cl2↑
-
13、阅读下列材料,完成下面小题。
催化反应广泛存在,如植物光合作用、合成氨、CH4和H2O重整制H2和CO、工业尾气中NH3的无害化处理、SO2的催化氧化[SO2(g)和O2(g)生成1molSO3(g)放出98.3kJ的热量]等。催化剂有选择性,如酸性条件下锑电催化还原CO,生成HCOOH的选择性大于CO。非均相催化通常指催化剂与反应物处于不同聚集状态的催化反应,反应在催化剂表面进行,主要包括吸附、反应、脱附等过程。
(1)、下列说法不正确的是A、植物光合作用过程中,酶能增大该反应的活化分子百分数 B、H2O2制O2反应中,Fe3+能加快化学反应速率 C、酸性条件下锑电催化还原CO2生成两种产物的速率:v(CO)>v(HCOOH) D、铁触媒催化合成氨的反应属于非均相催化(2)、下列化学反应表示不正确的是A、CH4和H2O催化重整制H2和CO:CH4+H2OCO+3H2 B、工业尾气中NH3的无害化处理:4NH3+5O24NO+6H2O C、锑电催化还原CO2生成HCOOH的阴极反应:CO2+2e-+2H+=HCOOH D、SO2的催化氧化:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ/mol(3)、下列有关反应描述正确的是A、合成氨温度选择400~500℃的重要原因之一是铁触媒在该温度范围内活性大 B、浓硫酸催化下,CH3CH218OH与CH3COOH的酯化反应产物中可检测到 C、乙醛催化加氢反应中,H2在催化剂Ni表面吸附过程的△S>0 D、SO2转化为SO3时,加入催化剂能减小该反应的焓变 -
14、在世界首创的人工合成淀粉反应中使用了多种生物酶。下列有关酶的说法不正确的是A、酶通常是一种羧酸 B、酶的催化条件通常较温和 C、酶催化反应具有效率高的特点 D、酶在重金属盐作用下会失去活性
-
15、实验室模拟侯氏制碱法制备 , 下列装置与原理均正确的是
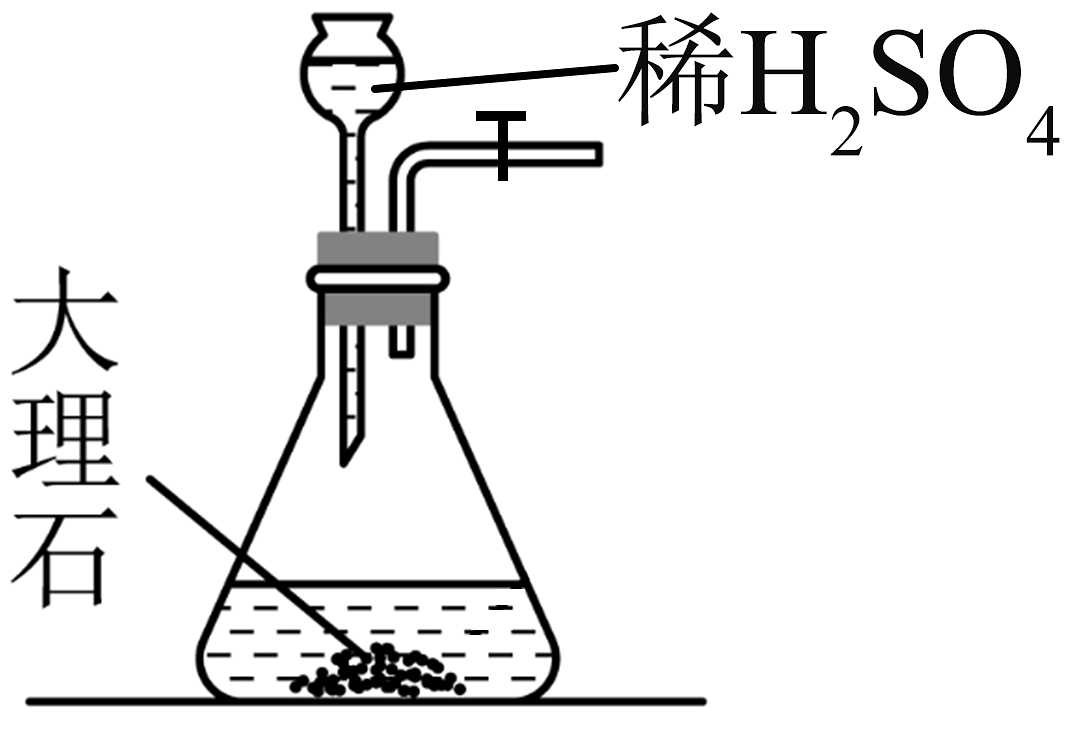

A.制取
B.制取
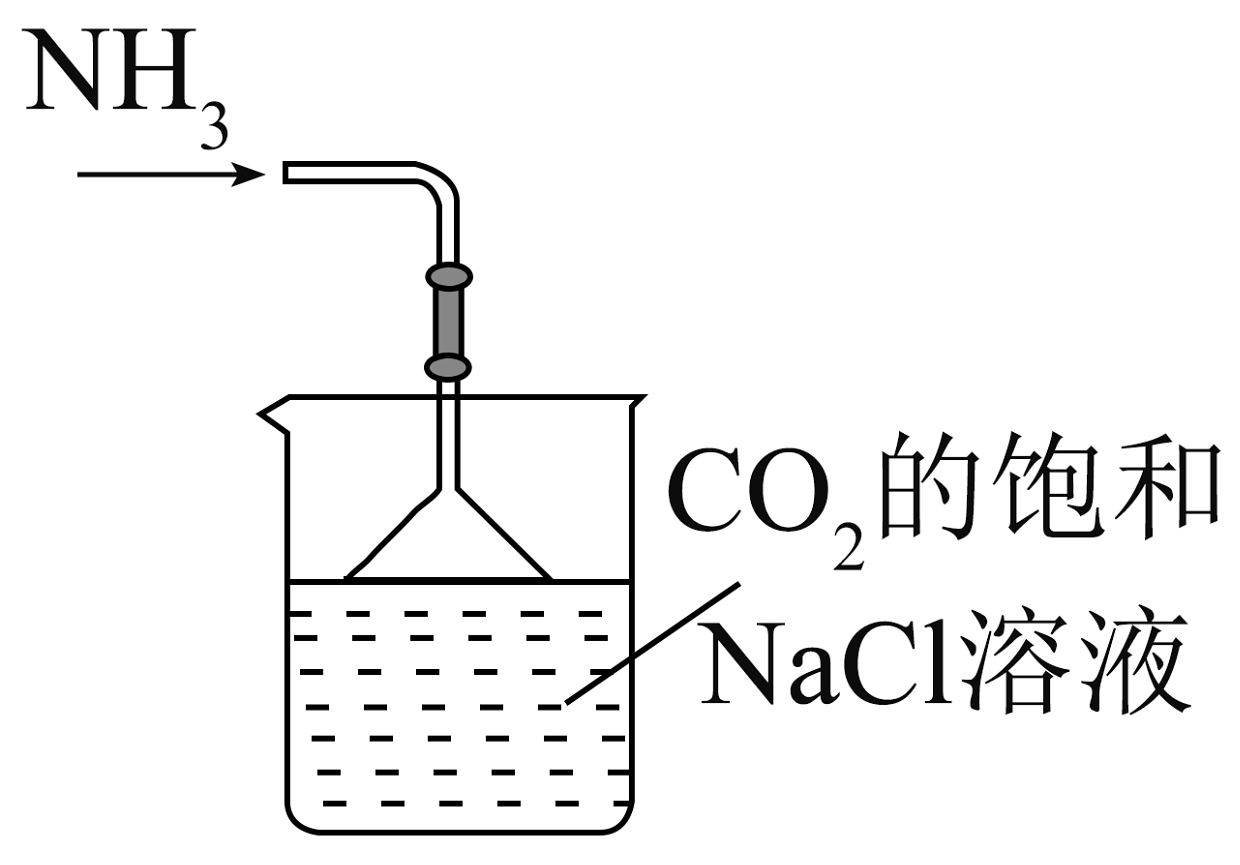

C.制取
D.制取
A、A B、B C、C D、D -
16、淮安十四五规划提出建设“美丽淮安”。下列做法不应该提倡的是A、大力发展化石能源经济 B、积极鼓励植树造林 C、将二氧化碳转化为化工产品 D、养成低碳生活习惯
-
17、高铁酸钠(Na2FeO4)是一种新型水处理剂,Na2FeO4只能在强碱性条件下稳定存在,主要用于饮用水处理。制备高铁酸钠有多种方法,其中一种方法的实验流程如下:

请回答下列问题。
(1)、过程1所得NaClO溶液中需要加入NaOH固体,其目的是。(2)、过程2中所发生反应的化学方程式为。(3)、过程3中所发生反应的离子方程式如下:_____ClO-+___Fe3++___OH-→_____+_____Cl-+____H2O
①请将上述离子方程式配平 , 并用双线桥表示电子转移的方向和数目。
②一个完整的氧化还原反应往往可以拆成两个半反应,一个为“氧化半反应”,另一个为“还原半反应”,两个半反应可以通过叠加得到总反应。如Zn+Cu2+=Zn2++Cu的氧化半反应为Zn-2e-=Zn2+ , 还原半反应为Cu2++2e-=Cu。则上述离子方程式对应的氧化半反应为(请将化学计量数化为最简整数比)。
(4)、高铁酸钠处理水的原理如图所示。Na2FeO4是一种多功能水处理剂的原因为。
-
18、某学习小组探究潮湿的与反应的产物,进行如图实验:

请回答:
(1)、试剂X是其作用是。装置中,盛放的仪器名称;该实验中收集氯气用的是法。(2)、写出氯气进入装置E发生反应的化学方程式。(3)、装置C中潮湿的与以等物质的量反应,生成、气体和NaCl,试写出该反应化学方程式。(4)、若将上述装置中的C、D、E部分换成如图所述装置,其中Ⅰ与Ⅲ是干燥的有色布条,Ⅱ和D中装入的物质是干燥剂(干燥剂不吸收),E中盛装NaOH溶液,请回答下列问题:一段时间后,可观察到的现象是 , 对比Ⅰ与Ⅲ中现象的差异可得出的结论是。 (5)、标准状况下,将17.4克与足量的浓盐酸溶液共热产生的体积为升(标准状况)。写出计算过程。
(5)、标准状况下,将17.4克与足量的浓盐酸溶液共热产生的体积为升(标准状况)。写出计算过程。 -
19、物质的量是一个联系宏观和微观的重要物理量。设NA为阿发加德罗常数的值,回答下列问题。(1)、同温同压下,A2气体与B2气体化合,生成AxBy气体(其中x、y都为整数),已知反应前后气体的密度不变,则AxBy的分子式为。(2)、已知Mm+的电子数为a,M的质量数为A,则2molM的中子数为。(3)、对于反应Zn+2HCl=ZnCl2+H2↑,将6.5gZn放入200mL2mol/L的盐酸中充分反应后,溶液中大量存在的离子有(用离子符号表示)。(4)、某混合物由NaCl、MgCl2、AlCl3组成,已知Na、Mg、Al三种元素的质量之比为46:12:27,则含1.2molCl-的该混合物中,MgCl2的质量为。(5)、将0.2mol/LNaCl和0.1mol/LCaCl2溶液等体积混合(忽略混合后溶液体积的变化),则该混合溶液中c(Cl-)=mol/L。(6)、针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取次氯酸钠(NaClO)含量为14.9g/L的84消毒液1mL加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为mol/L。(7)、有0.4g铁的氧化物,用足量CO在高温下将其还原,把生成的CO2全部通入足量的澄清石灰水中得到0.75g固体沉淀物,这种铁的氧化物的化学式为。(8)、将工业废渣中的铁元素提取,经过一系列步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁元素的质量分数:准确称取样品3.000g,置于250mL雒形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Fe3+和Sn2+以物质的量1:1反应,将Fe3+转化为Fe2+),充分反应后,除去过量的SnCl2.用5.000×10-2mol/LK2Cr2O7溶液滴定至终点(反应过程中与Fe2+以物质的量1:6反应生成Cr3+和Fe3+外,消耗K2Cr2O7溶液22.00mL。计算该样品中铁元素的质量分数(写出计算过程)。
-
20、废旧CPU中的金(Au)、银(Ag)和铜(Cu)回收的部分流程如下:

已知:HAuCl4=H++。下列说法正确的是
A、“酸溶”时加入的硝酸可以换成硫酸 B、“过滤”所得滤液直接弃用 C、用浓盐酸和NaNO3也可以溶解金 D、用过量Zn粉将1molHAuCl4完全还原为Au,参加反应的Zn为1.5mol