相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、几种常见物质的转化如图所示(条件省略)。下列推断正确的是
 A、若化合物2是淡黄色固体,化合物3为氧化物,则化合物4一定是碱 B、若单质1为黑色粉末,化合物2能使石灰水变浑浊,则化合物1能溶于水 C、若反应(1)和(2)是氧化还原反应,则反应(3)一定也是氧化还原反应 D、若化合物2为酸性氧化物,化合物4为盐,则化合物3可能是碱性氧化物
A、若化合物2是淡黄色固体,化合物3为氧化物,则化合物4一定是碱 B、若单质1为黑色粉末,化合物2能使石灰水变浑浊,则化合物1能溶于水 C、若反应(1)和(2)是氧化还原反应,则反应(3)一定也是氧化还原反应 D、若化合物2为酸性氧化物,化合物4为盐,则化合物3可能是碱性氧化物 -
2、研究发现,牛磺酸是影响动物健康、长寿的关键因素,牛磺酸的结构如图所示。牛磺酸结构中的五种短周期主族元素的原子序数之和为38,R和Z原子最外层电子数相等。下列叙述正确的是
 A、W位于第三周期第VA族 B、原子半径: C、W、X、Z不可能形成离子化合物 D、与能发生反应生成单质R
A、W位于第三周期第VA族 B、原子半径: C、W、X、Z不可能形成离子化合物 D、与能发生反应生成单质R -
3、一种水性电解液电池如图所示,关于该电池放电时的叙述正确的是

已知:KOH溶液中,只存在一种含铝粒子。
A、室2中可能向室1中迁移 B、一段时间后,室2中可能不变 C、一段时间后,室3电解质溶液pH增大 D、铝电极上的电极反应为 -
4、下列操作、现象和结论均正确且有相关性的是
选项
操作、现象
结论
A
向酸性高锰酸钾溶液中通入 , 溶液褪色
表现还原性
B
向紫色石蕊溶液中持续通入 , 溶液变为无色
表现漂白性
C
向溶液腐蚀铜版的废液中滴加氨水,产生红棕色沉淀
该废液中含
D
将粗乙烯气体通入酸性溶液中,溶液褪色
乙烯中一定含有
A、A B、B C、C D、D -
5、在不同的条件下,向不同的密闭容器中通入 , 只发生反应:。测得丁烷的浓度()随反应时间(min)的变化如下表(表中浓度、时间单位已省略)。下列说法正确的是
实验序号
时间
浓度
温度/
0
5
10
15
20
25
30
1
3.0
2.4
2.08
1.80
1.62
1.50
1.50
2
3.0
2.0
1.68
1.52
1.50
1.50
1.50
3
3.0
1.60
1.18
1.0
1.0
1.0
1.0
A、 B、实验1使用了催化剂,实验2未使用催化剂 C、实验2中内 D、实验3中丁烷的平衡转化率约为 -
6、下列离子方程式中正确的是A、在足量烧碱溶液中氯气发生歧化反应: B、将氯气通入溶液中: C、能证明氧化性的反应: D、次氯酸钠与亚硫酸钠反应:
-
7、Liepatoff规则:胶核总选择性吸附与其本身组成相似的离子形成胶粒。硅胶在生产、生活中有广泛应用。硅胶溶液的组成如图,下列叙述正确的是
 A、硅胶溶液的胶团不带电荷,硅胶胶粒带负电荷 B、溶于水形成的硅胶粒子数为 C、硅胶溶液可以用于自来水的消毒和净化 D、该胶粒中,表面离子数目一定大于束缚反离子数目
A、硅胶溶液的胶团不带电荷,硅胶胶粒带负电荷 B、溶于水形成的硅胶粒子数为 C、硅胶溶液可以用于自来水的消毒和净化 D、该胶粒中,表面离子数目一定大于束缚反离子数目 -
8、良渚古城被誉为“中华第一城”。良渚古城遗址的出土器物包括玉器、陶器、石器、漆器、竹木器、骨角器等,数量达1万多件。下列有关叙述错误的是A、玉器的主要成分是硅酸盐 B、制作陶器的主要原料是黏土 C、骨角器和竹木器中均只含无机物 D、漆器具有抗腐蚀性能
-
9、用烟气中SO2制S是一种重要的脱硫技术。(1)、用电解法将 SO2转化为S的原理如图所示。
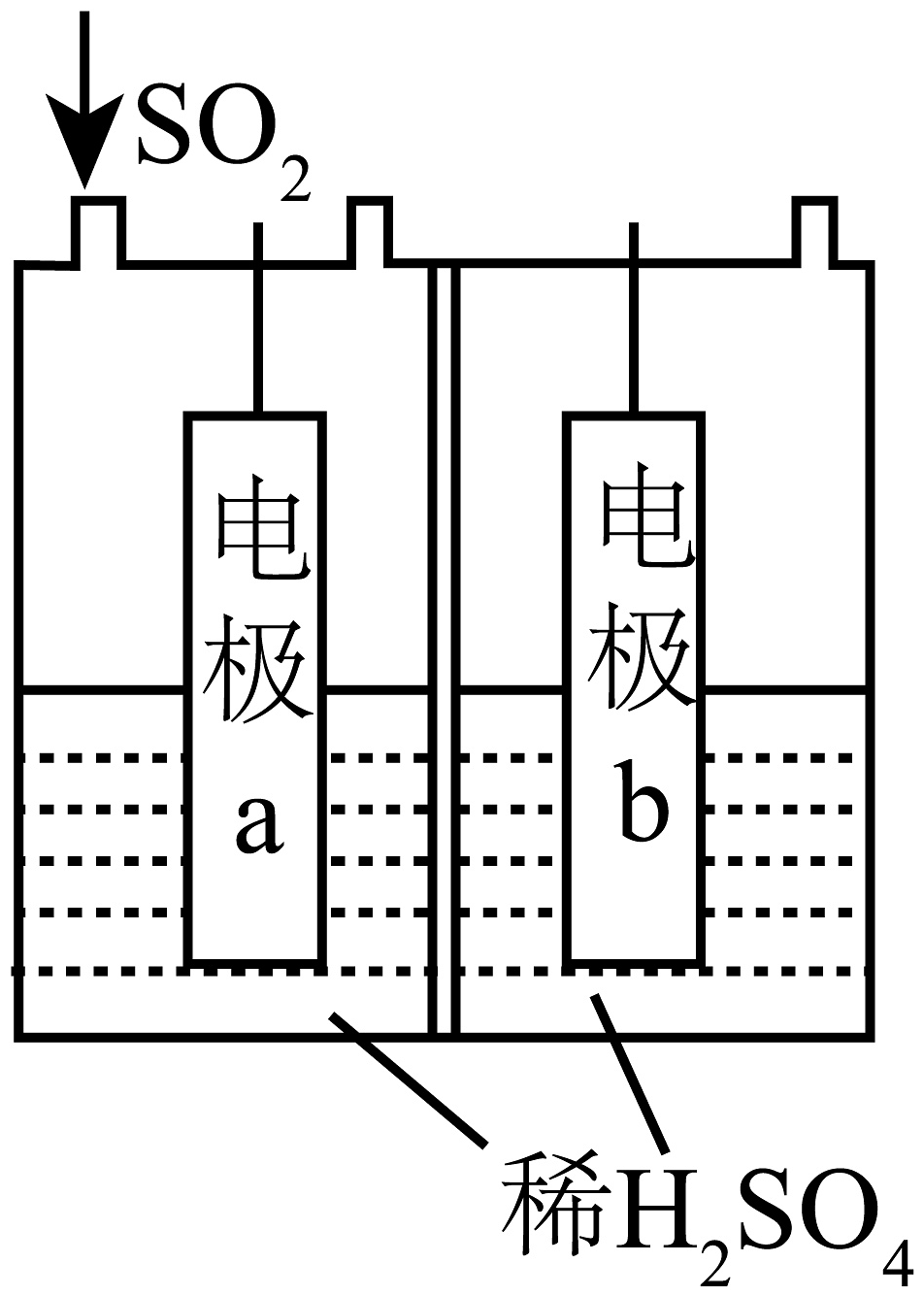
电极a表面的电极反应式为。随稀硫酸的浓度增大,SO2转化率先增大后减小的可能原因为。
(2)、利用乙烯与 SO2反应制S的机理如图所示,Cu+的基态核外电子排布式 , 此过程总反应的化学方程式为。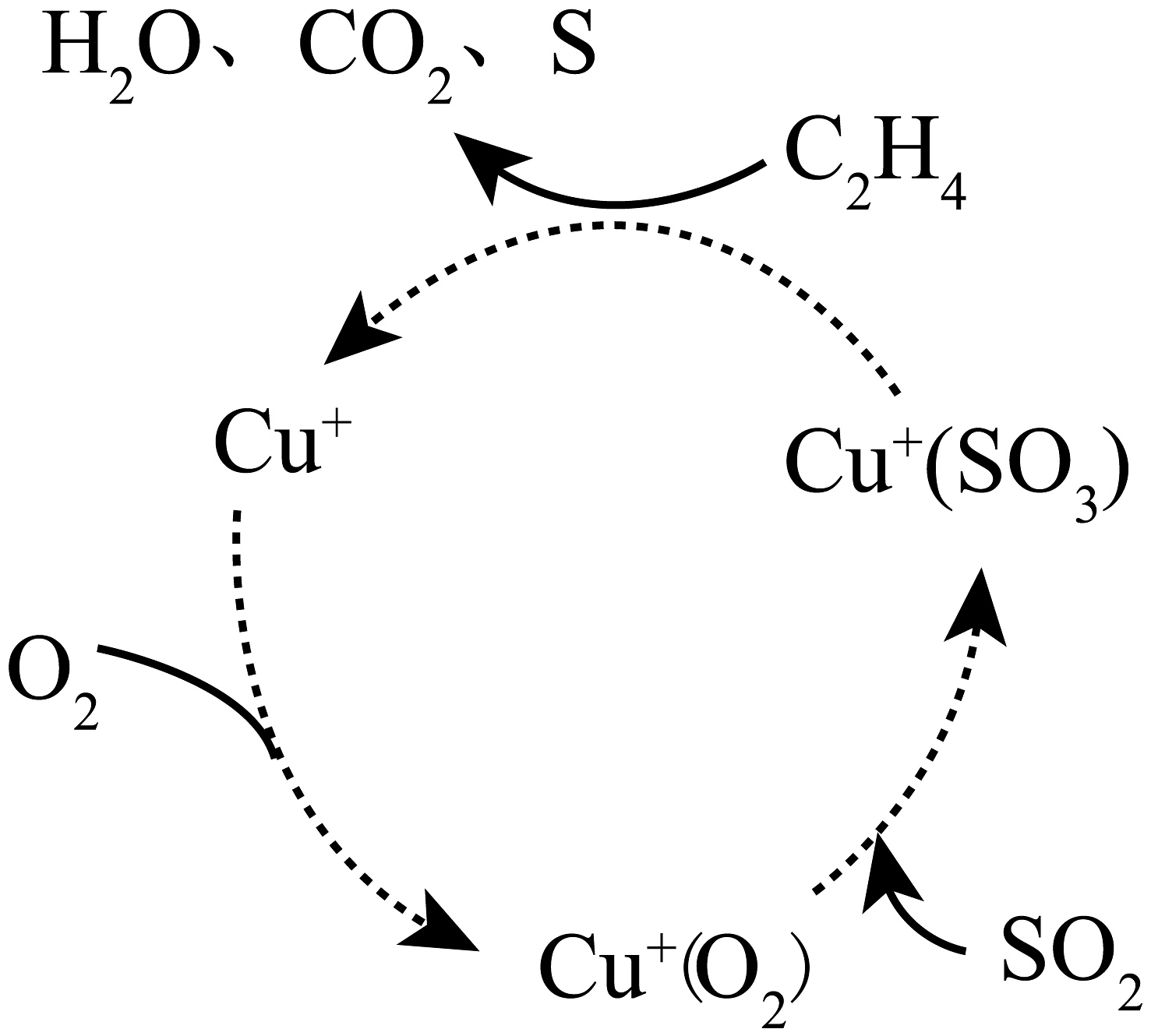 (3)、H2S与SO2在盐溶液中反应制备S,该过程生成含S 悬浮颗粒的悬浊液,含S 悬浮颗粒带负电。 SO2(g)+2H2S(g)3S(s)+2H2O(l) ΔH<0。
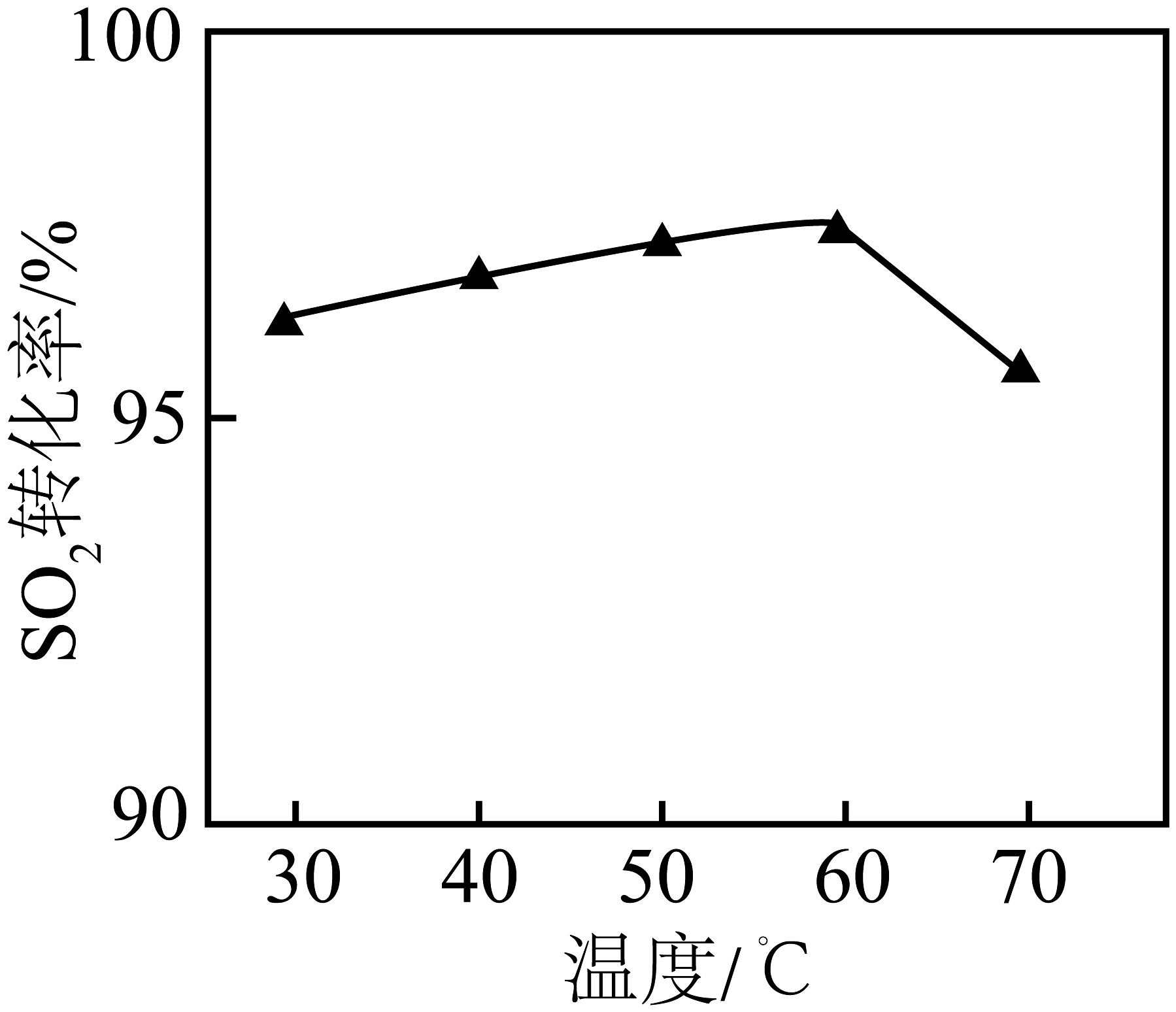
(3)、H2S与SO2在盐溶液中反应制备S,该过程生成含S 悬浮颗粒的悬浊液,含S 悬浮颗粒带负电。 SO2(g)+2H2S(g)3S(s)+2H2O(l) ΔH<0。①SO2转化率受温度影响如图所示。温度高于60℃时,SO2转化率逐渐减小的可能原因为。
②其它条件相同,Na2SO4溶液浓度对含S悬浮颗粒的过滤速率影响如下表所示。
Na2SO4溶液浓度 (g·L−1)
过滤速率 (mL∙min−1)
8
20
10
50
20
330
Na2SO4溶液浓度增大,过滤速率加快的可能原因为。
-
10、
钴的化合物种类较多,用途广泛。
I.[Co(NH3)6]Cl3微溶于冷水,易溶于热水,难溶于乙醇。以H2O2、NH4Cl、浓氨水、CoCl2∙6H2O和活性炭为原料制备[Co(NH3)6]Cl3 , 装置如图所示。
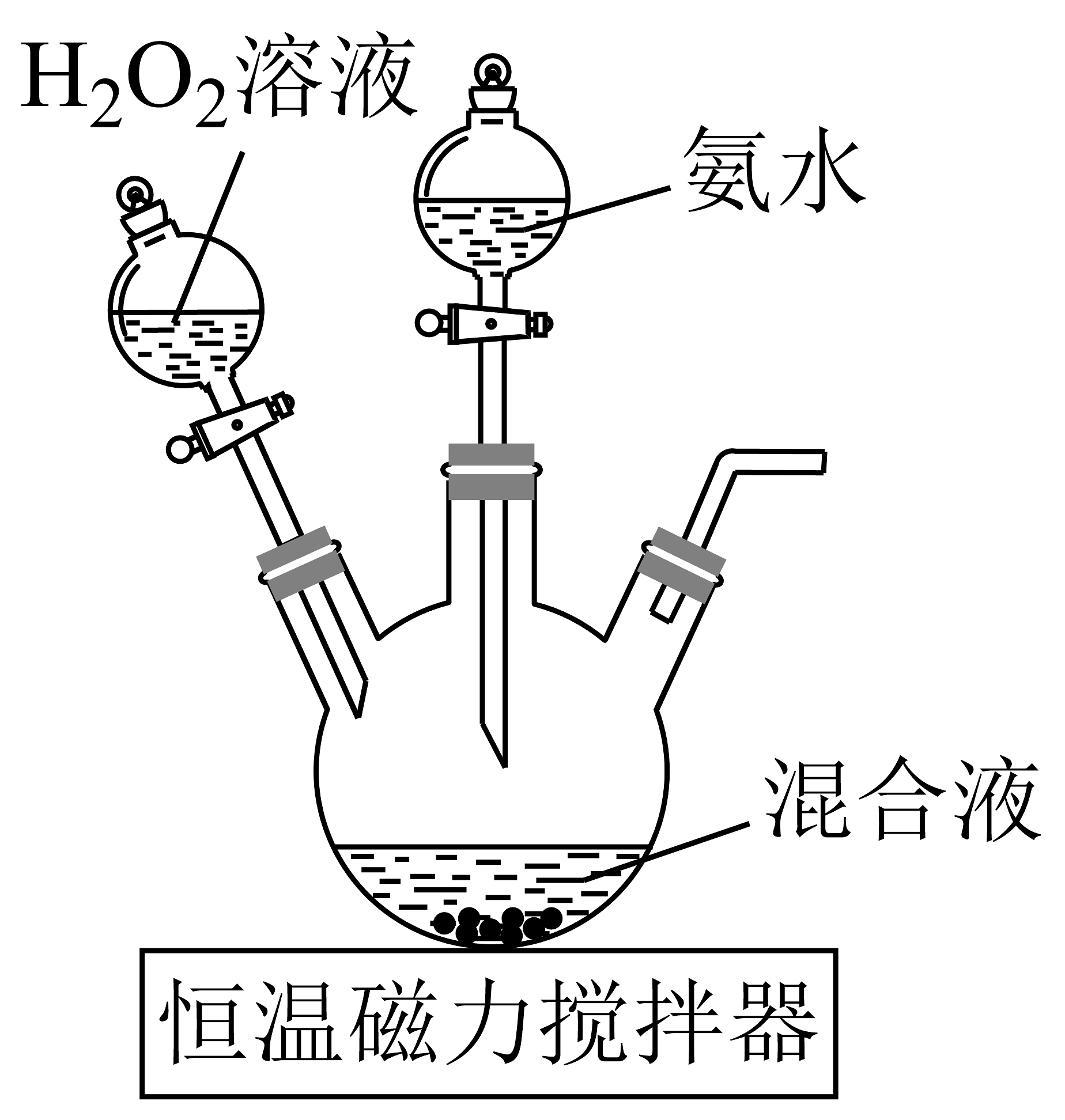
已知:①Co2+不易被氧化,Co3+具有强氧化性;
②[Co(NH3)6]2+具有较强的还原性,[Co(NH3)6]3+性质稳定。
实验过程:在三颈烧瓶中将CoCl2·6H2O、NH4Cl、活性炭、蒸馏水混合并加热至 60℃,依次打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液。再加入浓盐酸,冷却析出晶体,过滤、洗涤、干燥得到产品。
(1)制备[Co(NH3)6]Cl3的化学方程式为。
(2)分液漏斗中液体加入三颈烧瓶中的顺序为。
(3)活性炭是该反应的催化剂,实验室有粒状和粉末状两种形态的活性炭,从比表面积和吸附性的角度分析,本实验选择粉末状活性炭的优缺点是。
(4)洗涤时使用的试剂有冰水、乙醇、冷的盐酸,最后洗涤使用的洗涤剂为。
(5)测定产品纯度。取一定量产品溶于水,以K2CrO4溶液作指示剂,用AgNO3标准溶液进行滴定,测量溶液中Cl-含量。为使滴定终点时 Cl-沉淀完全(浓度小于1.8×10-5 mol∙L-1加入指示剂后溶液中浓度不应超过 (忽略滴加过程的体积增加)。[已知: Ksp(AgCl)= 1.8×10-10 , Ksp(Ag2CrO4)=2.0×10-12]
Ⅱ.实验室还可以用废旧锂电池正极材料 (含LiCoO2 , 以及少量 Fe)为原料制备Co(OH)2 , 已知:酸性条件下的氧化性强弱顺序为Co3+>H2O2>Fe3+;LiOH可溶于水; 下表是部分金属离子生成氢氧化物沉淀的pH。
金属离子
Co2+
Fe2+
Fe3+
开始沉淀的pH
7.6
7.6
2.7
沉淀完全的pH
9.2
9.6
3.7
(6)请补充完整实验方案:取一定量废旧锂电池正极材料,粉碎后与足量Na2SO3溶液配成悬浊液, , 过滤、洗涤、真空烘干得到Co(OH)2。(实验中必须使用的试剂:1 mol∙L-1H2SO4溶液、5 mol∙L-1NaOH溶液、30%H2O2溶液)
-
11、G是合成盐酸伊伐布雷定的中间体,其合成路线如下:
 (1)、B分子中的含氧官能团名称为。(2)、X 的分子式为C5H6N3O2Cl, 其结构简式为。(3)、D→E 的反应类型为。(4)、E→F 中加入K2CO3是为了除去反应中产生的。(5)、写出同时满足下列条件的A 的一种芳香族同分异构体的结构简式:。
(1)、B分子中的含氧官能团名称为。(2)、X 的分子式为C5H6N3O2Cl, 其结构简式为。(3)、D→E 的反应类型为。(4)、E→F 中加入K2CO3是为了除去反应中产生的。(5)、写出同时满足下列条件的A 的一种芳香族同分异构体的结构简式:。i.碱性条件下水解后酸化,生成M和N两种有机产物。
ii.M分子中含有一个手性碳原子;
iii.N分子只有2种不同化学环境的氢原子,且能与FeCl3溶液发生显色反应。
(6)、写出以 、CH3CH2OH和
、CH3CH2OH和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
12、利用锰银矿(主要成分为MnO2、Ag和少量SiO2等杂质)制备硫酸锰和银。(1)、用蔗糖(C12H22O11)、水和浓硫酸浸取锰银矿,过滤得硫酸锰溶液和含银滤渣。
①提高锰元素浸出率的措施(任写—条)。
②蔗糖还原 MnO2生成硫酸锰和CO2的化学方程式为。
③其它条件相同,酸矿比0.33∶1,糖矿比0.04∶1时,酸浸过程中随着水矿比的增大,锰的浸出率如图所示:
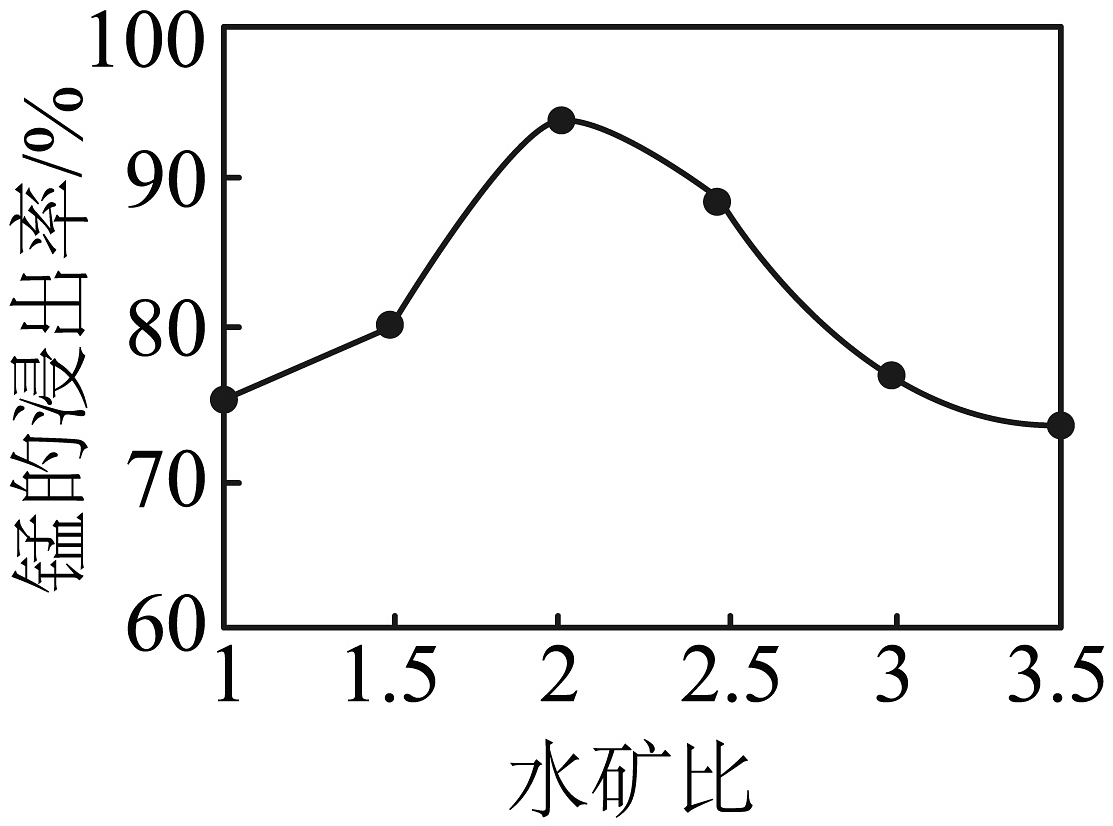
水矿比大于2∶1时,锰的浸出率逐渐减小的原因为。
(2)、在空气中用 NaCN 溶液浸取含银滤渣,得到含[Ag(CN)2]-的浸出液, 再用锌粉置换得银。①浸出反应的离子方程式:。
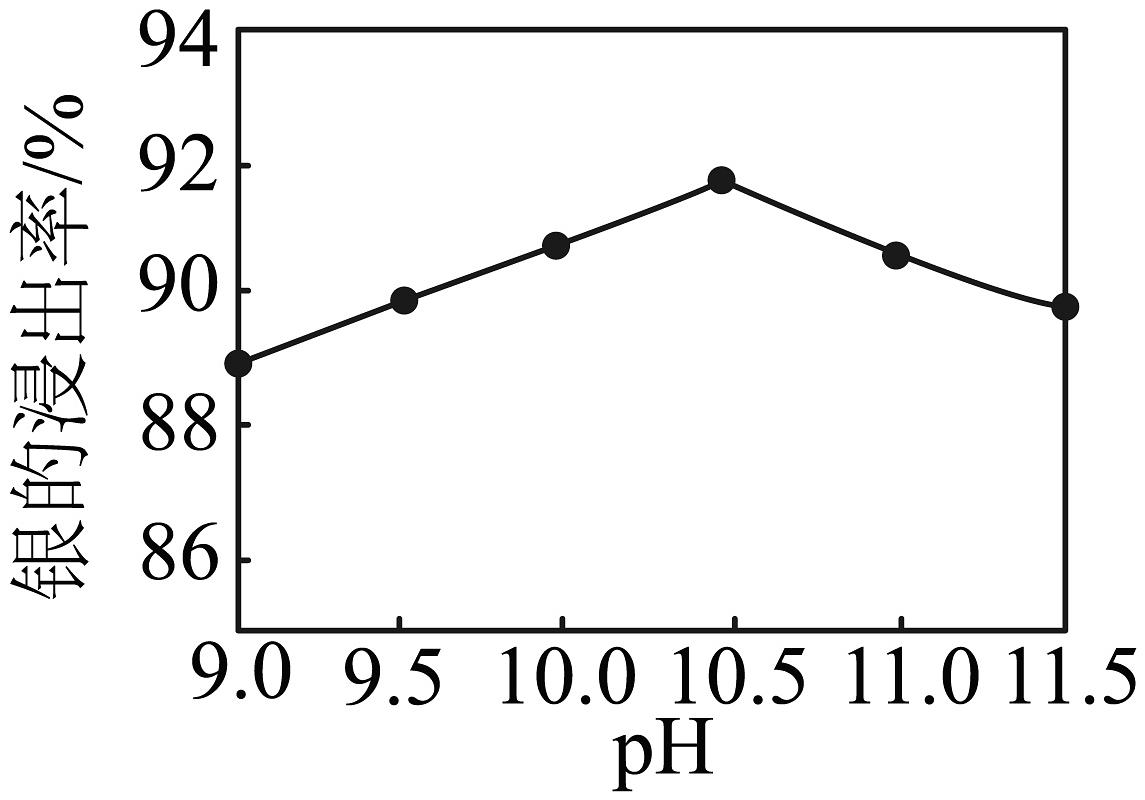
②如图所示,pH小于10.5时,随pH的减小,银的浸出率降低的原因:。
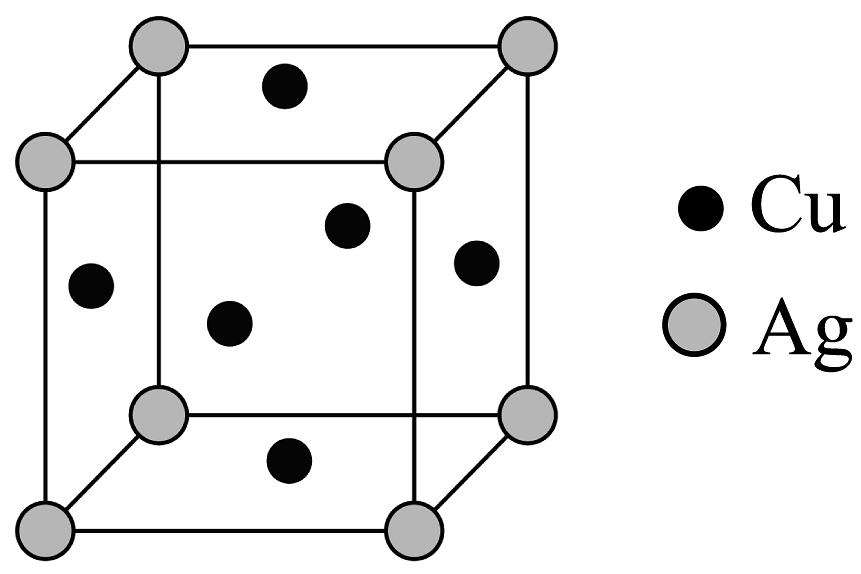
③金属材料铜银合金的晶胞如图所示,该铜银合金的化学式是。
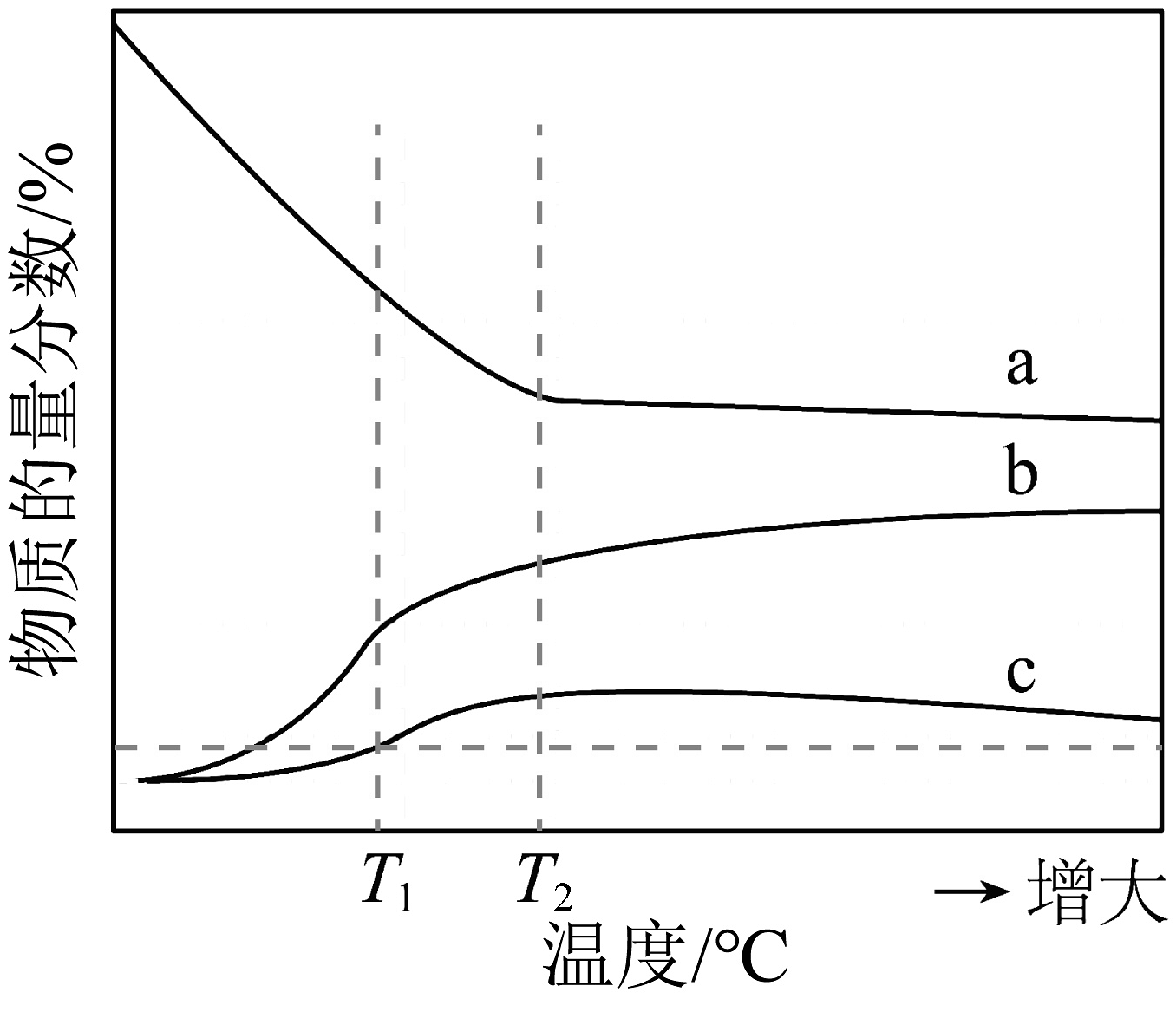
 (3)、“酸浸”所得溶液经一系列操作后得 MnSO4·H2O, 煅烧 MnSO4·H2O生产锰氧体材料,剩余固体质量随温度变化曲线如图所示。该曲线中 B 段所示物质的化学式为(写出计算过程)。
(3)、“酸浸”所得溶液经一系列操作后得 MnSO4·H2O, 煅烧 MnSO4·H2O生产锰氧体材料,剩余固体质量随温度变化曲线如图所示。该曲线中 B 段所示物质的化学式为(写出计算过程)。
-
13、氢能是未来的理想能源,一种水煤气制H2的方法涉及反应如下:
反应I: ΔH1>0
反应Ⅱ:H2O(g)+ CO2(g)+H2(g) ΔH2<0
反应Ⅲ:CO2(g)+ CaCO3(s) ΔH3
一定压强下,体系达平衡后,图示温度范围内C(s)已完全反应, CaCO3(s)在 T2时完全分解。气相中 CO、CO2和H2物质的量分数随温度的变化关系如图所示,下列说法不正确的是
 A、C(s)+2H2O(g)+ CaCO3(s)+2H2(g) ΔH=ΔH1+ΔH2+ΔH3 B、图中a线对应物质为H2 C、反应Ⅲ平衡常数K(T2) D、T1时,保持体积不变,向平衡体系中通入少量CO2(g),重新达平衡后,CO物质的量分数增大
A、C(s)+2H2O(g)+ CaCO3(s)+2H2(g) ΔH=ΔH1+ΔH2+ΔH3 B、图中a线对应物质为H2 C、反应Ⅲ平衡常数K(T2) D、T1时,保持体积不变,向平衡体系中通入少量CO2(g),重新达平衡后,CO物质的量分数增大 -
14、工业上用 H2S、Na2S等处理废水中Cu2+、Hg2+等重金属离子。已知: 25℃时, 饱和 H2S溶液浓度为0.1mol∙L−1 , Ka1(H2S) , Ka2(H2S) , , 下列说法正确的是A、H2S溶液中: B、溶液中:c(H2S) C、Na2S溶液中:c+2c(H2S) D、向溶液中通入 H2S气体至饱和,所得溶液中:
-
15、室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项
实验过程及现象
实验结论
A
测定等物质的量浓度的Na2CO3和 Na2SO3溶液的pH, 前者的pH大
非金属性: S>C
B
向 Fe(NO3)2和KSCN的混合溶液中滴入酸化的AgNO3溶液, 溶液出现血红色
氧化性:Ag+>Fe3+
C
用pH计分别测定0.1mol·L-¹ NaClO 溶液和0.1 mol·L-¹CH3COONa溶液pH,NaClO 溶液 pH大
结合 H+能力:ClO->CH3COO-
D
向 BaSO4固体中加入饱和Na2CO3溶液,充分搅拌后, 取沉淀洗净, 加入盐酸有气泡产生
溶度积常数: Ksp(BaSO4)>Ksp(BaCO3)
A、A B、B C、C D、D -
16、在给定条件下,下列物质间的转化均能一步实现的是A、 B、 C、 D、
-
17、化合物Z是一种药物的重要中间体,部分合成路线如下:

下列说法正确的是
A、X分子中所有碳原子一定共平面 B、1mol Y 与足量溴水反应消耗 3mol Br2 C、Z可以与银氨溶液反应 D、X、Y、Z均能与Na2CO3溶液反应生成CO2 -
18、利用电解法可使 Fe2(SO4)3转化成FeSO4 , 加入甲醇能提高FeSO4产率, 装置如图所示。下列有关说法不正确的是
 A、电解时 Fe3+在阴极放电 B、可用 KMnO4溶液检验有 Fe2+生成 C、反应中每生成 1mol HCHO,转移电子数约为1.204×1024 D、生成的 HCHO 具有还原性,能防止 Fe2+被氧化
A、电解时 Fe3+在阴极放电 B、可用 KMnO4溶液检验有 Fe2+生成 C、反应中每生成 1mol HCHO,转移电子数约为1.204×1024 D、生成的 HCHO 具有还原性,能防止 Fe2+被氧化 -
19、阅读材料,有机金属化合物是一类含有金属—碳键的化合物。蔡斯盐K[PtCl3(C2H4)∙H2O] 由乙烯和K2[PtCl4]溶液在催化剂作用下制得; 二茂铁 Fe(C5H5)2常被用作燃料的催化剂和抗爆剂,熔点为 172℃; 三甲基铝(CH3)3Al可用作许多反应的催化剂;[RhI2(CO)2]−可催化(CH3OH与CO反应生成乙酸; Ni能与CO在50~60℃条件下反应生成 Ni(CO)4 , 其在220~250℃下迅速分解生成金属 Ni,可用于 Ni、Co分离。完成问题。(1)、对于反应 下列说法正确的是A、该反应的△H<0 B、CO在反应过程中共价键未断裂 C、[RhI2(CO)2]−提高该反应的活化能 D、及时分离CH3COOH 能加快化学反应速率(2)、下列化学反应表示正确的是A、溴乙烷制备乙烯的反应:CH3CH2BrCH2=CH2↑+HBr B、过量铁与氯气反应: C、合成蔡斯盐的反应: D、生成 Ni(CO)4的反应:(3)、下列说法正确的是A、(CH3)3Al中 Al 原子轨道的杂化类型为 sp3 B、K[PtCl3(C2H4)]中 Pt的化合价为+3 C、Fe(C5H5)2属于离子化合物 D、1mol Ni(CO)4中 σ 键数目为 8 mol
-
20、尿素[CO(NH2)2]和草木灰(主要成分K2CO3)均可用作肥料。下列说法正确的是A、原子半径:r(O)>r (C) B、电负性:χ(H)>χ(K) C、电离能: D、沸点:NH3>H2O