相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X、Y的说法正确的是
A、X分子中所有原子一定在同一平面上 B、Y中含有三种官能团,其中能与H2加成的官能团只有一种 C、X、Y均不能使酸性KMnO4溶液褪色 D、X→Y的反应为加成反应 -
2、我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
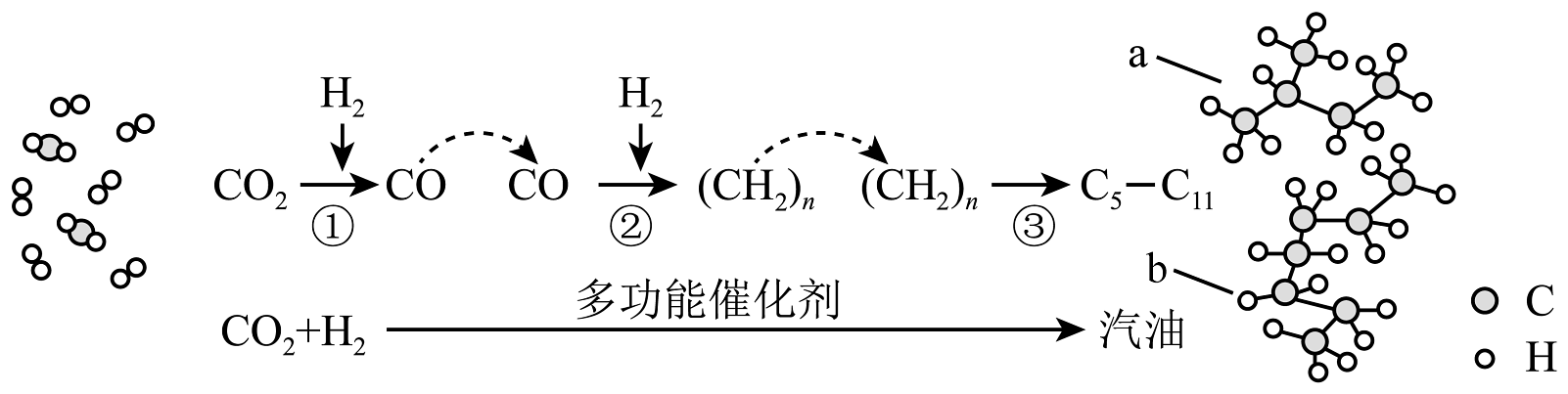
下列说法不正确的是
A、反应①的产物中含有水 B、反应②中只有碳碳键形成 C、汽油主要是的烃类混合物 D、相同情况下 a 比 b 的沸点低 -
3、根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向淀粉溶液中加入少量稀硫酸,加热约5min,冷却后加入NaOH溶液至碱性,再加入新制Cu(OH)2悬浊液,加热,有砖红色沉淀生成
淀粉已完全水解
B
向某样品溶液中滴加氯化铁溶液,振荡溶液后显紫色
样品成分中一定含有醛基
C
将电石与饱和食盐水反应生成的乙炔通入硫酸铜溶液中,有黑色沉淀生成
生成的乙炔气体中可能含有硫化氢
D
向95%乙醇中加入P2O5并加热,将生成的气体通入酸性KMnO4溶液中,紫红色褪色
乙醇发生了消去反应
A、A B、B C、C D、D -
4、有机物结构理论中有一个重要的观点:有机物分子中原子间或原子团间可以产生相互影响,从而导致化学性质的不同。以下事实不能支持该观点的是A、HCOOH 的酸性比CH3COOH酸性强 B、甲烷不能使酸性高锰酸钾褪色,而甲苯能使酸性高锰酸钾褪色 C、乙醛能与H2发生加成反应,而乙醇与H2难反应 D、苯酚能与 NaOH 溶液反应,而乙醇与 NaOH 溶液难反应
-
5、在指定条件下,下列选项所示的物质间转化不能实现的是A、
 B、
B、 C、
C、 D、
D、
-
6、下列有关实验原理或操作正确的是
 A、用图1装置制取少量乙酸乙酯 B、用图2装置验证乙醛的还原性 C、用图3装置检验反应产生乙烯 D、用图4装置分离苯和溴苯
A、用图1装置制取少量乙酸乙酯 B、用图2装置验证乙醛的还原性 C、用图3装置检验反应产生乙烯 D、用图4装置分离苯和溴苯 -
7、实验是化学的灵魂,是化学学科的重要特征之一,下列有关化学实验的说法正确的是A、在苯中加入溴水,振荡并静置后下层液体为橙红色 B、石蜡油蒸汽通过炽热的碎瓷片表面发生反应生成气体中有烷烃和烯烃 C、无水乙醇和钠反应时,钠浮在液面上四处游动,反应缓和并放出氢气 D、向2%的氨水中逐滴加入2%的硝酸银溶液,制得银氨溶液
-
8、下列有关烃的衍生物说法中,正确的是A、可用生石灰去除工业酒精中的少量水 B、能与纯碱溶液反应的物质一定属于羧酸 C、如图所示有机物分子核磁共振氢谱有两个峰
 D、氰酸铵()与尿素[]不能互称同分异构体
D、氰酸铵()与尿素[]不能互称同分异构体
-
9、下列有关物质的性质、用途以及对应关系都正确的是A、甲醛能抑制微生物活动,可用于生物标本的制作 B、乙醇具有特殊香味,医用酒精常用作消毒剂 C、硝化甘油微溶于水,可用作心绞痛的缓解药物 D、乙酸具有挥发性,可用于除铁锈
-
10、下列说法不正确的是A、2,3-二甲基丁烷的键线式:
 B、顺-2-丁烯的球棍模型:
B、顺-2-丁烯的球棍模型: C、CaC2的电子式:
C、CaC2的电子式: D、1-戊烯的球棍模型:
D、1-戊烯的球棍模型:
-
11、下列有关说法正确的是A、甲苯、苯甲酸均属于非电解质 B、煤的干馏、石油的催化重整可得芳香烃 C、蛋白质遇甲醛会生成沉淀,这种变化叫蛋白质的盐析 D、油脂在酸性条件下生成高级脂肪酸和甘油的反应称为皂化反应
-
12、食醋是生活中常见的调味品,我国人民很早就掌握了用粮食酿醋的技术。下列说法正确的是A、淀粉和纤维素互为同分异构体 B、制醋过程中不涉及氧化反应 C、乙酸中各原子最外层均满足8电子稳定结构 D、可用红外光谱仪检验乙酸含有的基团
-
13、氢能是一种极具发展潜力的清洁能源,目前有以下制取氢气的方法:(1)、一氧化碳变换反应CO(g)+H2O(g)=CO2(g)+H2(g)可用于生产氢气。该反应也可采用电化学方法实现,反应装置如图所示。

①装置中的固体电解质应采用(填“氧离子导体”或“质子导体”)。
②生产时,阳极发生的电极反应式为。
③同温同压下,相同时间内,若进口Ⅰ处n(CO)∶n(H2O)=a∶b,出口Ⅰ处气体体积为进口Ⅰ处的y倍,则CO的转化率为(用a、b、y表示)。
(2)、工业上利用甲醇和水蒸气可制备氢气。Ⅰ.催化重整法制氢
反应1:CH3OH(g)CO(g)+2H2(g) ΔH1=+90.6 kJ/mol
反应2:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.2 kJ/mol
则反应3:CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH3=kJ/mol。
Ⅱ.以CuO-ZnO-Al2O3催化剂进行甲醇重整制氢时,固定其他条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及CO选择性的影响如图所示。
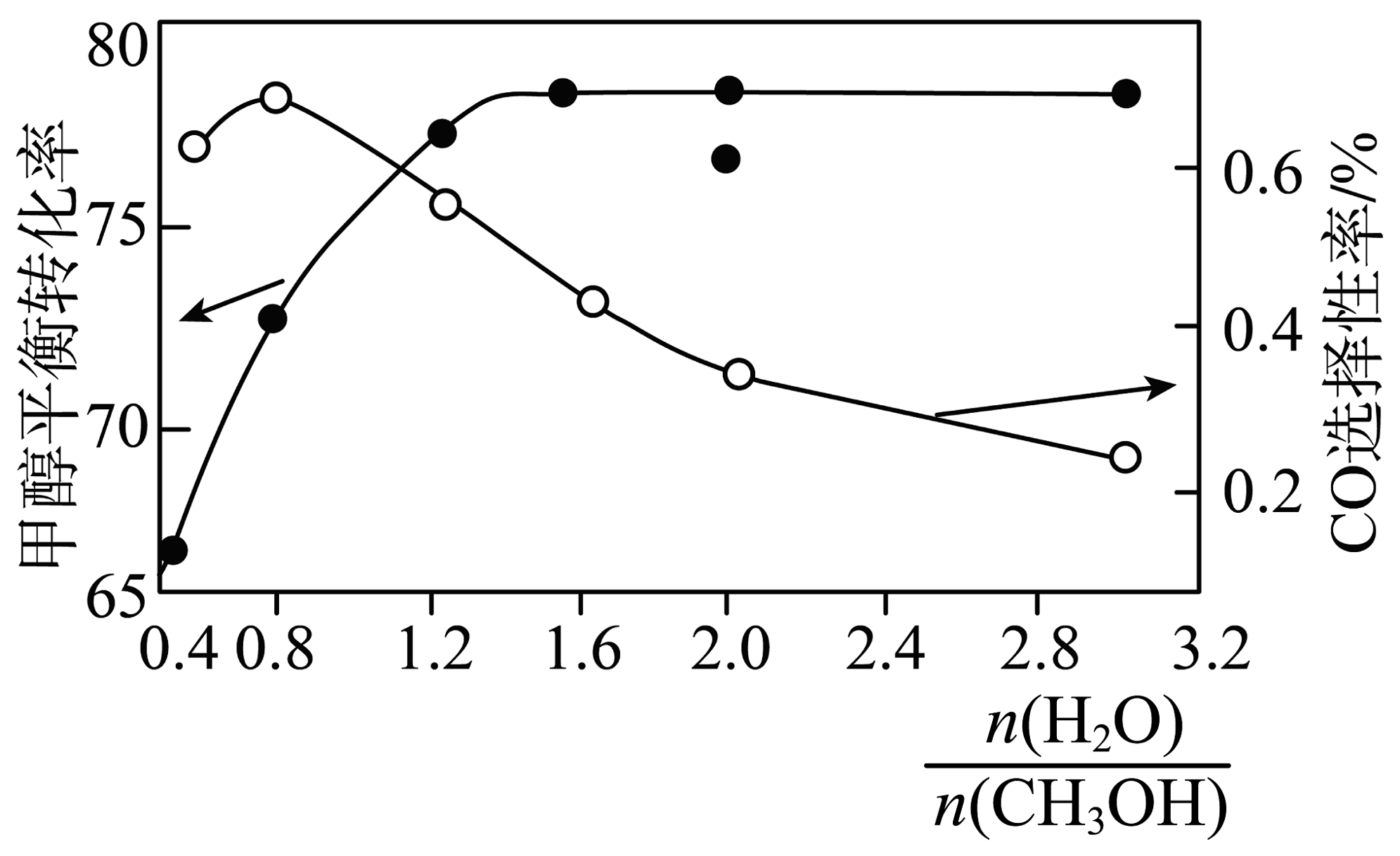
CO选择性=。
①当水、甲醇比大于0.8时,CO选择性下降的原因是。
② 当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是。
(3)、HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图所示。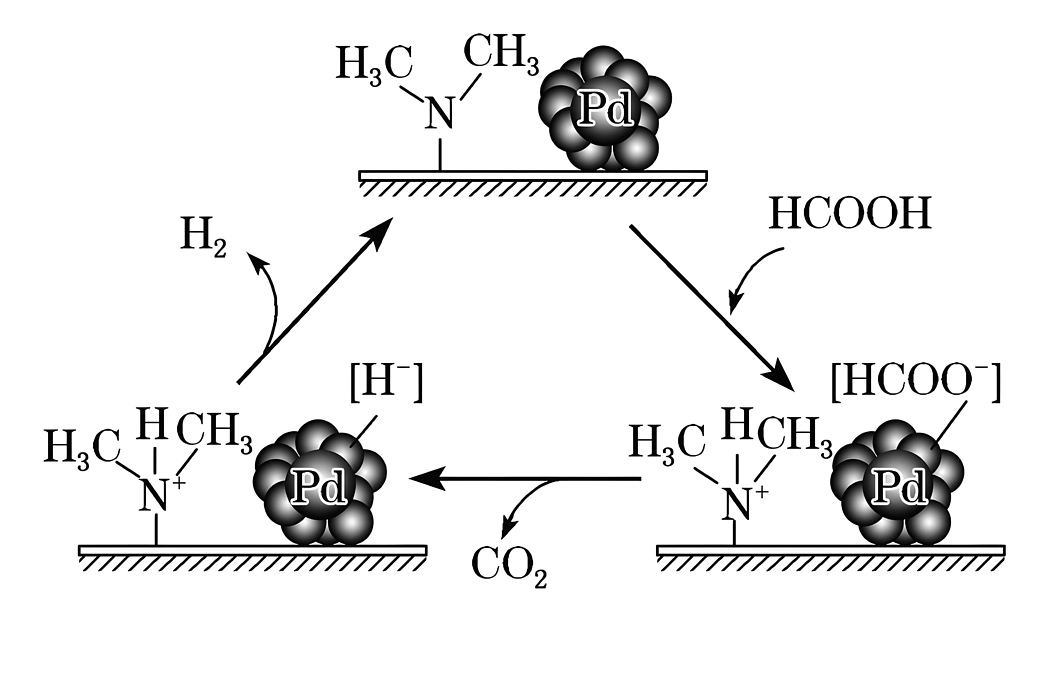
①HCOOD催化释氢反应除生成CO2外,还生成(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是。
-
14、钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广泛应用。(1)、一种从湿法炼锌产生的废渣(主要含Co、Zn、Pb、Fe的单质或氧化物)中富集回收得到含锰高钴成品的工艺如下:
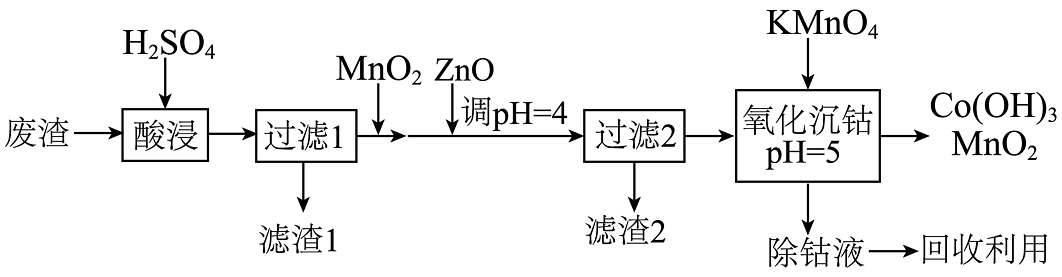
已知溶液中离子开始沉淀和沉淀完全()时的pH:
开始沉淀的pH
1.5
6.9
—
7.4
6.2
沉淀完全的pH
2.8
8.4
1.1
9.4
8.2
回答下列问题:
①酸浸。保持温度、浸取时间不变,能提高金属元素浸出率的措施有。(写两条)
②“过滤1”后的溶液中加入的作用是。
③“氧化沉钴”中氧化还原反应的离子方程式为、 。
(2)、Co3O4在磁性材料、电化学领域应用广泛,实验室中可以用CoC2O4煅烧后制得。①已知:请补充完整由某含c(Co2+)=0.1 mol/L的浸出液 (含有杂质Fe2+、Fe3+)制备纯净的CoC2O4·2H2O实验方案: , 干燥,得到CoC2O4·2H2O晶体[须使用的试剂:NaClO3、NaOH、AgNO3溶液、(NH4)2C2O4、蒸馏水]
②CoC2O4·2H2O热分解可制备Co3O4.为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575 g CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385 ℃以上残留固体均为金属氧化物)。经测定,温度为205~385 ℃的煅烧过程中,产生的气体为CO2 , 计算AB段消耗O2在标准状况下的体积(写出计算过程,结果保留2位有效数字)。

-
15、化合物E是合成抗癌药帕比司他的中间体,其合成路线如下:
 (1)、B分子中采取sp2杂化的碳原子数目与采取sp3杂化的碳原子数目之比是。(2)、①A→B中有一种分子式为C8H10O2的副产物生成,该副产物的结构简式为。
(1)、B分子中采取sp2杂化的碳原子数目与采取sp3杂化的碳原子数目之比是。(2)、①A→B中有一种分子式为C8H10O2的副产物生成,该副产物的结构简式为。② C在水中的溶解度 D在水的溶解度。(填“大于”、“小于”、“等于”)
(3)、已知B→C的反应有中间体X生成,中间体X的分子式为C11H12O6。B→X的反应类型为。(4)、D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。① 分子中含有苯环,且不同化学环境的氢原子个数之比为1∶1;
②1 mol该物质最多能与4 mol NaOH反应。
(5)、肉桂酸苄酯 是一种天然香料。写出以
是一种天然香料。写出以 和CH2(COOH)2为原料制备肉桂酸苄酯的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
和CH2(COOH)2为原料制备肉桂酸苄酯的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
16、化工厂烟气中的SO2 , 会对空气造成一定程度的污染。用ZnO浆料吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、、的物质的量分数随pH的分布如图−1所示。
 (1)、搅拌下向氧化锌浆料中匀速缓慢通入SO2气体。
(1)、搅拌下向氧化锌浆料中匀速缓慢通入SO2气体。①下列操作一定能提高氧化锌浆料吸收SO2效率的有 (填序号)。
A.加快搅拌速率 B.水浴加热氧化锌浆料
C.通过多孔球泡向氧化锌浆料中通SO2 D.降低通入SO2气体的速率
②在开始吸收的40 min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图−2)。溶液pH几乎不变阶段,主要产物是(填化学式)。
 (2)、O2催化氧化。其他条件相同时,pH在6~8范围内,pH增大,浆料中ZnSO3的氧化速率增大,其主要原因是。(3)、氧化锌晶体的一种晶胞结构如图−3所示,O2-位于Zn2+构成的(填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。若晶体中部分O原子被N原子替代后可以改善晶体的性能,Zn-O中离子键成分的百分数大于Zn-N键,原因是。
(2)、O2催化氧化。其他条件相同时,pH在6~8范围内,pH增大,浆料中ZnSO3的氧化速率增大,其主要原因是。(3)、氧化锌晶体的一种晶胞结构如图−3所示,O2-位于Zn2+构成的(填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。若晶体中部分O原子被N原子替代后可以改善晶体的性能,Zn-O中离子键成分的百分数大于Zn-N键,原因是。 (4)、Zn、Fe及其化合物在生产、生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4 , 还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:
(4)、Zn、Fe及其化合物在生产、生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4 , 还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下: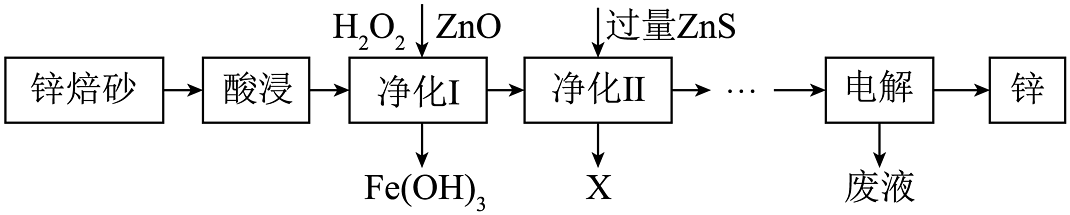
①若净化后的溶液中Cu2+浓度为1×10-12mol·L-1 , 则净化后溶液中Zn2+浓度为[已知:室温下Ksp(ZnS)=1.6×10-24 , Ksp(CuS)=6.4×10-36]。
②ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为。
-
17、室温下,用0.5mol·L-1Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5 , Ksp(CaCO3)=3×10-9。下列说法正确的是A、0.5mol·L-1Na2CO3溶液中存在:2c(Na+)=c(CO)+c(HCO)+c(H2CO3) B、过滤后所得清液中一定存在:c(Ca2+)=且c(Ca2+)≤ C、反应CaSO4+COCaCO3+SO正向进行,需满足>×104 D、滤渣中加入醋酸发生反应的离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O
-
18、室温下,探究溶液的性质,下列实验探究方案能达到探究目的的是
选项
探究目的
探究方案
A
溶液中是否含有
向溶液中加入稍过量较浓的NaOH溶液,加热,将湿润的蓝色石蕊试纸放在试管口,观察试纸颜色变化
B
是否有还原性
向溶液中滴加几滴酸性溶液,观察溶液颜色变化
C
溶液中是否含有
向溶液中加入溶液,观察沉淀产生情况
D
是否水解
向溶液中滴加几滴甲基橙试液,观察溶液颜色变化
A、A B、B C、C D、D -
19、在指定条件下,下列选项所示的物质间转化不能实现的是A、(浓) B、 C、 D、(浓)
-
20、抗阿尔茨海默病药物多奈哌齐的部分合成路线如下,下列说法正确的是
 A、1mol X最多能与3 mol H2反应 B、Y存在顺反异构体且所有碳原子可能共平面 C、Z既能与NaOH溶液反应又能与盐酸反应 D、可用酸性KMnO4溶液鉴别X和Y两种物质
A、1mol X最多能与3 mol H2反应 B、Y存在顺反异构体且所有碳原子可能共平面 C、Z既能与NaOH溶液反应又能与盐酸反应 D、可用酸性KMnO4溶液鉴别X和Y两种物质