相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、科学家基于水/有机双相电解质开发了一种新型的铜锌二次电池,双相电解质建立了离子选择性界面,仅允许氯离子迁移,其放电时的工作原理如图所示。下列说法不正确的是
 A、充电时,石墨电极与电源正极相连 B、充电时,石墨电极上可发生电极反应 C、放电时,氯离子向锌电极迁移 D、放电时,理论上电路中每转移电子,锌电极质量增加
A、充电时,石墨电极与电源正极相连 B、充电时,石墨电极上可发生电极反应 C、放电时,氯离子向锌电极迁移 D、放电时,理论上电路中每转移电子,锌电极质量增加 -
2、是汽车尾气净化催化剂的关键成分,其高效的储放氧性能在的氧化还原催化循环中发挥了巨大作用。研究发现,先在催化剂表面形成强吸附性的二聚体,再与在表面反应生成和 , 该过程的能量变化曲线如图所示(吸附在表面的物种用*标注)。下列说法不正确的是

说明:“-----”表示化学键将要断裂或形成。
A、该反应属于放热反应 B、该过程中的最大活化能为 C、该过程中伴随极性键和非极性键的断裂和形成 D、若改用其他催化剂,其反应的不变 -
3、下列实验操作对应的实验现象和结论均正确的是
选项
实验操作
实验现象
实验结论
A
向溶液中滴加少量氯水,充分反应后再加入淀粉溶液
溶液先变橙黄色,后变蓝色
氧化性:
B
将气体通入溶液中
生成白色沉淀
该沉淀是
C
向稀硝酸中加入过量铁粉,充分反应后滴加溶液
有气体生成,滴加溶液后溶液呈红色
稀硝酸将氧化成
D
向溴水中加入苯,振荡后静置
水层颜色变浅
溴与苯发生了取代反应
A、A B、B C、C D、D -
4、利用如图所示装置制备SO2并检验其性质。下列说法不正确的是
 A、装置①中紫色石蕊溶液变红 B、装置②和④中溶液褪色,均体现SO2的漂白性 C、装置③中出现浑浊,体现SO2的氧化性 D、装置⑤中的试剂可以是NaOH溶液,用于吸收尾气
A、装置①中紫色石蕊溶液变红 B、装置②和④中溶液褪色,均体现SO2的漂白性 C、装置③中出现浑浊,体现SO2的氧化性 D、装置⑤中的试剂可以是NaOH溶液,用于吸收尾气 -
5、化合物M可作为一种废水处理剂,去除废水中的金属离子。其结构如图所示。W、X、Y和Z均为短周期主族元素,X、Y和Z位于同一周期。W原子核外的电子只有一种自旋取向,基态Z原子s轨道上的电子数和p轨道上的电子数相等。下列说法正确的是
 A、第一电离能: B、原子半径: C、简单氢化物沸点: D、化合物M中X、Y、Z均满足8电子结构
A、第一电离能: B、原子半径: C、简单氢化物沸点: D、化合物M中X、Y、Z均满足8电子结构 -
6、部分含氮物质的分类与相应化合价关系如图所示。下列说法正确的是
 A、工业制硝酸的转化路线为 B、能用铁制品盛装e的浓溶液是因为常温下二者不反应 C、c和d均可以用排水法收集 D、实验室可用生石灰与f的浓溶液制取a
A、工业制硝酸的转化路线为 B、能用铁制品盛装e的浓溶液是因为常温下二者不反应 C、c和d均可以用排水法收集 D、实验室可用生石灰与f的浓溶液制取a -
7、某化学兴趣小组利用实验室常见仪器进行海带提碘的实验,下列实验操作正确且能达到对应实验目的的是
实验操作


实验目的
A.灼烧海带
B.过滤海带灰悬浊液
实验操作


实验目的
C.加入氧化
D.萃取溶液中的
A、A B、B C、C D、D -
8、下列生产生活情境涉及的离子方程式书写正确的是A、用去除自来水中的余氯(): B、用侯氏制碱法制备碳酸氢钠晶体: C、用胃舒平[主要成分为]治疗胃酸过多: D、用溶液刻蚀铜电路板:
-
9、维生素P是一种营养增补剂,其结构如图所示(其中R为烷烃基)。关于该化合物,下列说法正确的是
 A、含有5种官能团 B、所有原子可能共平面 C、可以与溶液发生显色反应 D、该化合物最多能与发生反应
A、含有5种官能团 B、所有原子可能共平面 C、可以与溶液发生显色反应 D、该化合物最多能与发生反应 -
10、劳动创造美好生活。下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
用熟香蕉催熟猕猴桃生果
乙烯能加速生果成熟
B
用油脂制肥皂
羧酸与醇能发生酯化反应
C
用光导纤维传输量子光信号
二氧化硅具有良好的光学特性
D
用干冰制造舞台“烟雾”
干冰易升华吸热
A、A B、B C、C D、D -
11、设为阿伏加德罗常数的值,下列说法不正确的是A、标准状况下,中含有的质子数目为 B、乙醇中含有的共价键数目为 C、与水反应转移的电子数目为 D、与的混合气体含有的原子数目为
-
12、利用电化学原理既能输出电能,又能合成有机物。如图所示装置在输出电能的同时可合成苯胺。该电池工作时,下列说法不正确的是
 A、多孔惰性电极为正极 B、电流方向为 C、负极电极反应式为 D、反应一段时间后,负极区溶液减小
A、多孔惰性电极为正极 B、电流方向为 C、负极电极反应式为 D、反应一段时间后,负极区溶液减小 -
13、化学与科技、生产、生活息息相关。下列说法不正确的是A、“深海勇士”号潜水艇使用的锂离子电池是二次电池 B、保温杯内胆使用316不锈钢,不锈钢的含碳量大于生铁 C、月球新矿物“嫦娥石”是一种磷酸盐矿物(含镁和铁),它不易溶于水 D、甲流病毒主要由和蛋白质组成,可采用高温、紫外线、乙醇等有效灭活
-
14、粤剧被誉为“南国的红豆”,是世界非物质文化遗产之一。下列说法不正确的是A、粤剧头饰“凤冠”上的金丝银线属于金属材料 B、粤剧演奏乐器“椰胡”的琴筒由椰壳制成,椰壳的主要成分为多糖 C、粤剧彩绘脸谱使用的红色油彩主要成分为 D、粤剧头饰“翎子”(也称“野鸡翎”“锥毛翎”),其主要成分为天然纤维
-
15、下列化学用语或图示表达不正确的是A、的电子式:
 B、丙烯的结构简式:
C、电子云轮廓图:
B、丙烯的结构简式:
C、电子云轮廓图: D、基态的价层电子轨道表示式:
D、基态的价层电子轨道表示式:
-
16、下列物质使用的材料属于有机高分子材料的是


A.航空发动机——碳化硅纤维
B.人造骨骼——镍钛合金


C.量子计算机——铁基超导材料
D.滑雪服面料——聚酰胺纤维
A、A B、B C、C D、D -
17、普利类药物是常用的一线降压药,EHPB是合成众多普利类药物的重要中间体。EHPB的其中一种合成方法如下:

回答下列问题:
(1)、化合物Ⅰ的名称为。化合物Ⅱ和物质X合成化合物Ⅲ的原子利用率为100%,则物质X的分子空间结构名称为。(2)、化合物Ⅵ到Ⅶ的转化反应是第一个以中国科学家命名的反应(黄鸣龙还原反应),该反应的部分机理如下:
其中①和②的反应类型分别为、。
(3)、根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
①
②
(4)、关于上述示意图中的相关物质及转化,下列说法正确的有______A、化合物Ⅳ和Ⅶ的手性碳原子数相同 B、可以利用酸性高锰酸钾溶液鉴别化合物Ⅲ和Ⅳ C、化合物Ⅴ转化为Ⅵ,存在键的断裂和键的形成 D、化合物Ⅳ易溶于水,可能是因为其能与水形成分子间氢键(5)、化合物Ⅵ的某种同分异构体在核磁共振氢谱图上有3组峰,能发生银镜反应,且能使溶液显紫色,其结构简式为。(6)、以化合物Ⅰ和乙烯为有机原料,合成化合物M(如图)。基于设计的合成路线,回答下列问题:
①从乙烯出发,第一步反应的化学方程式为。
②最后一步反应的反应物为。
-
18、
Ⅰ.化学反应中,从反应物到生成物可有多种途径,但殊途同归。
(1)如图所示,已知:

则(用、和的代数式表示)。
Ⅱ.从分子、原子的角度认识物质的转化是化学区别于其他学科的显著特点。
(2)有机反应机理的研究可为人们展示微观粒子在反应中的变化过程。
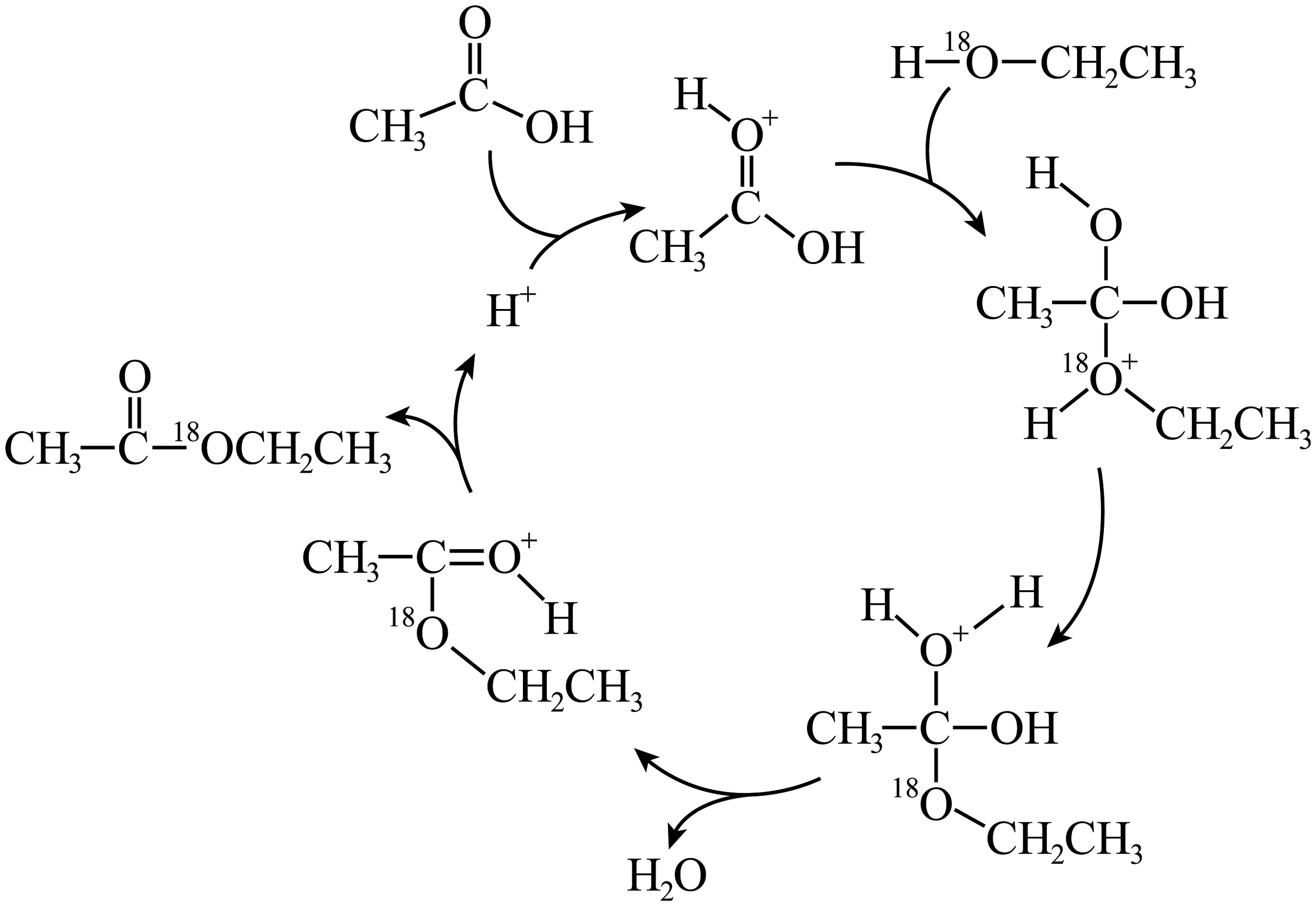
①根据上图所示反应机理,写出相应的化学方程式。
②关于上图所示反应,以下说法正确的是。
A.作为反应物参与该反应
B.能增大该反应速率
C.不能增大该反应的平衡转化率
D.若该反应在溶液中进行,升温、增压均可增大反应速率
Ⅲ.化学助力我国实现“碳达峰、碳中和”的目标。
(3)向体积为1L的密闭容器通入4mol和的混合气体,并发生反应:。
的平衡转化率与压强、温度及氢碳比的关系如下图所示。
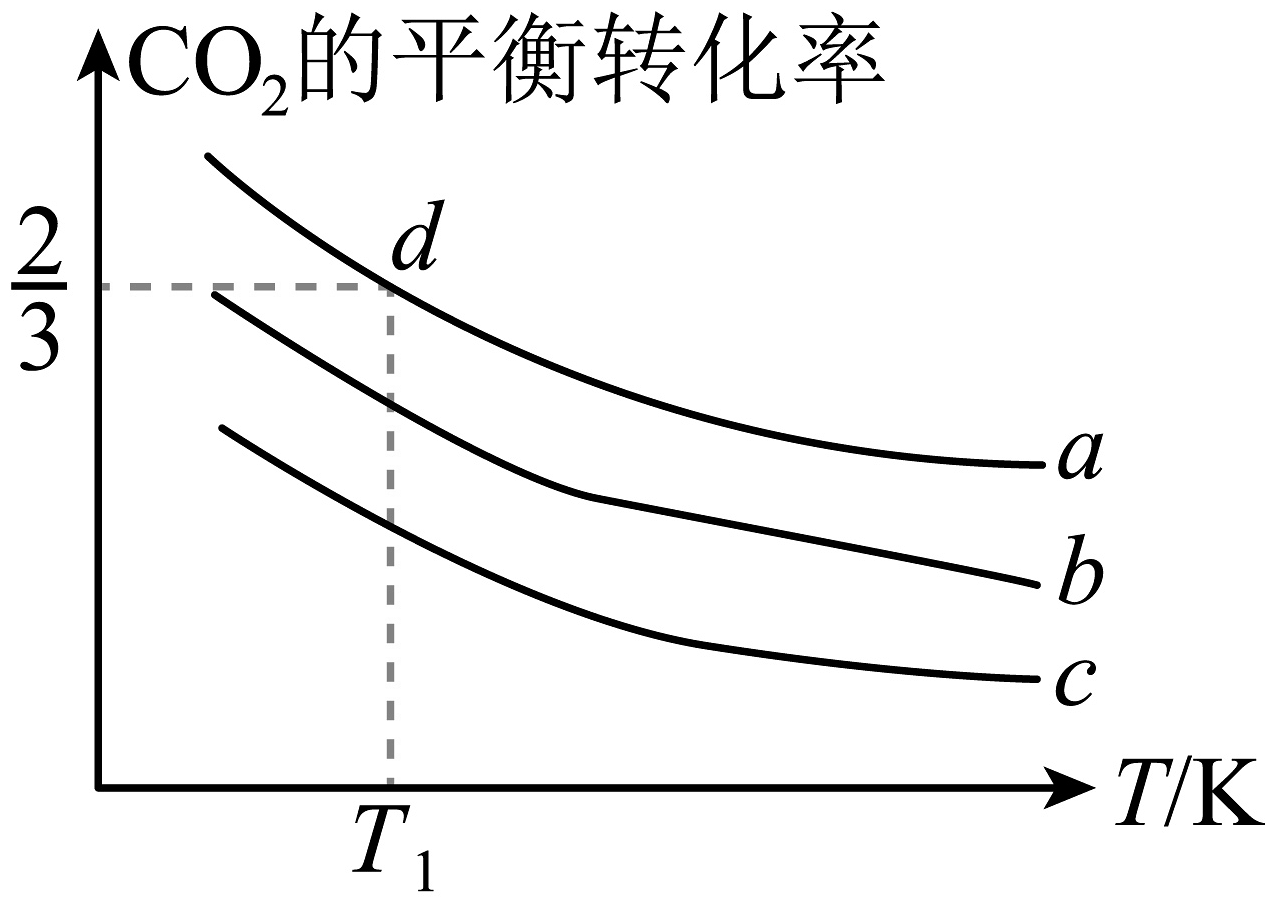
①其他条件相同,若a、b、c代表压强,则a、b、c从大到小的顺序为 , 该反应为(填“吸热”或“放热”)反应:其他条件相同,若a、b、c代表氢碳比,则a、b、c从大到小的顺序为。
②若d点时氢碳比为3∶1,求此温度下该反应的平衡常数K。(写计算过程)
③工业上可利用NaOH溶液捕获。将通入NaOH溶液中,若所得溶液 , 溶液pH=。(已知: , 该条件下,的;)
-
19、钒、钛、钨等金属的回收具有重要的经济和战略价值。利用废钒-钛系脱硝催化剂(含、、及少量的Si、P、Al等的化合物)回收钒、钛、钨的工艺流程如下图。
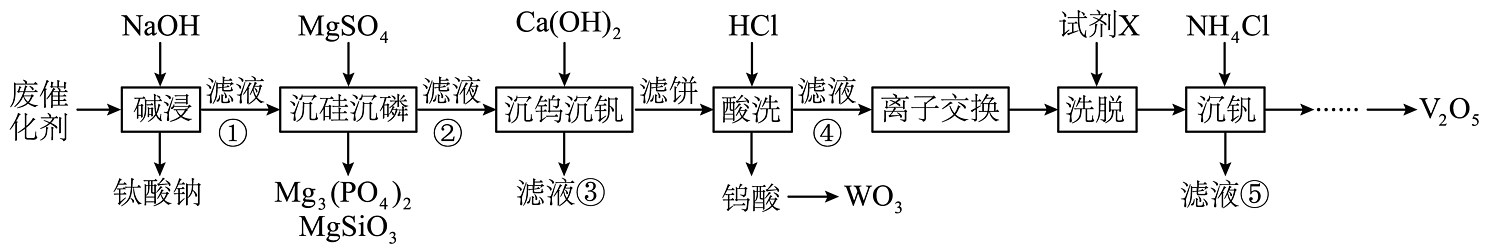
已知:和的溶解度随温度升高而增大。
回答下列问题:
(1)、钛酸钠()中Ti的化合价为。写出“碱浸”过程中反应生成的化学方程式:。(2)、在“沉硅沉磷”工序中,除磷率和除硅率变化如图所示。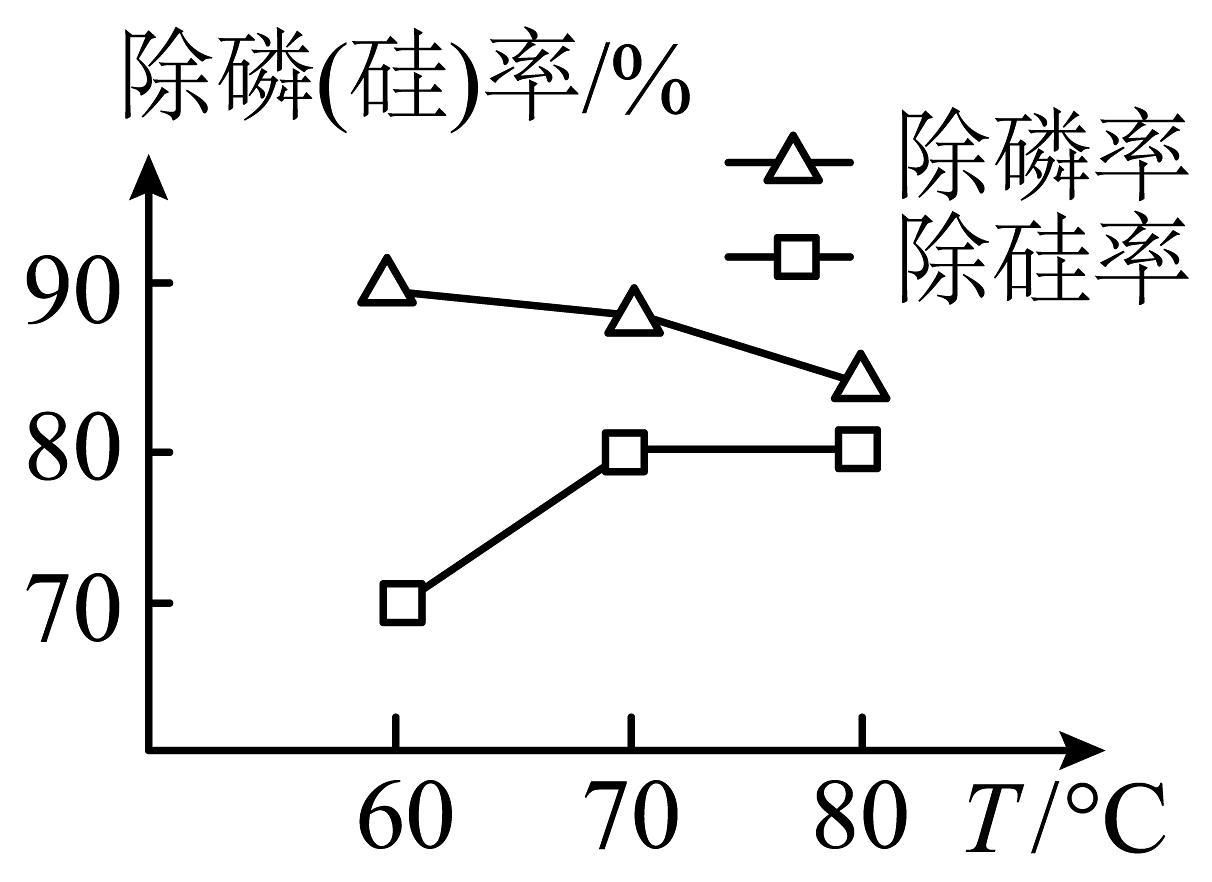
①“沉硅沉磷”最适合温度为。
②除硅率随温度升高而增大,因升温促进含硅物质的水解,最后硅元素以(填化学式)的形式沉淀分离出来。
③除磷率随着温度的升高而下降,其原因可能是。
(3)、“沉钨”时转化为沉降分离,已知温度为T时 , , 当溶液中恰好沉淀完全(离子浓度等于)时,溶液中。(4)、已知“酸洗”后钒以形式存在。“离子交换”过程可表示为: , 其中为强碱性阴离子交换树脂。“洗脱”时,试剂X应选用(填化学式)。(5)、①是常用的催化剂,其结构如图所示,该分子中σ键和π键数目比为。硫酸工业中,转化为的催化剂选用 , 催化过程经两步完成。
ⅰ:(写出化学方程式),ⅱ:。
②磷化钒(VP)是另外一种新型催化材料,P交替地填入在V构成的正三棱柱中心,形成如图1所示结构单元。VP晶胞沿b轴投影图如图2所示,则该晶体的晶胞体积为。
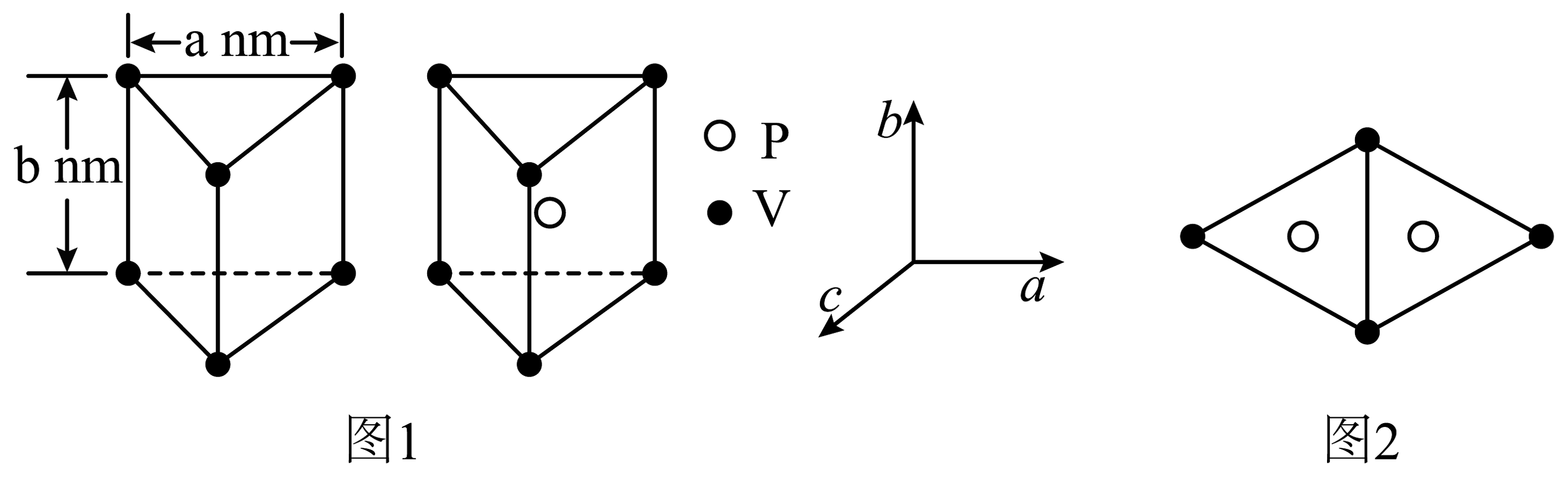
-
20、
铜纳米线是制作柔性电子元件的重要材料,制作铜纳米线常见原料为硫酸铜。某学习小组设计实验探究铜纳米线的制备过程。
Ⅰ.硫酸铜的制备
(1)实验室可用铜和浓硫酸反应制备硫酸铜,反应方程式为。
(2)硫酸铜溶液的配制
ⅰ.配制100mL 0.1硫酸铜溶液需称量g。
ⅱ.以下硫酸铜溶液的配制操作中,不正确的是(填序号)。
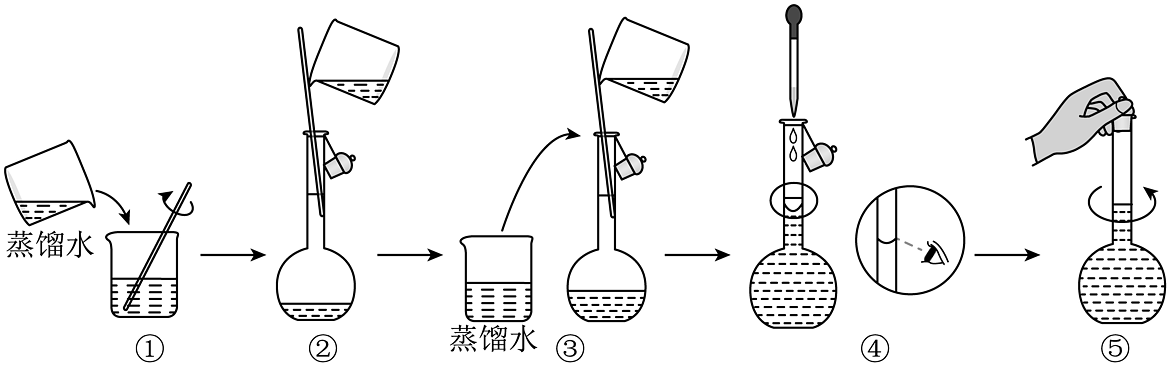
Ⅱ.铜纳米线的制备
铜纳米线的制备可采用化学还原法,如使用铁进行置换。学习小组设计实验探究Cu(Ⅱ)(二价铜)存在形式对所置换铜的颗粒度影响。
实验序号
实验操作
实验现象
①
往5mL 0.1硫酸铜溶液中放入一枚表面打磨光滑的铁钉
10分钟时观察到溶液颜色变浅,铁钉表面沉积一层粗糙的铜颗粒,试管底部有铜颗粒
②
往5mL 0.1硫酸铜溶液中滴加浓氨水至生成的淡蓝色沉淀刚好完全溶解,得深蓝色铜氨溶液,放入与实验①相同的铁钉
10分钟时无明显现象,10小时后观察到铁钉表面镀上一层红色的铜,试管底部有红褐色沉淀
学习小组通过查阅资料发现:
ⅰ.工业上常采用电沉积铜方法制备纳米铜,过程为Cu(Ⅱ)的扩散迁移并在电极上被还原为铜单质。
ⅱ.电沉积过程中:速率常数越大,沉积速率越快:扩散系数越大,溶液导电性越强。
学习小组模仿工业制备纳米铜的条件,设计实验验证Cu(Ⅱ)存在形式和溶液导电性对电沉积铜反应速率的影响。
实验设计与实施
实验
序号
Cu(Ⅱ)存在形式
(浓度均为5 mmol/L)
支持电解质
(提高溶液导电性)
实验测得
速率常数
含铜离子
扩散系数
③
0.5mol/L溶液
④
______
⑤
0.5mol/L溶液
k
表格中的速率常数和扩散系数为多次实验后测得数据的平均值。
(3)其中实验④中支持电解质为。
分析与讨论
(4)实验⑤中,k(填“>”、“<”或“=”)。
(5)已知铁与铜氨溶液反应: , 平衡常数。推测实验②在10分钟时无明显现象的原因是:。
结论:选用扩散系数更大Cu(Ⅱ)和提高溶液的导电性都可加快反应速率。
Ⅲ.铜纳米线的纯度检测
某铜纳米线样品质量为m g,经处理后完全转化为含的溶液,向其中加入过量的KI溶液,发生反应:。用的溶液滴定生成的 , 发生反应: , 消耗溶液V mL。
(6)滴定实验中可使用(填试剂名称)作为指示剂。滴定终点现象为:。
(7)该样品中铜的质量分数为(写计算式)。