相关试卷
- 江苏省如皋中学2025-2026学年高三上学期测试(一)化学试题
- 广西壮族自治区来宾市多校2025-2026学年高二上学期11月期中联考 化学试题
- 江苏省苏州市吴江区汾湖高级中学2025-2026学年高二上学期9月月考化学试题
- 北京市第八十中学2025-2026学年高三上学期9月月考化学试题
- 贵州省铜仁市思南中学2025-2026学年高三上学期10月月考 化学试题
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 江苏省泰州市靖江高级中学2025-2026学年高一上学期9月月考化学试题
- 四川省泸州市泸县第五中学2025-2026学年高三上学期10月月考化学试题
- 贵州省安顺市普定县第一中学2025-2026学年高一上学期9月月考化学试题
-
1、化学在日常生活和工农业生产中的应用非常广泛。下列离子方程式书写正确的是A、向硫酸铜溶液中加入过量的NaHS溶液: B、0.1mol/LKHC2O4的水解方程式: C、钢铁浸泡在NaCl溶液中被腐蚀时正极反应式: D、向冷的石灰乳中通入Cl2制漂白粉:
-
2、下列化学用语表示正确的是A、3,3-二甲基戊烷的键线式:
 B、和H2O的空间填充模型均为:
B、和H2O的空间填充模型均为: C、邻羟基苯甲醛分子内氢键示意图:
C、邻羟基苯甲醛分子内氢键示意图: D、键的电子云形状:
D、键的电子云形状:
-
3、化学与生活密切相关,下列说法错误的是A、可在馒头加工过程中添加碳酸氢铵,使馒头更加松软 B、苯甲酸钠可作为食品防腐剂,用于腊肉、香肠的生产 C、维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化 D、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用
-
4、某温度下,在密闭容器中充入一定量的R(g),发生反应R(g)T(g),该反应经历两步:①R(g)I(g),②I(g)T(g),催化剂M能催化第②步反应,反应历程如图所示。

下列说法不正确的是
A、升高温度,减小,且减小 B、不使用催化剂M,反应过程中c(I)先增大后减小 C、使用催化剂M,反应①的ΔH不变,反应②的ΔH减小 D、使用催化剂M,反应①速率不变,反应②速率加快 -
5、一种在水处理领域应用广泛的物质,其结构如图。已知R、W、Z、X、Y为原子序数依次增大的短周期主族元素,下列说法正确的是
 A、简单氢化物的沸点:W>Z B、元素电负性:W>Z>R C、第一电离能大小:W>Z>X D、YR3和的空间构型均为三角锥形
A、简单氢化物的沸点:W>Z B、元素电负性:W>Z>R C、第一电离能大小:W>Z>X D、YR3和的空间构型均为三角锥形 -
6、汽车尾气管的钢材可通过镀铝的方法来延缓腐蚀,下列说法正确的是A、该法中钢铁为负极被保护 B、该法为牺牲阴极法 C、镀铝时将钢材与电源正极相连 D、电化学腐蚀时铝发生反应:
-
7、以化合物Ⅰ为原料,利用代谢工程和合成生物学技术可实现苯乙烯的绿色合成,进而制各种高级芳醇,合成路线如图(微生物酶、部分反应条件略)。
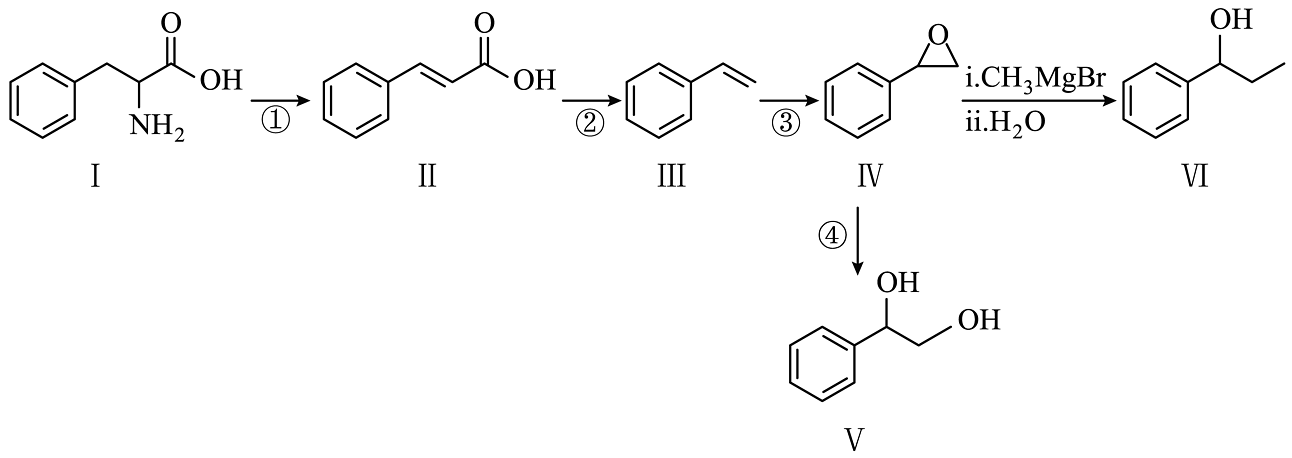
已知:
(1)、化合物Ⅰ的分子式为;其中,含氮官能团的名称为。(2)、对化合物Ⅱ,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a

b
酯化反应
(3)、反应②的化学方程式可表示为: , 化合物Z为。(4)、化合物Ⅳ的某同分异构体含有苯环,在核磁共振氢谱图上只有4组峰,且峰面积之比为1:2:2:3,其结构简式为(写一种)。(5)、关于上述合成路线中的相关物质及转化,下列说法正确的有___________(填标号)。A、化合物Ⅰ与 混合,最多可生成2种二肽
B、反应①中,有键和键的断裂
C、反应③中,存在C原子杂化方式的改变,且有手性碳原子形成
D、若反应④是原子利用率100%的反应,则另一反应物为直线形分子
(6)、参考上述合成路线,以苯、为原料,合成
混合,最多可生成2种二肽
B、反应①中,有键和键的断裂
C、反应③中,存在C原子杂化方式的改变,且有手性碳原子形成
D、若反应④是原子利用率100%的反应,则另一反应物为直线形分子
(6)、参考上述合成路线,以苯、为原料,合成 。
。①由合成
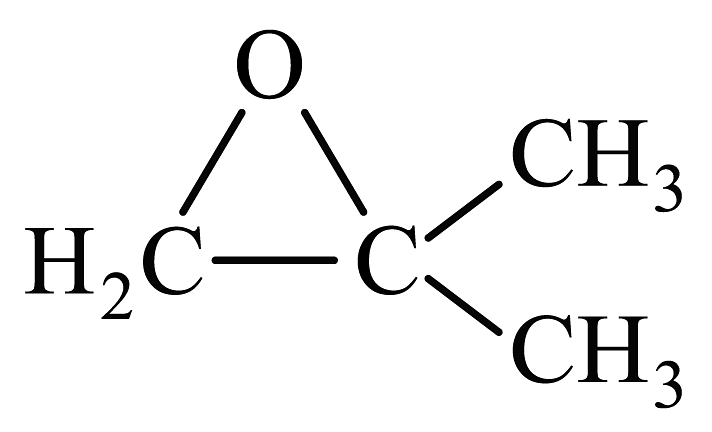 , 第一步反应的化学方程式为(注明反应条件)。
, 第一步反应的化学方程式为(注明反应条件)。②从苯出发,第一步反应的化学方程式为(注明反应条件)。
-
8、铂族金属是国家战略性金属,被誉为“现代工业维他命”。从某矿渣[含钯(Pd)、铂(Pt)、FeS、NiS及等]中提取Pd、Pt、Ni的工艺如下。
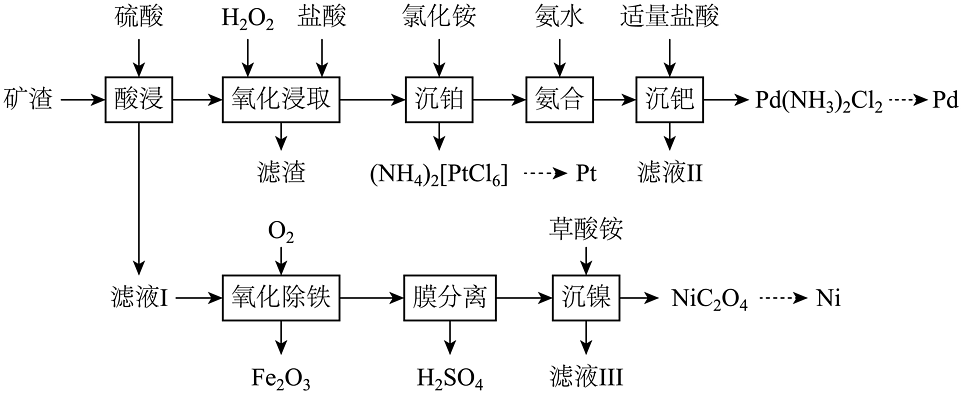
已知:Pd、Pt经“氧化浸取”转化为、;“氨合”后,Pd(Ⅱ)主要以的形式存在;常温下,的 , 。
(1)、Pt、Pd与Fe为同族元素,位于元素周期表的区。(2)、“氧化浸取”时,Pd发生反应的化学方程式为。(3)、“滤液Ⅱ”中的溶质可在工序中循环利用。(4)、“氧化除铁”时,温度为180℃,该过程主要发生两步反应:(ⅰ)
(ⅱ)(填离子方程式)。
(5)、常温下,“沉镍”时,需调节溶液pH=2,此时。(6)、含钯催化剂可与其他催化剂协同催化乙烯氧化为乙醛的反应,该催化氧化反应经历如图所示5步(①→⑤),其中发挥催化作用的阳离子有和。 (7)、含Pd、Cs、I的化合物可用于太阳能电池材料。一定条件下,其中一种晶体可由立方结构(结构单元如图ⅰ所示)转化为四方结构(晶胞结构如图ⅱ所示),两种结构的棱边夹角均为90°,且转化过程中原子个数比保持不变。
(7)、含Pd、Cs、I的化合物可用于太阳能电池材料。一定条件下,其中一种晶体可由立方结构(结构单元如图ⅰ所示)转化为四方结构(晶胞结构如图ⅱ所示),两种结构的棱边夹角均为90°,且转化过程中原子个数比保持不变。
①立方结构中Pd、Cs、I的原子个数比为;
②立方结构单元与四方晶胞结构的密度之比为。
-
9、
溶解过程常伴随热量变化。
Ⅰ.配制500mL 0.5mol/L盐酸。
(1)需12mol/L浓盐酸的体积为________mL(精确至小数点后一位)。
(2)该过程不需用到的仪器有________(填标号)。
A.
 B.
B. C.
C. D.
D. E.
E.
(3)下列操作会导致所配制溶液的浓度偏高的是___________(填标号)。
A. 转移溶液时部分溶液洒出 B. 转移溶液时未洗涤烧杯内壁 C. 定容时俯视刻度线 D. 加水超过刻度线,将多余液体吸出 Ⅱ.测定的溶解焓:
已知:在不同温度下的溶解度如下表:
温度/℃
10
20
30
40
溶解度/g
0.18
0.17
0.15
0.14
(4)利用量热法测定
初步实验 甲同学取一定质量固体完全溶解于一定体积的水中,利用量热计测算溶解前后体系的温度差,代入公式 , 再计算得出。
发现问题 ①甲同学实验结果误差较大,乙同学结合在水中的溶解性,分析其原因是________。
优化实验 ②乙同学根据相关原理间接测算:先测算固体与过量稀盐酸反应的焓变;再测算反应________(填离子方程式,需注明物质的聚集状态)的焓变。最后,计算得出为。
(5)为避免实验过程热量损失引起实验误差,该小组同学尝试其他实验方案。
查阅资料 不同温度下,物质的溶度积常数与满足(R、C为常数,)
实验思考 ①根据饱和溶液中和的关系,推出________[用仅含的式子表示,忽略水的电离]。测定不同温度下饱和溶液的pH,再结合相应温度下水的离子积常数 , 即可求算出不同温度下。
设计实验 方案1 将20℃的饱和溶液逐步升温至40℃,每隔5℃测量并记录溶液pH;
方案2 将40℃的饱和溶液逐步降温至20℃,每隔5℃测量并记录溶液pH。
②应选择________(填“方案1”或“方案2”)进行实验;选择该方案的依据是________。
数据处理 绘制随的变化曲线如图。
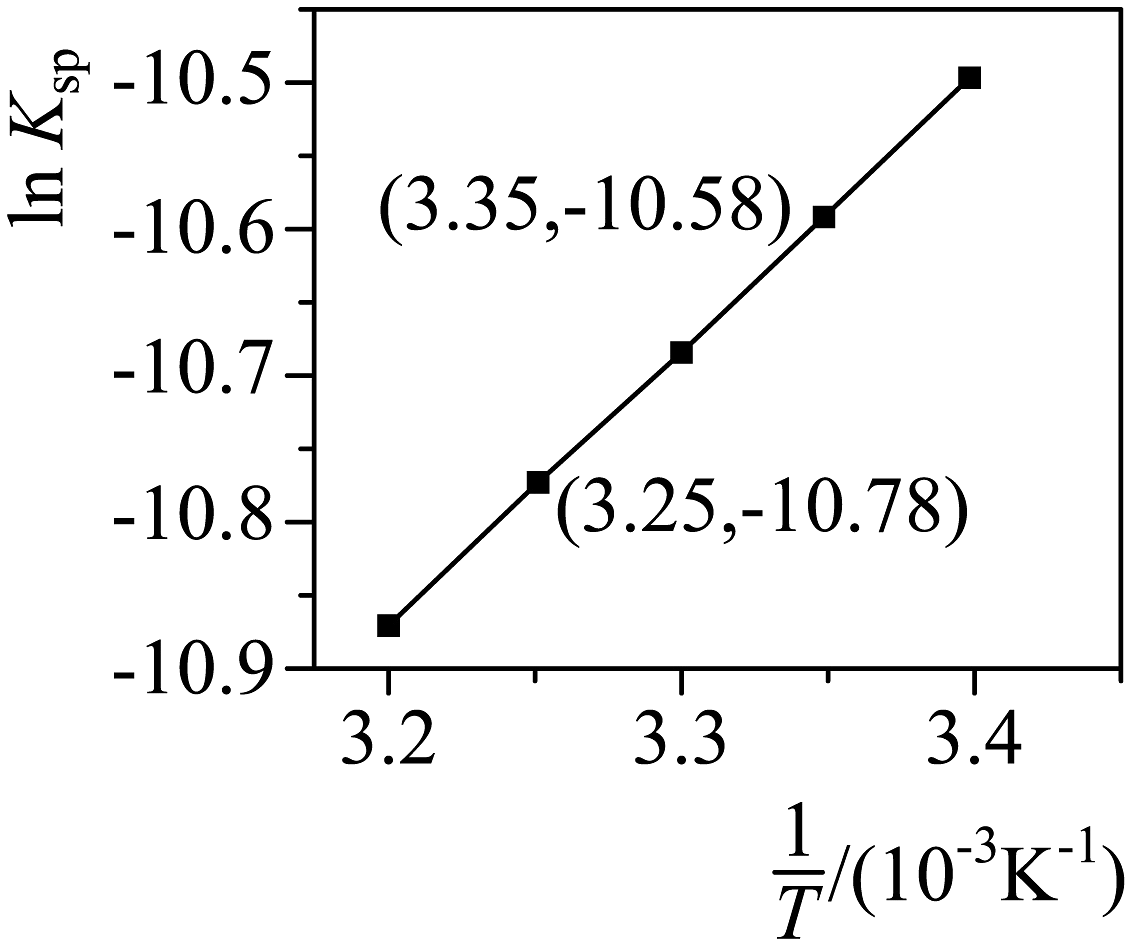
③根据公式,利用直线的斜率值,计算________(保留三位有效数字)。
-
10、化学镀镍废水经分离处理后得到含磷废液(主要含)和含镍废液(主要含),分别通入如图所示电解装置的两极室回收磷、镍。已知:是一元中强酸;25℃时,的、、。电解过程中,下列说法不正确的是
 A、阳极的主要反应为 B、Ⅰ室溶液的pH逐渐增大,Ⅱ室溶液的pH逐渐减小 C、理论上,每生成1mol Ni,同时处理0.5mol D、理论上,电路中每转移1mol , Ⅲ室溶液质量减少65g
A、阳极的主要反应为 B、Ⅰ室溶液的pH逐渐增大,Ⅱ室溶液的pH逐渐减小 C、理论上,每生成1mol Ni,同时处理0.5mol D、理论上,电路中每转移1mol , Ⅲ室溶液质量减少65g -
11、四种燃煤烟气脱硫方法的原理如图,下列说法不正确的是
 A、方法1中,吸收前后的溶液中硫元素的化合价未发生改变 B、若烟气中还含有 , 采用方法2可实现同时脱硫脱硝 C、方法3中能循环利用的物质是NaOH D、方法4中与CO反应,氧化剂与还原剂的物质的量之比为2:1
A、方法1中,吸收前后的溶液中硫元素的化合价未发生改变 B、若烟气中还含有 , 采用方法2可实现同时脱硫脱硝 C、方法3中能循环利用的物质是NaOH D、方法4中与CO反应,氧化剂与还原剂的物质的量之比为2:1 -
12、水煤气变换反应是获取的重要方式之一,在不同催化剂作用下,其反应历程如图所示(*表示吸附态)。下列说法正确的是
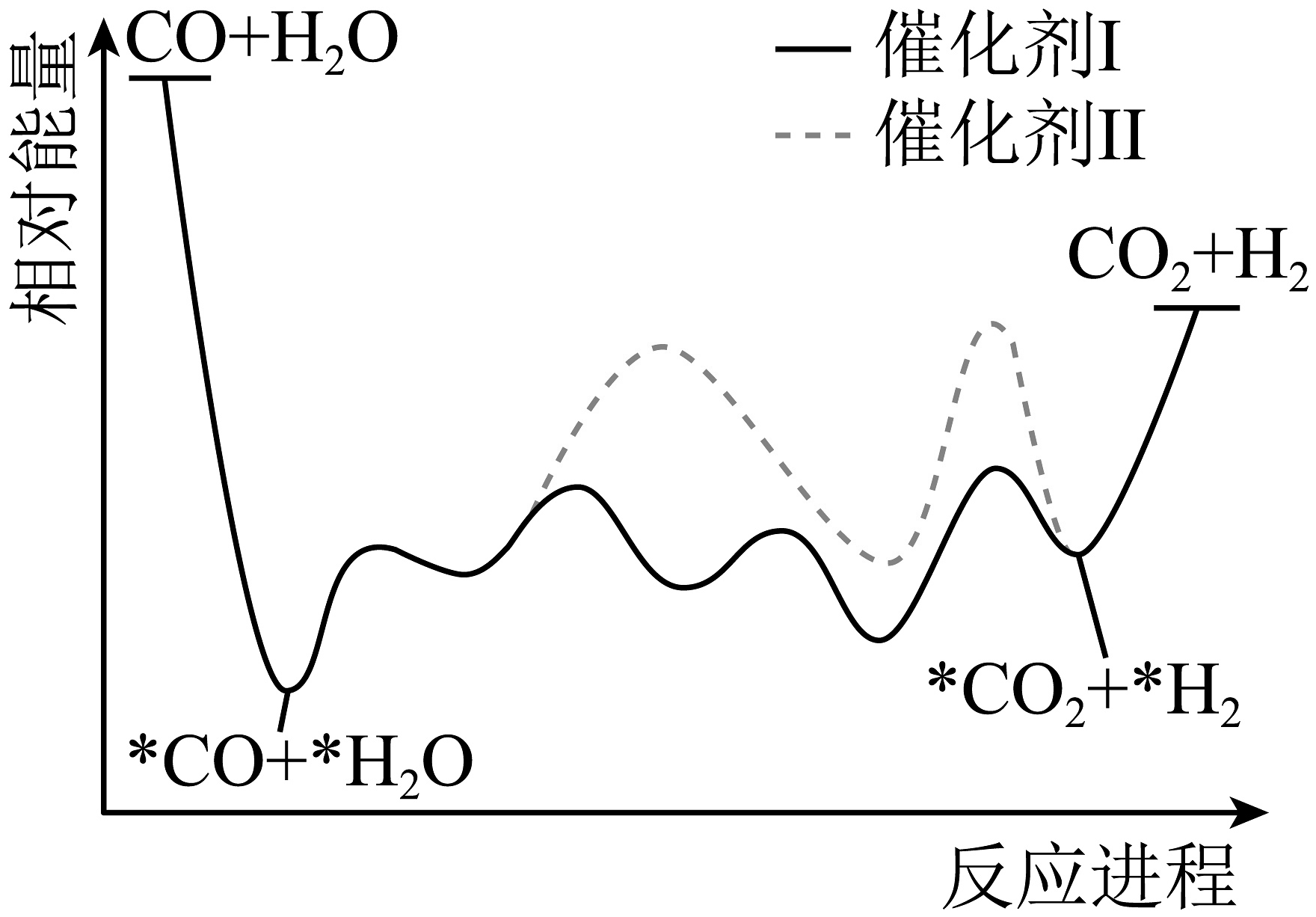 A、使用Ⅰ、Ⅱ,反应历程均分4步进行 B、反应达平衡时,增大压强,增大 C、使用Ⅰ时,反应体系更快达到平衡 D、Ⅰ、Ⅱ均能降低反应的焓变
A、使用Ⅰ、Ⅱ,反应历程均分4步进行 B、反应达平衡时,增大压强,增大 C、使用Ⅰ时,反应体系更快达到平衡 D、Ⅰ、Ⅱ均能降低反应的焓变 -
13、化合物可作催化剂,所含的5种主族元素在每个短周期均有分布,W与Z同族,X、W、Y同周期且原子序数依次递增。X与W的基态原子未成对电子数相同,W的基态原子p能级电子数与s能级电子数相等。下列说法正确的是A、第一电离能:W>Y B、最高价氧化物的水化物的酸性:X>Z C、简单氢化物的沸点:Z>W D、和的VSEPR模型均为四面体形
-
14、实验室利用如图所示装置模拟氨的催化氧化实验。用酒精灯预热催化剂至红热后,移开酒精灯并向试管中注入浓氨水;一段时间后,烧瓶中有红棕色气体产生,再向烧瓶中注入浓氨水,烧瓶中有白烟产生。下列说法正确的是
 A、每消耗0.1mol 生成0.1mol B、催化剂持续红热,说明氨的催化氧化反应为吸热反应 C、烧瓶中有红棕色气体产生,说明被直接氧化为 D、烧瓶中所产生的白烟的主要成分为
A、每消耗0.1mol 生成0.1mol B、催化剂持续红热,说明氨的催化氧化反应为吸热反应 C、烧瓶中有红棕色气体产生,说明被直接氧化为 D、烧瓶中所产生的白烟的主要成分为 -
15、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
当镀层破损时,马口铁(镀锡钢板)比白铁皮(镀锌钢板)更难被腐蚀
用牺牲阳极法防止金属腐蚀
B
冠醚可用于识别碱金属离子
不同空穴大小的冠醚可与不同的碱金属离子形成超分子
C
酸性:
烷基是推电子基团,烷基越长推电子效应越小
D
向溴乙烷水解后的上层溶液中,滴入几滴溶液,有淡黄色沉淀生成
溴乙烷中存在溴离子
A、A B、B C、C D、D -
16、设为阿伏加德罗常数的值。下列说法正确的是A、22.4L乙炔中含有σ键的数目为3 B、1L 1.5 溶液中的数目为1.5 C、46g 和的混合气体含有的原子数目为3 D、溶液与溶液反应生成1mol S,转移电子数目为2
-
17、锂-氟化碳()电池具有优异的性能。该电池的总反应为 , 电池工作时,下列说法正确的是A、锂电极为正极 B、电子由Li电极经导线流向电极 C、负极反应为 D、将电能转化为化学能
-
18、白木香醛(如图)是沉香精油的主要成分之一。下列关于该化合物的说法不正确的是
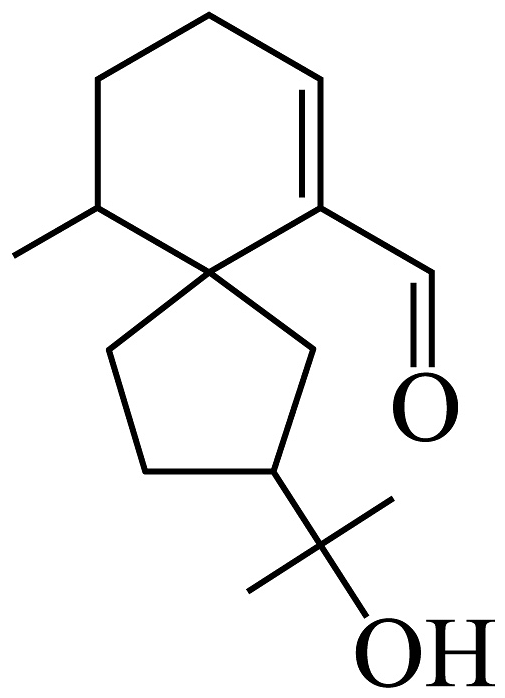 A、能发生银镜反应 B、能使溴的四氯化碳溶液褪色 C、其结构中两个碳环一定共平面 D、1mol该化合物与足量Na反应可产生0.5mol
A、能发生银镜反应 B、能使溴的四氯化碳溶液褪色 C、其结构中两个碳环一定共平面 D、1mol该化合物与足量Na反应可产生0.5mol -
19、为达到相应实验目的,下图所示实验装置不合理的是
 A、图甲:分离正己烷(沸点69℃)和正庚烷(沸点98℃) B、图乙:提纯粗苯甲酸时,趁热过滤去除不溶物 C、图丙:完成乙酸乙酯制备后,分离有机相和水相 D、图丁:用盐酸标准液滴定未知浓度的NaOH溶液
A、图甲:分离正己烷(沸点69℃)和正庚烷(沸点98℃) B、图乙:提纯粗苯甲酸时,趁热过滤去除不溶物 C、图丙:完成乙酸乙酯制备后,分离有机相和水相 D、图丁:用盐酸标准液滴定未知浓度的NaOH溶液 -
20、下列化学方程式或离子方程式书写正确的是A、溶液与NaOH溶液反应: B、高温下Fe与反应: C、与冷的石灰乳反应: D、铜丝与热的浓硫酸反应: