相关试卷
- 江苏省如皋中学2025-2026学年高三上学期测试(一)化学试题
- 广西壮族自治区来宾市多校2025-2026学年高二上学期11月期中联考 化学试题
- 江苏省苏州市吴江区汾湖高级中学2025-2026学年高二上学期9月月考化学试题
- 北京市第八十中学2025-2026学年高三上学期9月月考化学试题
- 贵州省铜仁市思南中学2025-2026学年高三上学期10月月考 化学试题
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 江苏省泰州市靖江高级中学2025-2026学年高一上学期9月月考化学试题
- 四川省泸州市泸县第五中学2025-2026学年高三上学期10月月考化学试题
- 贵州省安顺市普定县第一中学2025-2026学年高一上学期9月月考化学试题
-
1、敦煌壁画色彩瑰丽,其所用的有机颜料主要从动植物中提取色素经过加工而制成,其中紫胶红色素的结构如图所示,则下列关于紫胶红色素的说法不正确的是
 A、能与氨基酸的氨基发生反应 B、其环系结构中4个六元环一定共平面 C、该有机物最多可以消耗 D、其中碳原子的杂化方式有和
A、能与氨基酸的氨基发生反应 B、其环系结构中4个六元环一定共平面 C、该有机物最多可以消耗 D、其中碳原子的杂化方式有和 -
2、劳动创造美好生活。下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
学工活动:玻璃工用氢氟酸生产磨砂玻璃
氢氟酸具有弱酸性
B
科学用药:补铁剂搭配维生素C同时服用
维生素C具有还原性
C
帮厨活动:将水果、蔬菜等放入冰箱储存
降低温度,能降低反应速率
D
自主探究:用红热铁针、石蜡和水晶验证晶体的各向异性
晶体内部质点排列具有有序性
A、A B、B C、C D、D -
3、点蚀又称小孔腐蚀,是一种极端的局部腐蚀形态,大多数点蚀是由引起的。曾侯乙青铜编钟发生点蚀的基本原理为 , 下列说法不正确的是A、潮湿的空气会加速曾侯乙青铜编钟的腐蚀 B、负极反应为 C、点蚀的过程中化学能转化为电能 D、长江中的轮船比大海中的轮船更容易发生点蚀
-
4、碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海带中含有丰富的碘元素,其以碘离子的形式存在,海带提碘的工艺流程如图所示,下列说法正确的是
 A、“灼烧”用到的主要仪器有蒸发皿 B、“氧化”时作还原剂 C、“萃取”时有色层出现在下层 D、“反萃取”发生的主要反应的化学方程式可能为
A、“灼烧”用到的主要仪器有蒸发皿 B、“氧化”时作还原剂 C、“萃取”时有色层出现在下层 D、“反萃取”发生的主要反应的化学方程式可能为 -
5、化学使生活更美好,人类的衣食住行皆离不开化学。下列说法涉及的有关化学知识中,不正确的是A、新衣扮靓迎佳节,媒染剂中的金属离子能与有机色素生成稳定的配合物起到固色作用 B、均衡膳食助健康,蔬果中的纤维素可在人体内水解为葡萄糖 C、爆竹烟花迎佳节,烟花呈现的不同焰色是因为不同金属元素有不同的发射光谱 D、能源产业助环保,钙钛矿太阳能电池实现了太阳能转化为电能
-
6、金属冶炼的发展史铭刻着化学对人类社会的重大贡献。下列说法不正确的是A、“美人首饰王侯印,尽是沙中浪底来”,古人可以利用密度差异获取金 B、“有胆泉,出观音石,可浸铁为铜”,可以利用置换反应冶炼铜 C、生物冶金技术可以利用微生物的代谢来提取有色金属,其温度越高,提取速率越快 D、电化学法冶炼金属Na可以在的氛围中进行
-
7、科技是国家强盛之基,创新是民族进步之魂,下列有关说法不正确的是A、“奋斗者”号潜水器外壳材料为钛合金,钛元素位于元素周期表的区 B、“祖冲之二号”量子计算机中的半导体存储器的主要成分为硅单质 C、“华龙一号”核电项目所用铀棒含有的和互为同位素 D、“天宫一号”空间站中太阳能电池的主要材料GaAs属于合金
-
8、“传承文化遗产,飞扬华夏风采”,中华文物传承华夏文明,下列文物中主要由无机金属材料制成的是




A.秦兵马俑
B.人面鱼纹陶盆
C.西周利簋
D.击鼓说唱俑
A、A B、B C、C D、D -
9、化合物V是一种重要的免疫增强剂,工业上可以进行如下路线的合成:
 (1)、化合物Ⅰ的名称为。(2)、化合物Ⅱ中含氧官能团的名称是。化合物Ⅱ的某种同分异构体,在核磁共振氢谱图上只有4组峰,能够发生银镜反应,且苯环上的一氯代物有3种,其结构简式为。(3)、关于上述示意图中的相关物质及转化,下列说法正确的有___________。A、化合物Ⅴ中存在3个手性碳原子 B、由化合物Ⅰ到Ⅱ的转化中,有π键的断裂与形成 C、由化合物Ⅱ到Ⅲ以及由Ⅳ到Ⅴ的转化过程,反应类型相同 D、化合物Ⅴ中N原子的杂化方式为杂化(4)、对化合物Ⅴ,分析预测其可能的化学性质,完成下表。
(1)、化合物Ⅰ的名称为。(2)、化合物Ⅱ中含氧官能团的名称是。化合物Ⅱ的某种同分异构体,在核磁共振氢谱图上只有4组峰,能够发生银镜反应,且苯环上的一氯代物有3种,其结构简式为。(3)、关于上述示意图中的相关物质及转化,下列说法正确的有___________。A、化合物Ⅴ中存在3个手性碳原子 B、由化合物Ⅰ到Ⅱ的转化中,有π键的断裂与形成 C、由化合物Ⅱ到Ⅲ以及由Ⅳ到Ⅴ的转化过程,反应类型相同 D、化合物Ⅴ中N原子的杂化方式为杂化(4)、对化合物Ⅴ,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
①

②
催化氧化反应
(5)、由化合物Ⅲ到Ⅳ的转化中,生成一种副产物,其分子式为 , 请写出其结构简式为。(6)、以1,2-二溴乙烷和为有机原料,合成 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:①第一步反应的化学方程式为(注明反应条件)。
②第二步的产物与反应的物质的量之比为。
③最后一步的反应条件是。
-
10、酸性溶液主要组成为HCl与(HCl与会络合为),其具有溶铜速率快、稳定、易控制及易再生等优点,常应用于印刷线路板(PCB)的刻蚀。刻蚀原理为 , 。(1)、CuCl中基态亚铜离子的价层电子轨道表示式为。(2)、溶液中存在平衡:(蓝色)(黄色) , 下列说法不正确的是___________(填序号)。A、加入几滴溶液,平衡逆向移动 B、加热溶液,溶液由蓝绿色变为黄绿色,平衡常数K增大 C、加水稀释,的比值会减小 D、加入少量NaCl固体,平衡正向移动,转化率增大(3)、盐酸的浓度会影响刻蚀速率,浓度相同,盐酸浓度分别为1.5mol/L、2.5mol/L、3.0mol/L时,随时间的变化曲线如图所示,中间速率变缓慢的可能原因是。mol/L时,在0~1.5min内,的平均生成速率为。
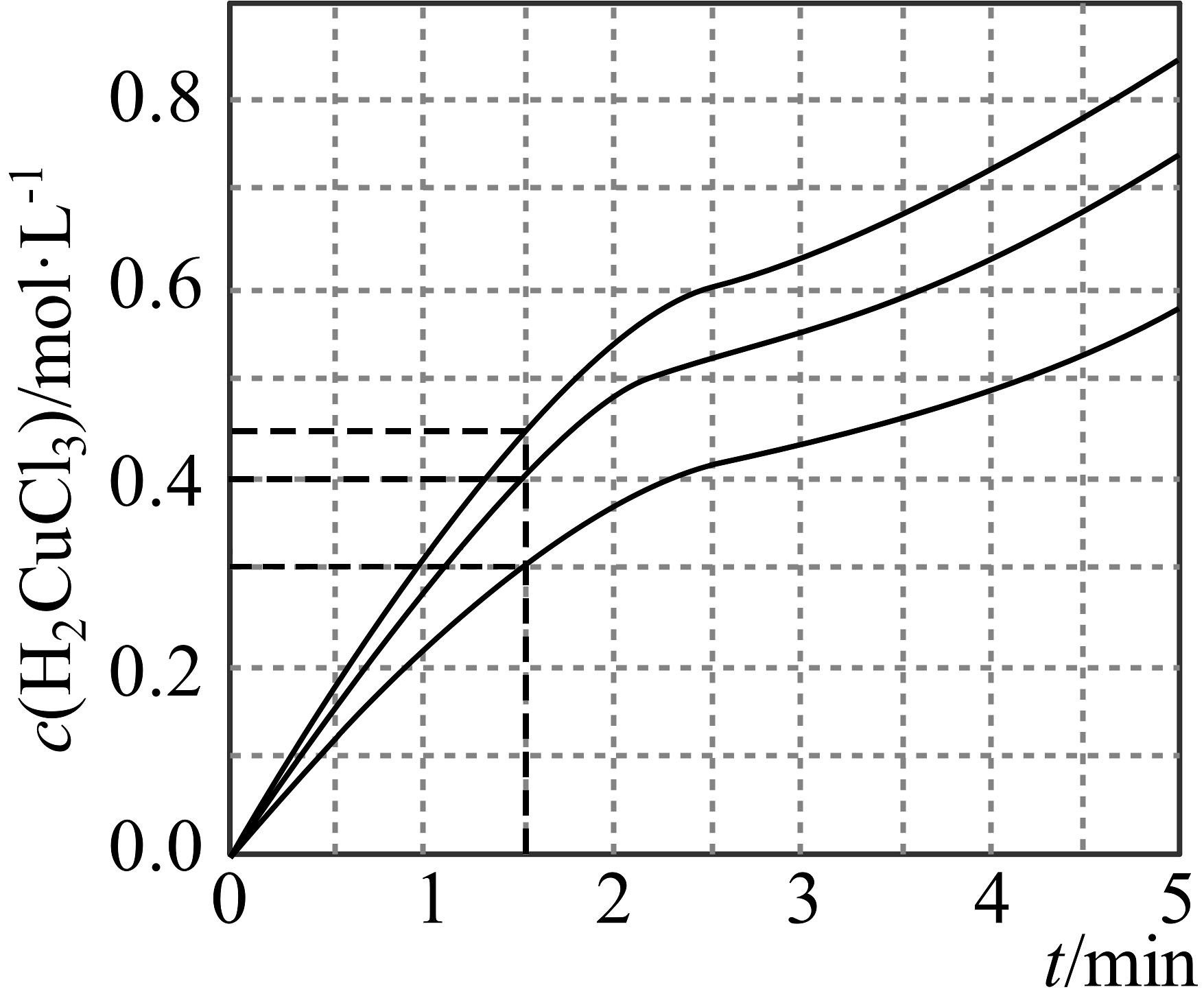 (4)、能形成多种配合物。铜氨溶液具有显著的抗菌作用。往0.2mol/L溶液中通入氨气,测得和铜氨各级配合物的物质的量分数与平衡体系的(浓度的负对数)的关系如图所示。
(4)、能形成多种配合物。铜氨溶液具有显著的抗菌作用。往0.2mol/L溶液中通入氨气,测得和铜氨各级配合物的物质的量分数与平衡体系的(浓度的负对数)的关系如图所示。
①曲线4代表的含铜微粒为。
②b点的纵坐标为。
③结合图像信息,计算反应的平衡常数K=。(已知的 , 写出计算过程)
-
11、工业上利用黑钨矿(其主要成分是FeWO4、MnWO4 , 还含有少量SiO2和Al2O3)制备钨的工艺流程如下图所示:

已知:①上述流程中,钨的化合价只在最后一步发生改变;②常温下钨酸难溶于水。回答下列问题:
(1)、已知元素钨与铬同族,钨在元素周期表中的位置是第六周期第族,其位于元素周期表区。(2)、提高黑钨矿“焙烧”效率的措施有(任写一条),FeWO4在“焙烧”过程中发生反应的化学方程式为。(3)、“滤渣”的主要成分是(填化学式)。(4)、钨酸钙(CaWO4)和氢氧化钙都是微溶电解质。某温度下Ca(OH)2和CaWO4的饱和溶液中,pc(Ca2+)与pc(阴离子)的关系如图所示,已知:pc(离子)=-lgc(离子)。该温度下将Na2WO4溶液加入石灰乳中得到大量钨酸钙,发生反应的离子方程式为 , 该反应的平衡常数K=。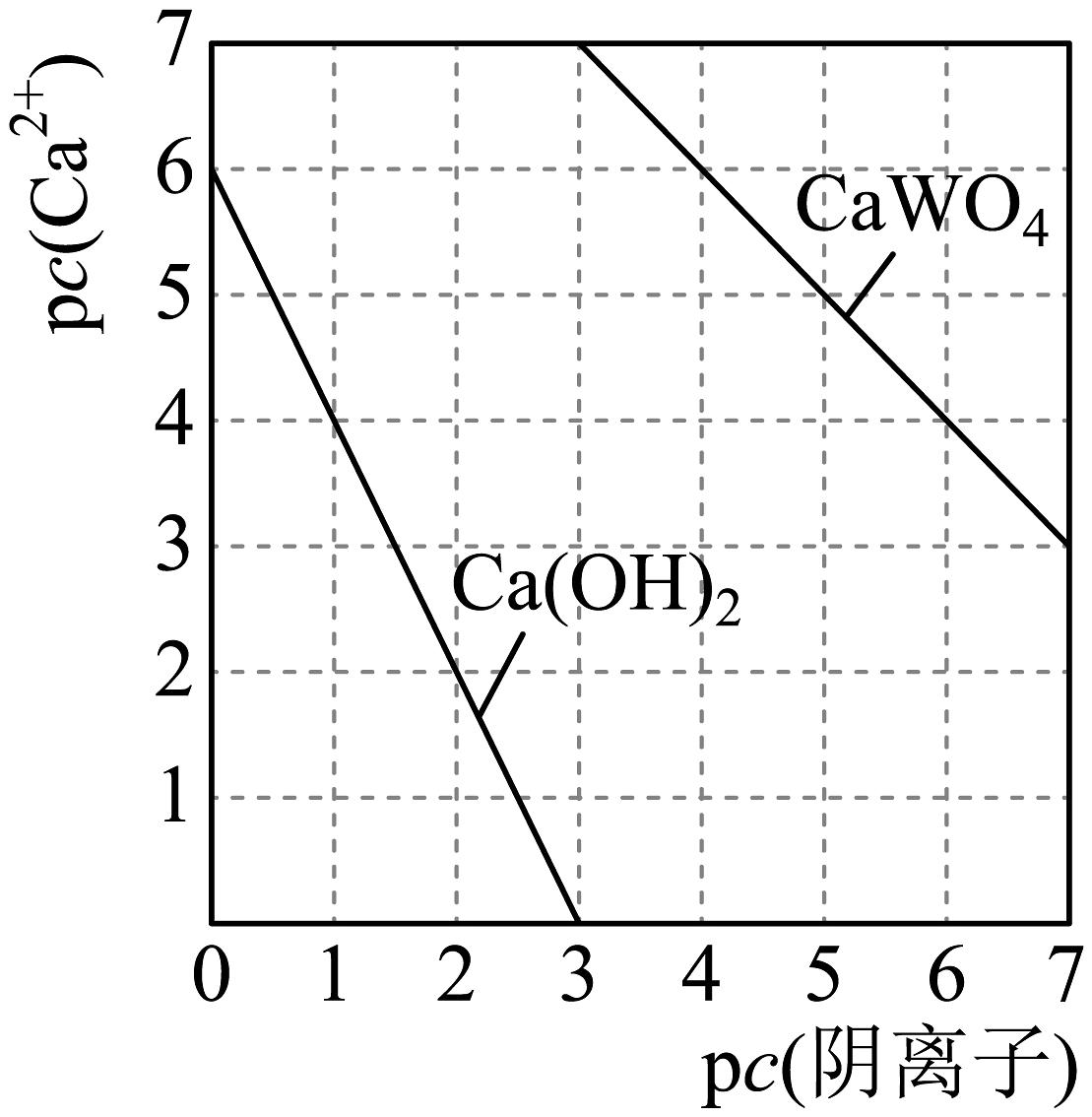 (5)、合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示(已知:Mn原子和Al原子位于Cu原子所构成的八个小正方体的体心)。
(5)、合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示(已知:Mn原子和Al原子位于Cu原子所构成的八个小正方体的体心)。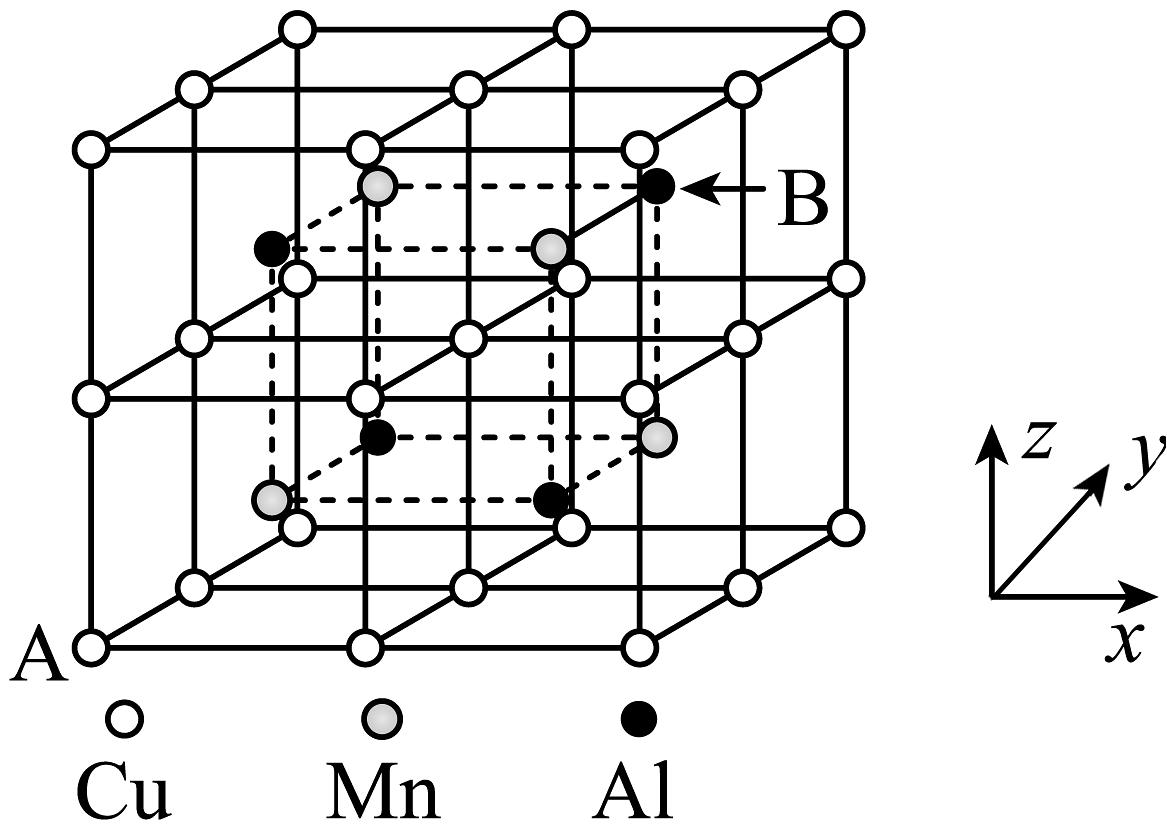
①若A原子的坐标参数为(0,0,0),则B原子的坐标参数为。
②已知该合金晶体的密度为pg·cm-3 , 则最近的两个Al原子间的距离为pm(列出计算式,阿伏加德罗常数的值用NA表示)。
-
12、苯酚能与形成的紫色配合物,该过程属于可逆反应。某小组同学探究铁离子与苯酚的反应。(1)、配制100mL0.1mol/L苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和。(2)、探究铁盐种类和pH对苯酚与显色反应的影响。查阅资料:
ⅰ.对苯酚与的显色反应无影响;
ⅱ.小组同学得出猜想对与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是。
ⅲ.对特定波长光的吸收程度(用吸光度A表示)与浓度在一定范围内成正比。
提出猜想:猜想1:对苯酚与的显色反应有影响
猜想2:对苯酚与的显色反应有影响
进行实验:常温下,用盐酸调节pH,配制得到pH分别为a和b的0.1mol/L溶液();用硫酸调节pH,配制得到pH分别为a和b的0.05mol/L溶液。取4支试管各加入5mL0.1mol/L苯酚溶液,按实验1~4分别再加入0.1mL含的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对水解程度的影响可忽略)。

序号
含的试剂
吸光度
0.1mol/L溶液
0.05mol/L溶液
1
/
Al
2
/
A2
3
/
A3
4
/
A4
结果讨论:实验结果为
①根据实验结果,小组同学认为此结果不足以证明猜想“对与苯酚的显色反应有抑制作用”成立的理由是。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为。

序号
含Fe的试剂
再加入的试剂
吸光度
0.1mol/L溶液
0.05mol/L溶液
5
/
NaCl固体
A5
6
/
试剂M
A6
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且对苯酚与的显色反应起抑制作用,得出此结论的实验依据是:、AlA6(填“>”、“<”或“=”)。
(3)、通过以上实验结论分析:与苯酚相比,对羟基苯甲酸与溶液发生显色反应。(填“更容易”或“更难”)(4)、实验室中常用某些配合物的性质进行物质的检验,请举一例子并说明现象。 -
13、大苏打(Na2S2O3)、苏打(Na2CO3)和小苏打(NaHCO3)被誉为“苏氏三兄弟”,在生产、生活中应用广泛。下列离子方程式不正确的是A、用MnSO4和NaHCO3反应制备MnCO3:Mn2++2=MnCO3↓+CO2↑+H2O B、用Na2S2O3溶液吸收尾气中的Cl2:5H2O+4Cl2+=2+8Cl-+10H+ C、生活中常用泡沫灭火器灭火:2Al3++3+3H2O=2Al(OH)3↓+3CO2↑ D、用Na2S2O3与盐酸反应测反应速率:+2H+=SO2↑+S↓+H2O
-
14、已知二氧化氯(ClO2)为新型绿色消毒剂,沸点为9.9℃,可溶于水、有毒,浓度较高时易发生爆炸。利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置如图所示。

下列说法正确的是
A、实验中通入CO2气体的速率应尽可能慢 B、装置乙中应使用热水浴,以加快反应速率 C、为配制分液漏斗中的混合液,应将甲醇溶液倒入浓硫酸中搅拌 D、若装置甲烧瓶内氧化产物为HCOOH,则氧化剂与还原剂的物质的量之比为4∶1 -
15、下列陈述I与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述I
陈述Ⅱ
A
1mol
 可以和3mol氢气加成
可以和3mol氢气加成1mol
 中含有3mol碳碳双键
中含有3mol碳碳双键B
石墨的硬度比金刚石小很多
石墨中共价键的键能比金刚石小
C
二氧化硫可以使高锰酸钾溶液褪色
二氧化硫具有漂白性
D
酸性:甲酸>乙酸>丙酸
烷基越长推电子效应越大
A、A B、B C、C D、D -
16、实验室可利用反应MnO2+2KBr+3H2SO4MnSO4+2KHSO4+Br2+2H2O制备Br2。设NA代表阿伏加德罗常数的值。下列说法正确的是A、0℃、101kPa下,11.2LH2O所含的分子数为0.5NA B、9.8gH2SO4和H3PO4混合物中含氧原子数为0.4NA C、该反应中生成0.2molBr2时,转移的电子数为0.2NA D、0.1mol/L的KHSO4溶液中含有的离子数为0.3NA
-
17、部分含S(a、b、c、d)和Cl(e、f、g、h)的物质分类与相应化合价的关系如图所示。下列说法正确的是
 A、向h的溶液中通入c,溶液的酸性增强 B、b或f与金属Cu反应的产物中Cu的化合价均为+2 C、d的浓溶液因具有脱水性使胆矾晶体由蓝色变为白色 D、c和g都能使湿润的蓝色石蕊试纸先变红后褪色
A、向h的溶液中通入c,溶液的酸性增强 B、b或f与金属Cu反应的产物中Cu的化合价均为+2 C、d的浓溶液因具有脱水性使胆矾晶体由蓝色变为白色 D、c和g都能使湿润的蓝色石蕊试纸先变红后褪色 -
18、从中草药中提取的calebinA(结构简式如下图)可用于治疗阿尔茨海默症。下列关于calebinA的说法正确的是
 A、该物质在空气中能长时间保存 B、该物质能使高锰酸钾溶液褪色 C、该物质能与溶液反应生成 D、1mol该物质与浓溴水反应,最多消耗2mol
A、该物质在空气中能长时间保存 B、该物质能使高锰酸钾溶液褪色 C、该物质能与溶液反应生成 D、1mol该物质与浓溴水反应,最多消耗2mol -
19、将一块镀层破损的铁片置于海边潮湿环境中,一段时间后铁片如图所示。下列说法正确的是
 A、电子由镀层流向铁 B、铁片凹陷深处产生了较多OH- C、镀层的金属性比铁弱 D、对铁进行了牺牲阳极的阴极保护
A、电子由镀层流向铁 B、铁片凹陷深处产生了较多OH- C、镀层的金属性比铁弱 D、对铁进行了牺牲阳极的阴极保护 -
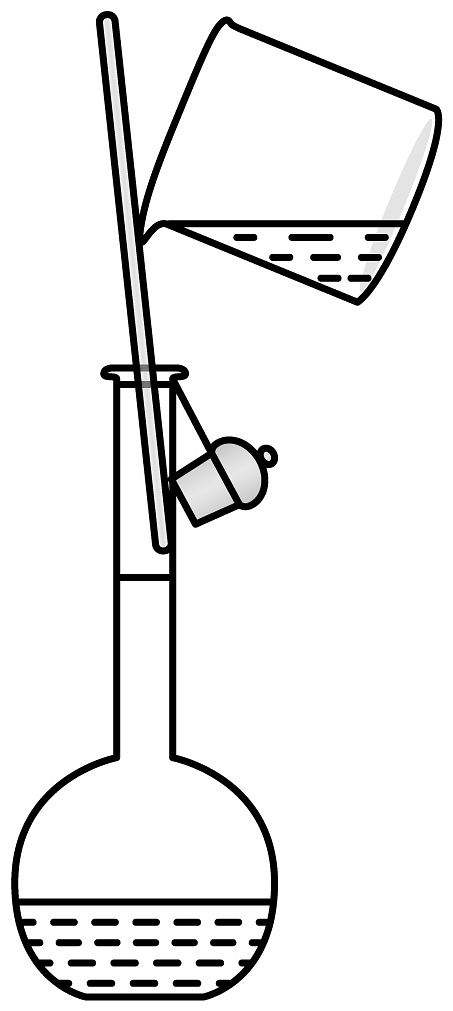
20、下列制备实验中,实验装置及操作均正确的是

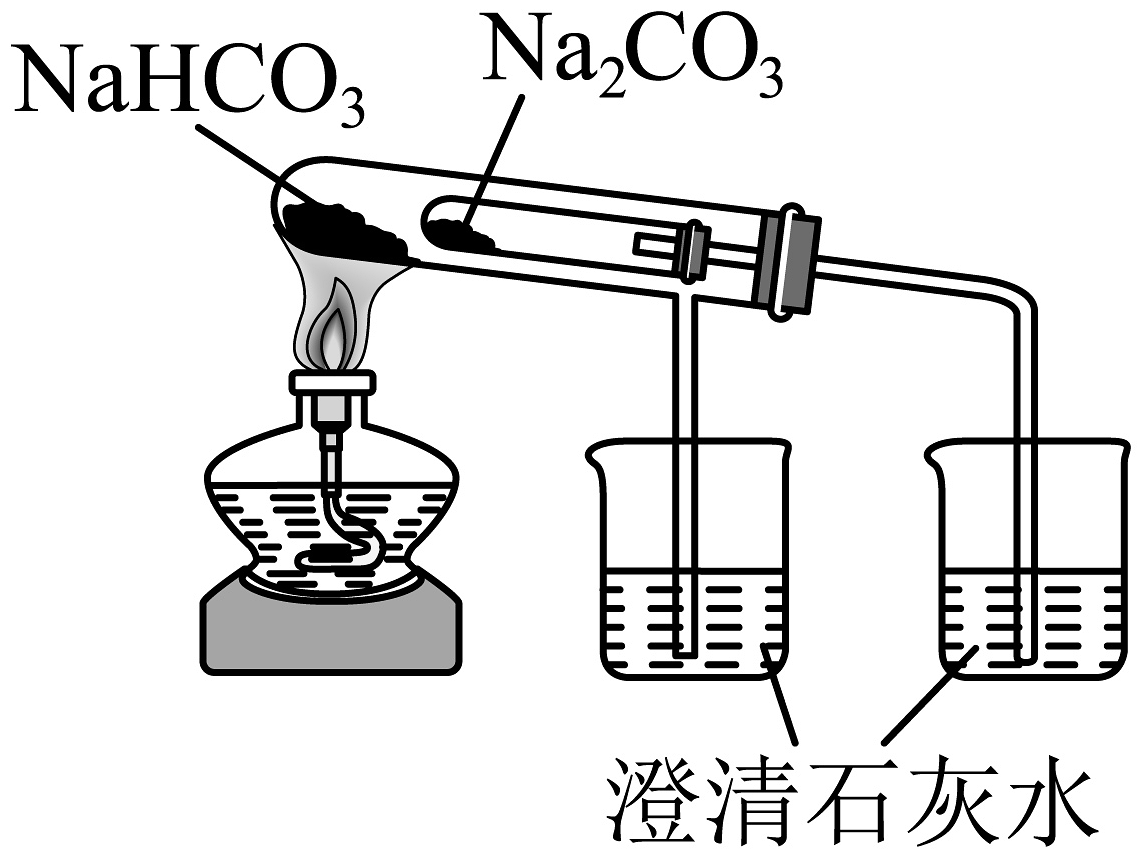
A.用高锰酸钾标准溶液滴定草酸溶液
B.探究苏打和小苏打的稳定性
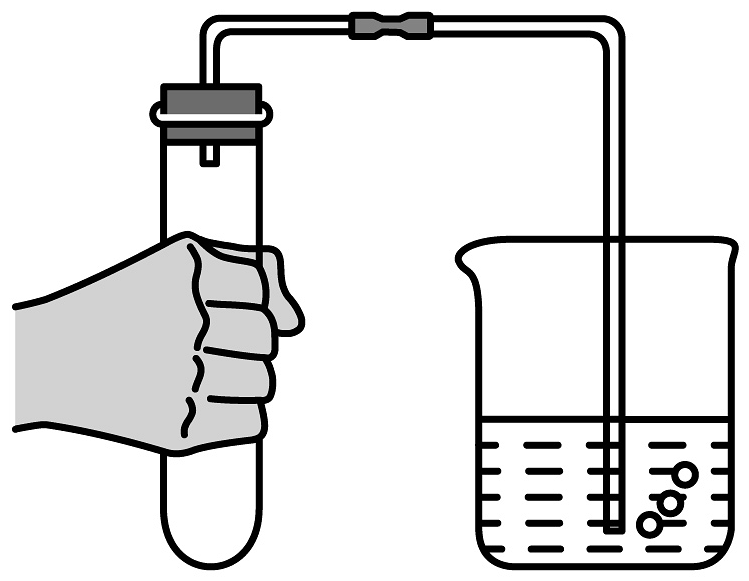
C.检验装置气密性
D.溶液转移
A、A B、B C、C D、D