相关试卷
- 广东省广州市广州中学2025-2026学年九年级上学期九月月考化学试题
- 广东省深圳市多校联考2025-2026学年九年级上学期10月期中化学试题
- 湖南省长沙市开福区青竹湖湘一外国语学校2025-2026学年九年级上学期化学第一次月考试卷
- 湖南省岳阳市岳阳楼区2025-2026学年九年级上学期化学10月月考试卷
- 黑龙江省哈尔滨市2025年化学中考真题试卷
- 河北省石家庄市第四十一中学2025-2026学年九年级上学期10月月考化学试卷
- 青海省西宁市2025年中考化学真题
- 广东省广州外国语学校2025-2026年度九年级上学期9月月考化学试卷
- 四川省自贡市蜀光绿盛实验学校2025-2026学年九年级上学期9月月考化学试题
- 人教版(五四学制)初中化学八年级全一册单元测试-第六单元 碳和碳的氧化物(提升卷)
-
1、氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。请回答问题:
 (1)、m=。(2)、镓形成稳定结构时的符号。(3)、请写出图中镓元素的位置(填“X”、“Y”或“Z”)。
(1)、m=。(2)、镓形成稳定结构时的符号。(3)、请写出图中镓元素的位置(填“X”、“Y”或“Z”)。 -
2、化学是来源于生活,服务于生活的学科,请用化学知识回答以下问题:(1)、氮气具有广泛的用途,常在食品包装袋内充入氮气用于防腐,这是因为氮气的化学性质。(2)、相温库技术极大地方便了人们的生活,相温库中的子库采用单层彩钢板作气密性处理,彩钢(主要成分是铁)是一种带有有机涂层的钢板,有机涂层可以防止钢板生锈,铁生锈属于(填“剧烈”或“缓慢”)氧化。(3)、“淄博烧烤”火遍大江南北,当地人的热情和独特的“炭火烧烤”技术,吸引了一批又一批的游客到淄博“打卡”,请写出木炭在空气中燃烧的文字表达式:。
-
3、实验室中要熟悉实验操作,严格按照实验室规则才能正确、快速、安全地进行实验。(1)、用酒精灯给物质加热时,要用酒精灯火焰的。(2)、用量筒量取液体时,量筒必须平放,视线要与液体保持水平。
-
4、我国科学家在氢化镧晶格的基础上研发出首个室温环境下超快氢负离子导体,这一成果有望引领一系列能源技术革命。氢化镧(LnH)中镧元素的化合价为+1。则氢元素的化合价为A、-2 B、+2 C、+3 D、-1
-
5、稀土是国家战略资源,我国化学家徐光宪在稀土分离技术上做出了杰出贡献,稀土中钬元素在元素周期表中的信息如图,下列说法正确的是
 A、钬原子的质子数为67 B、钬元素是非金属元素 C、钬的相对原子质量为164.9g D、钬原子的中子数为67
A、钬原子的质子数为67 B、钬元素是非金属元素 C、钬的相对原子质量为164.9g D、钬原子的中子数为67 -
6、下列元素名称与其对应的元素符号完全正确的A、氯Cr B、钠NA C、氦he D、镁Mg
-
7、下列物质能在空气中燃烧发出微弱淡蓝色火焰的是A、硫 B、碱 C、铁 D、红磷
-
8、下列物质属于混合物的是A、液氮 B、汞 C、冰 D、矿泉水
-
9、学好化学离不开实验,下列实验操作正确的是A、
 闻气体气味
B、
闻气体气味
B、 往试管里加锌粒
C、
往试管里加锌粒
C、 熄灭酒精灯
D、
熄灭酒精灯
D、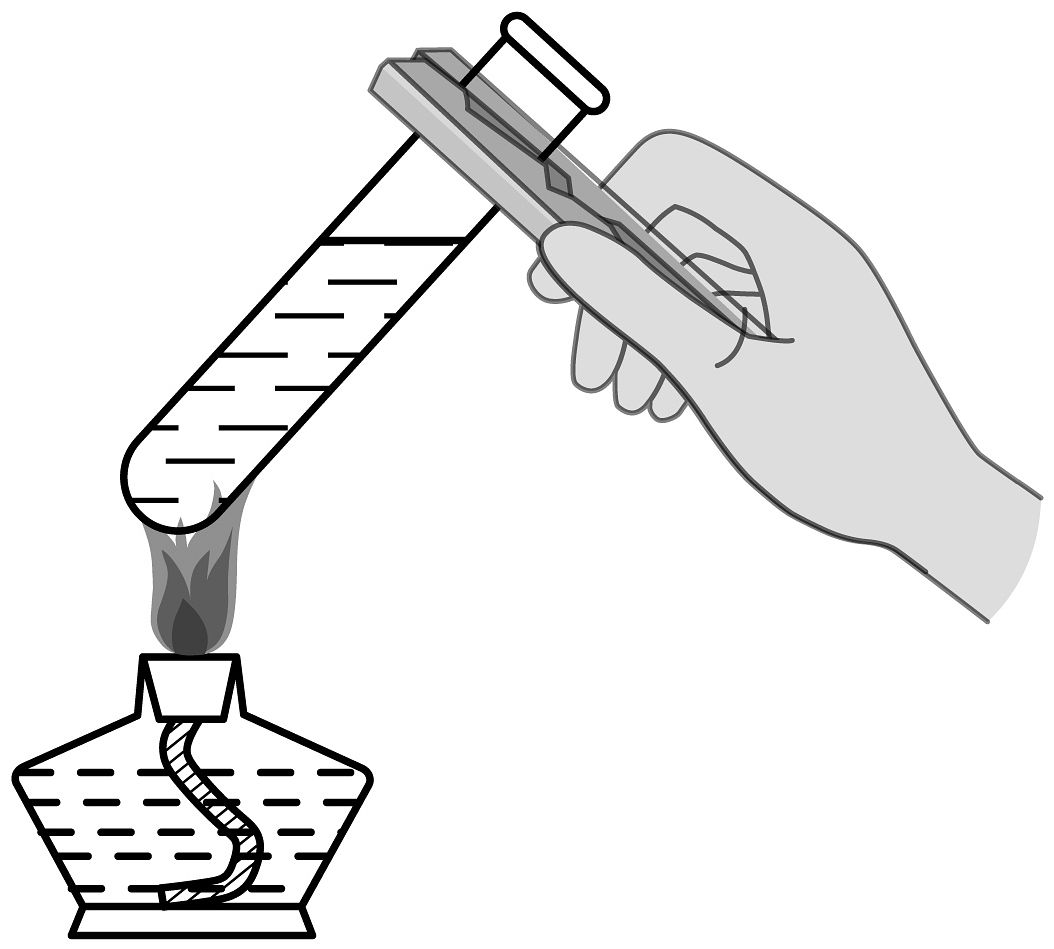 加热液体
加热液体
-
10、下列符合化学实验安全要求的是A、实验中要特别注意保护眼睛 B、加热后的试管立即用冷水冲洗 C、随意丢弃实验室剩余药品 D、易燃、易爆药品放在火源附近
-
11、化学实验室中的仪器种类很多,下列仪器用于收集或贮存少量气体的是A、
 B、
B、 C、
C、 D、
D、
-
12、下列过程中只发生物理变化的是A、纸张燃烧 B、呼吸作用 C、玻璃破碎 D、食物腐烂
-
13、合理施用化肥可提高农作物的产量。碳酸氢铵是一种常见的化肥,其化学式为。(1)、碳酸氢铵的相对分子质量是。(2)、碳酸氢铵中氢、氧元素的质量比是。(3)、现有碳酸氢铵,其中氮元素的质量为g。
-
14、
化学小组在开展“铁丝在氧气中燃烧实验”时,发现不易成功。决定对该实验进行更深入的探究,请你一起参与。
活动一:重现课本实验
[实验1]如图1所示,将细铁丝绑上火柴,点燃火柴,用坩埚钳将细铁丝伸入盛有氧气的集气瓶中。

(1)铁丝在氧气中燃烧,写出该反应的文字表达式。
(2)实验中,点燃火柴后,将铁丝伸入盛有氧气的集气瓶中的最佳时机是待火柴快燃尽时,不宜过早,其目的是防止 , 故进行该实验时,宜选择容积为(填“125”或“250”)的集气瓶更容易成功。
活动二:探究铁丝引燃的方式
实验中发现不容易控制铁丝伸入集气瓶的时间,小组同学进行如下改进。
[实验2]如图2所示,实验中,观察到铁丝剧烈燃烧,火星四射。

(3)如果使用已学过的化学试剂来代替火柴,你会使用(写一种)。
活动三:探究铁丝燃烧时长的影响因素
[实验3]如图3所示,从同一长铁丝上分别截取3根长度相同的铁丝,将1根拉直、另2根绕成直径大小不同的螺旋状,下端系上燃着的小木条进行燃烧实验。每种形状的铁丝平行测量3次,所测得的实验数据如图4所示。

(4)实验中发现不管铁丝形状如何,其燃烧时长均在曲线附近,说明燃烧时长与铁丝是否绕成螺旋状(填“有关”或“无关”)。
(5)分析图4可知,铁丝在氧气中剧烈燃烧的时间与集气瓶内氧气的起始浓度的关系是。
(6)对铁与氧气反应的实验,写一个你认为还可进一步探究的问题是。
-
15、化学小组开展氧气性质和制取的跨学科实践活动,请你一起参与。
 (1)、模拟自然界的光合作用。
(1)、模拟自然界的光合作用。将图1装置置于阳光下一段时间,观察到有气泡产生。该收集气体的方法是 , 检验所收集的气体应进行的操作是。
(2)、利用改进后的图2装置进行炭块的燃烧实验。用气卿(能不断鼓入空气的装置)不断地向弯型具支试管中鼓入空气,同时用酒精灯给炭块加热,一段时间后,可观察到炭块呈红热状态;移去酒精灯,停止鼓入空气,再用酒精灯给高锰酸钾加热,观察到炭块剧烈燃烧,发出白光。
①图2中,仪器a的名称是。
②写出加热高锰酸钾发生反应的文字表达式:。
③实验说明,炭块燃烧的剧烈程度与有关。能说明碳与氧气发生反应,生成二氧化碳的实验现象是。
④实验结束时,应先进行的操作是(填字母序号)。
A.停止加热,熄灭酒精灯 B.将导管移出水面
-
16、
化学小组就“空间站的氧气和水从哪里来”的问题进行了探讨,请你参与。
方案一:从地球带上去。
(1)如图所示,空气通过“分子筛”可获得更高浓度的 , 由此可知两种分子的大小:(填“>”或“<”)。

(2)空间站供氧使用特种材料制成的氧气瓶,可充氧气至300倍大气压,一瓶氧气即可供航天员长时间使用,从微观粒子视角分析其原因:。
方案二:在天宫制取。
(3)早期空间站利用二氧化碳与过氧化钠在常温下反应获得氧气,同时生成碳酸钠。写出该反应的文字表达式:。
(4)如图是空间站内的部分物质循环示意图。

①空间站利用太阳能转为电能,水通电发生反应,获得氧气,该反应属于(填“化合”或“分解”)反应。
②结合图示,请你说出一种空间站内获得水的方法:。
-
17、图1是某品牌制氧杯,图2为内部结构示意图。使用时,先在甲杯中加入制氧剂A、制氧剂B,再加入清水,乙杯加入适量清水,放回,旋紧杯盖即可快速供氧。(制氧剂A是过碳酸钠,在水中溶解后转化为碳酸钠溶液和过氧化氢溶液。制氧剂B是二氧化锰。)
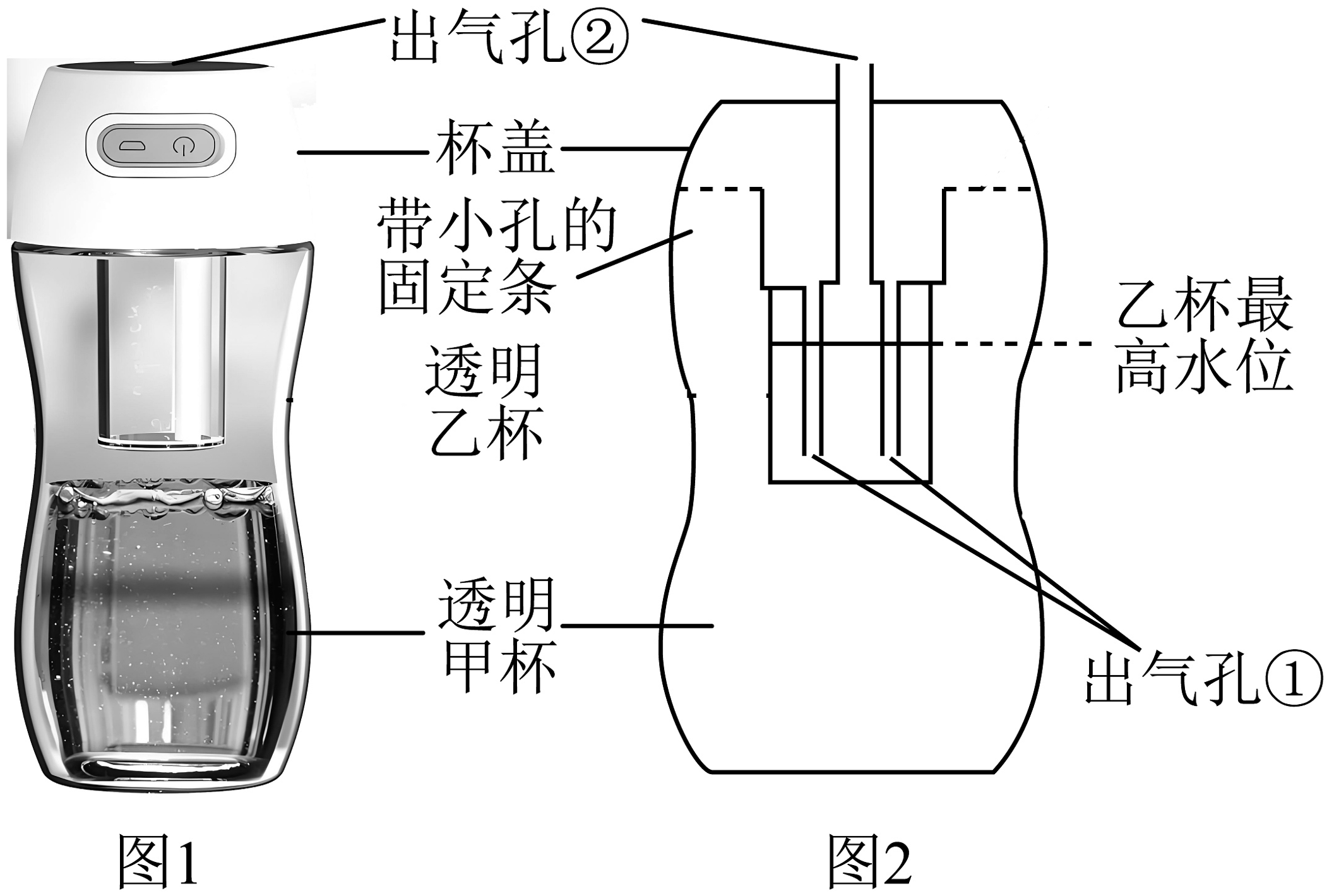 (1)、制氧杯能快速产生氧气的原因是(用文字表达式表示)。(2)、制氧杯使用过程中,手接触制氧杯有温热感,其原因是。(3)、在乙杯中加入清水的作用是(写一种)。(4)、采用透明杯体,当观察到 , 说明反应已结束。(5)、反应结束后,将甲杯中剩余物质进行过滤,所得滤渣(填“能”或“不能”)继续使用。(6)、相比较于大型制氧机、氧气罐供氧,制氧杯的优点是。
(1)、制氧杯能快速产生氧气的原因是(用文字表达式表示)。(2)、制氧杯使用过程中,手接触制氧杯有温热感,其原因是。(3)、在乙杯中加入清水的作用是(写一种)。(4)、采用透明杯体,当观察到 , 说明反应已结束。(5)、反应结束后,将甲杯中剩余物质进行过滤,所得滤渣(填“能”或“不能”)继续使用。(6)、相比较于大型制氧机、氧气罐供氧,制氧杯的优点是。 -
18、“生命吸管”是一种可以随身携带的小型水净化器,其工作原理如图所示。
 (1)、双层纺织网的作用是(填实验操作名称)。(2)、活性炭可以除去水中的色素和异味,是利用其具有性。(3)、碘树脂可杀菌消毒,生活饮用水还可通过来杀灭细菌。(4)、钠离子直径小于0.001微米,“生命吸管”(填“能”或“不能”)淡化海水。生产中常用膜分离技术淡化海水,结合自然界中水的循环,还能用的方法淡化海水。(5)、“生命吸管”使用一定时间后,流速会明显变慢,可能原因是。
(1)、双层纺织网的作用是(填实验操作名称)。(2)、活性炭可以除去水中的色素和异味,是利用其具有性。(3)、碘树脂可杀菌消毒,生活饮用水还可通过来杀灭细菌。(4)、钠离子直径小于0.001微米,“生命吸管”(填“能”或“不能”)淡化海水。生产中常用膜分离技术淡化海水,结合自然界中水的循环,还能用的方法淡化海水。(5)、“生命吸管”使用一定时间后,流速会明显变慢,可能原因是。 -
19、化学与能源密切相关。(1)、核聚变是未来最有希望的能源之一。图1是氢在元素周期表中的部分信息,图2是核聚变的原料之一氚的原子结构模型。

①氢原子的相对原子质量为。
②根据图2分析,图3中能表示氚原子结构示意图的是(填标号)。
③H和T都属于氢元素,是因为它们的相同。
(2)、氢气是理想燃料。①氢气具有可燃性,使用时应注意安全,点燃氢气前要。
②图4是氢气和氧气发生反应的微观模拟示意图,请在横线上补充完整。

-
20、生活中处处有化学。(1)、氮气作食物的保护气,说明氮气的化学性质(填“稳定”或“活泼”)。从宏观角度看,氮气是由组成的。(2)、节日里燃放的烟花中含有镁粉。镁在空气中燃烧的现象是 , 放热,生成白色固体。(3)、食盐,化学名为氯化钠。氯化钠是由(填微粒符号,下同)和构成的。“加碘食盐”中“碘”通常以碘酸钾的形式存在,在中,碘元素的化合价是。