相关试卷
- 广东省广州市广州中学2025-2026学年九年级上学期九月月考化学试题
- 广东省深圳市多校联考2025-2026学年九年级上学期10月期中化学试题
- 湖南省长沙市开福区青竹湖湘一外国语学校2025-2026学年九年级上学期化学第一次月考试卷
- 湖南省岳阳市岳阳楼区2025-2026学年九年级上学期化学10月月考试卷
- 黑龙江省哈尔滨市2025年化学中考真题试卷
- 河北省石家庄市第四十一中学2025-2026学年九年级上学期10月月考化学试卷
- 青海省西宁市2025年中考化学真题
- 广东省广州外国语学校2025-2026年度九年级上学期9月月考化学试卷
- 四川省自贡市蜀光绿盛实验学校2025-2026学年九年级上学期9月月考化学试题
- 人教版(五四学制)初中化学八年级全一册单元测试-第六单元 碳和碳的氧化物(提升卷)
-
1、2022年10月31日,中国空间站梦天实验舱成功发射。梦天舱载有世界上第一套由冷原子锶光钟等组成的空间冷原子钟组。如图是锶的原子结构示意图及有关信息,下列说法正确的是
 A、锶属于非金属元素 B、锶原子的中子数为38 C、锶原子最外层有2个电子,比较容易失去 D、锶的相对原子质量为87.62g
A、锶属于非金属元素 B、锶原子的中子数为38 C、锶原子最外层有2个电子,比较容易失去 D、锶的相对原子质量为87.62g -
2、物质由分子、原子等微观粒子构成,用分子的知识解释下列现象,其中正确的是A、水结成冰,是由于水分子停止了运动 B、水沸腾变成水蒸气,是由于水分子的间隔变小了 C、氧气在加压后可贮存于钢瓶中,是由于分子之间有间隔 D、变瘪了的乒乓球放在热水中鼓起,是由于分子的体积变大
-
3、如图所示用高锰酸钾制取氧气的实验操作中,正确的是A、取用高锰酸钾
 B、检查气密性
B、检查气密性 C、收满后移出集气瓶
C、收满后移出集气瓶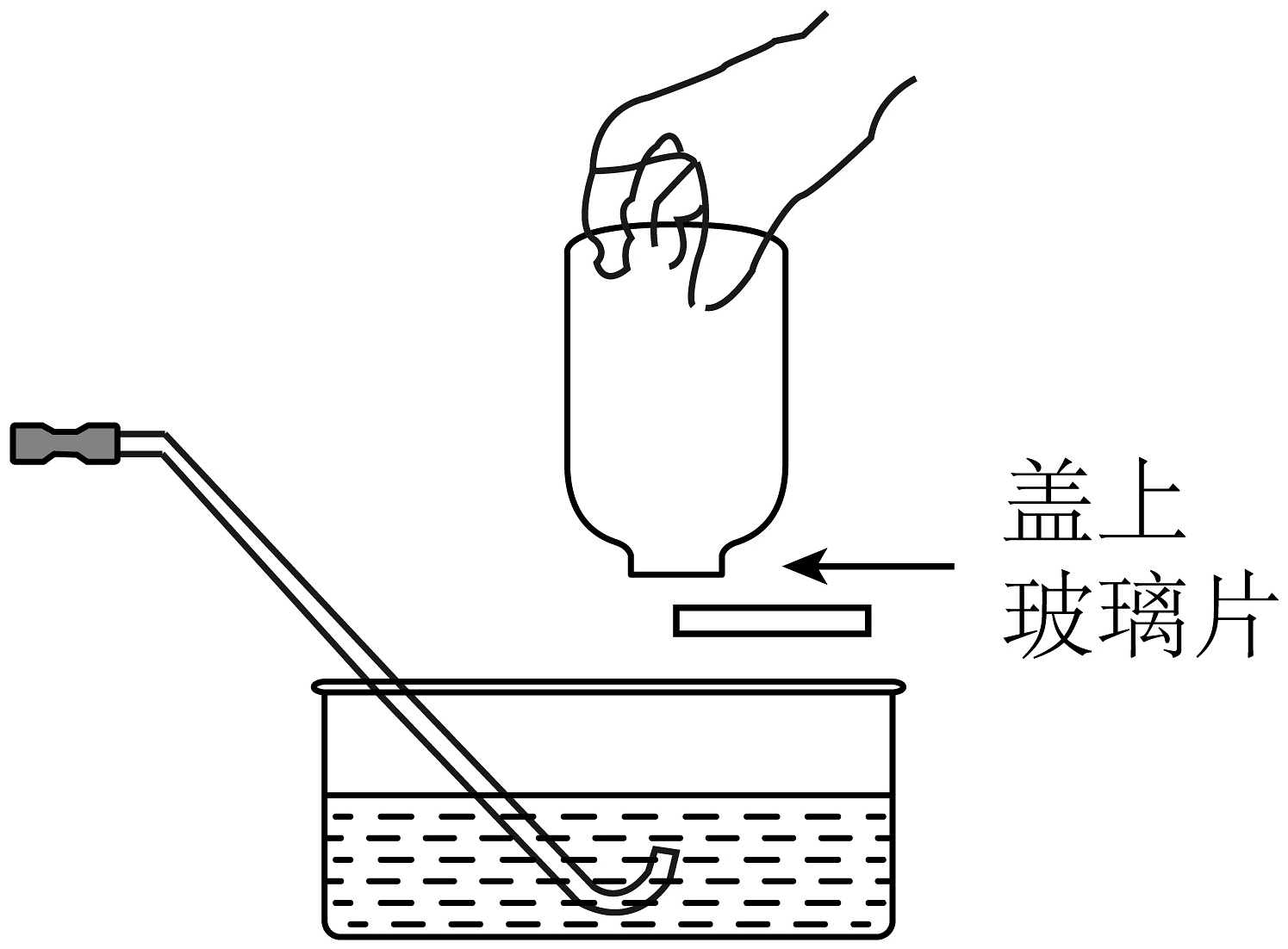 D、处理废渣
D、处理废渣
-
4、物质由微观粒子构成。下列各组物质均由分子构成的是A、铁、氢气 B、金刚石、水 C、液氧、干冰 D、氯化钠、硫酸铜
-
5、下列基本操作正确的是
①如果没有说明药品用量,则固体盖满试管底部即可,液体取1~2mL
②取用一定量的液体药品,没有量筒时可用胶头滴管代替
③打开试剂瓶后要把瓶塞正放在桌面上,标签向着手心,右手拿试剂瓶倒液体试剂
④滴管吸满药液后,管口端要靠在试管壁上,使液体沿管壁流下
⑤取液后的滴管应保持胶帽在上,不要平放或倒置,防止试液倒流,腐蚀胶帽
A、①②③④ B、③⑤ C、②③⑤ D、①⑤ -
6、实验探究是学习化学的重要方法。请根据下列实验装置图回答问题。
 (1)、装置B中仪器①的名称是;请画出氧原子(核电荷数为8)的结构示意图。(2)、实验室加热高锰酸钾固体制取一瓶较纯净的氧气,应选用的一组装置是(填字母序号),写出反应的化学方程式。(3)、A装置中试管口略向下倾斜的原因是;F装置中水的作用是。(4)、欲使用下图装置收集氧气,请将导管补画完整。
(1)、装置B中仪器①的名称是;请画出氧原子(核电荷数为8)的结构示意图。(2)、实验室加热高锰酸钾固体制取一瓶较纯净的氧气,应选用的一组装置是(填字母序号),写出反应的化学方程式。(3)、A装置中试管口略向下倾斜的原因是;F装置中水的作用是。(4)、欲使用下图装置收集氧气,请将导管补画完整。 (5)、已知:氯酸钾粉末在二氧化锰作催化剂并加热的条件下,分解生成氯化钾和氧气。制取19.2g氧气,需要氯酸钾的质量是多少?
(5)、已知:氯酸钾粉末在二氧化锰作催化剂并加热的条件下,分解生成氯化钾和氧气。制取19.2g氧气,需要氯酸钾的质量是多少? -
7、质量守恒定律对科学发展具有重大意义。
 (1)、用如图所示的两个实验装置验证质量守恒定律,其中不能达到实验目的是?请说明理由。(2)、甲图是铜与氧气反应来验证质量守恒。请回答下列问题:铜与氧气反应的化学方程式是;装置中气球和橡胶塞的作用是。(3)、请从微观的角度解释质量守恒定律。
(1)、用如图所示的两个实验装置验证质量守恒定律,其中不能达到实验目的是?请说明理由。(2)、甲图是铜与氧气反应来验证质量守恒。请回答下列问题:铜与氧气反应的化学方程式是;装置中气球和橡胶塞的作用是。(3)、请从微观的角度解释质量守恒定律。 -
8、请写出下列反应的化学方程式。(1)、有黑色固体生成的化合反应:;(2)、有白色固体生成的化合反应:。
-
9、请从分子的角度解释下列生活中的现象。(1)、热水能使压瘪的乒乓球复原。(2)、加油站严禁烟火。
-
10、甲、乙、丙三种物质都含同一种元素,它们之间的转化关系如下图所示(“→”表示反应一步实现,部分物质和反应条件略去)。

已知甲、乙组成元素相同,常温下为液体。丙在空气中含量居第二位。
(1)、甲生成丙的化学方程式为;(2)、从分子角度解释,甲、乙性质有差异的原因是。 -
11、2023年10月26日,我国神舟十七号载人飞船发射取得圆满成功,舱内航天员所用氧气可通过电解水的方法制取。如下图是水的电解实验,a管连接的电极为(填“正极”或“负极”),该反应的化学方程式为;该实验的结论是。

-
12、工业制取氧气常采用法,主要发生(填“物理”或“化学”)变化;过滤时玻璃棒的作用是 , 净化水时主要利用了活性炭的性。
-
13、用化学符号表示:两个硫酸根离子;氯化钠的构成粒子。
-
14、(用化学用语填空)空气中体积分数约为78%的气体是;Si名称为;地壳中含量最高的金属元素与氯元素形成化合物的化学式。
-
15、如图所示的四个图像能正确反映对应变化关系的是
 A、①水在通电条件下分解 B、②高锰酸钾分解制取氧气 C、③红磷燃烧测空气中氧气含量 D、④等质量的过氧化氢分解制取氧气
A、①水在通电条件下分解 B、②高锰酸钾分解制取氧气 C、③红磷燃烧测空气中氧气含量 D、④等质量的过氧化氢分解制取氧气 -
16、推理是初中化学常用的思维方法。下列推理正确的是A、氧化物中含有氧元素,所以含有氧元素的物质一定是氧化物 B、单质只含一种元素,所以由一种元素组成的纯净物一定是单质 C、离子是带电荷的微粒,所以带电荷的微粒一定是离子 D、同种元素的核内质子数相同,所以核内质子数相同的微粒一定属于同种元素
-
17、煤气中加入有特殊臭味的乙硫醇 , 可提醒煤气是否漏。乙硫醇燃烧时发生的反应为。则X是A、CO B、 C、 D、
-
18、以下实验方案中,能达到实验目的的是
选项
A
B
C
D
实验目的
探究能否加快的分解
测定空气中氧气的含量
探究石蜡中含有碳元素
探究分子在不断的运动
实验方案



 A、A B、B C、C D、D
A、A B、B C、C D、D -
19、猕猴桃酸甜可口,富含维生素C(化学式C6H8O6)。下列关于维生素C的说法正确的是A、维生素C中氢元素的质量分数最小 B、维生素C是由碳原子、氢原子和氧原子构成的 C、维生素C是一种氧化物 D、维生素C中碳元素、氢元素和氧元素的质量比为3:4:3
-
20、日常生活中的下列各组物质,前者属于混合物,后者属于单质的是A、高锰酸钾、铁 B、空气、水 C、食醋、氢气 D、冰水混合物、氧气