相关试卷
- 广东省广州市广州中学2025-2026学年九年级上学期九月月考化学试题
- 广东省深圳市多校联考2025-2026学年九年级上学期10月期中化学试题
- 湖南省长沙市开福区青竹湖湘一外国语学校2025-2026学年九年级上学期化学第一次月考试卷
- 湖南省岳阳市岳阳楼区2025-2026学年九年级上学期化学10月月考试卷
- 黑龙江省哈尔滨市2025年化学中考真题试卷
- 河北省石家庄市第四十一中学2025-2026学年九年级上学期10月月考化学试卷
- 青海省西宁市2025年中考化学真题
- 广东省广州外国语学校2025-2026年度九年级上学期9月月考化学试卷
- 四川省自贡市蜀光绿盛实验学校2025-2026学年九年级上学期9月月考化学试题
- 人教版(五四学制)初中化学八年级全一册单元测试-第六单元 碳和碳的氧化物(提升卷)
-
1、下列实验操作正确的是A、液体的倾倒
 B、点燃酒精灯
B、点燃酒精灯 C、闻气体的气味
C、闻气体的气味 D、取用块状固体
D、取用块状固体
-
2、以下是实验室几种物质的“聊天”内容。你认为它们的叙述中属于化学变化的是A、蒸馏水:我被酒精灯加热后蒸发了 B、铁钉:好难受啊,我在潮湿空气中生锈了 C、试管:我不小心掉地上,摔碎了 D、灯泡:我通电后发光了,给大家带来光明
-
3、水是生命之源,人类从未停止过对水的研究。(1)、探秘水的净化

①“生命吸管”可以解决野外极限环境中的饮水问题。“生命吸管”中PP棉的作用相当于净水方法中的(填操作名称),活性炭的作用是利用其具有性。
②自制净水器净水材料的选择需要考虑的因素有(写一条)。
③我国目前海水淡化能力超过160万吨每天,可将海水淡化的方法是。
(2)、探究水的组成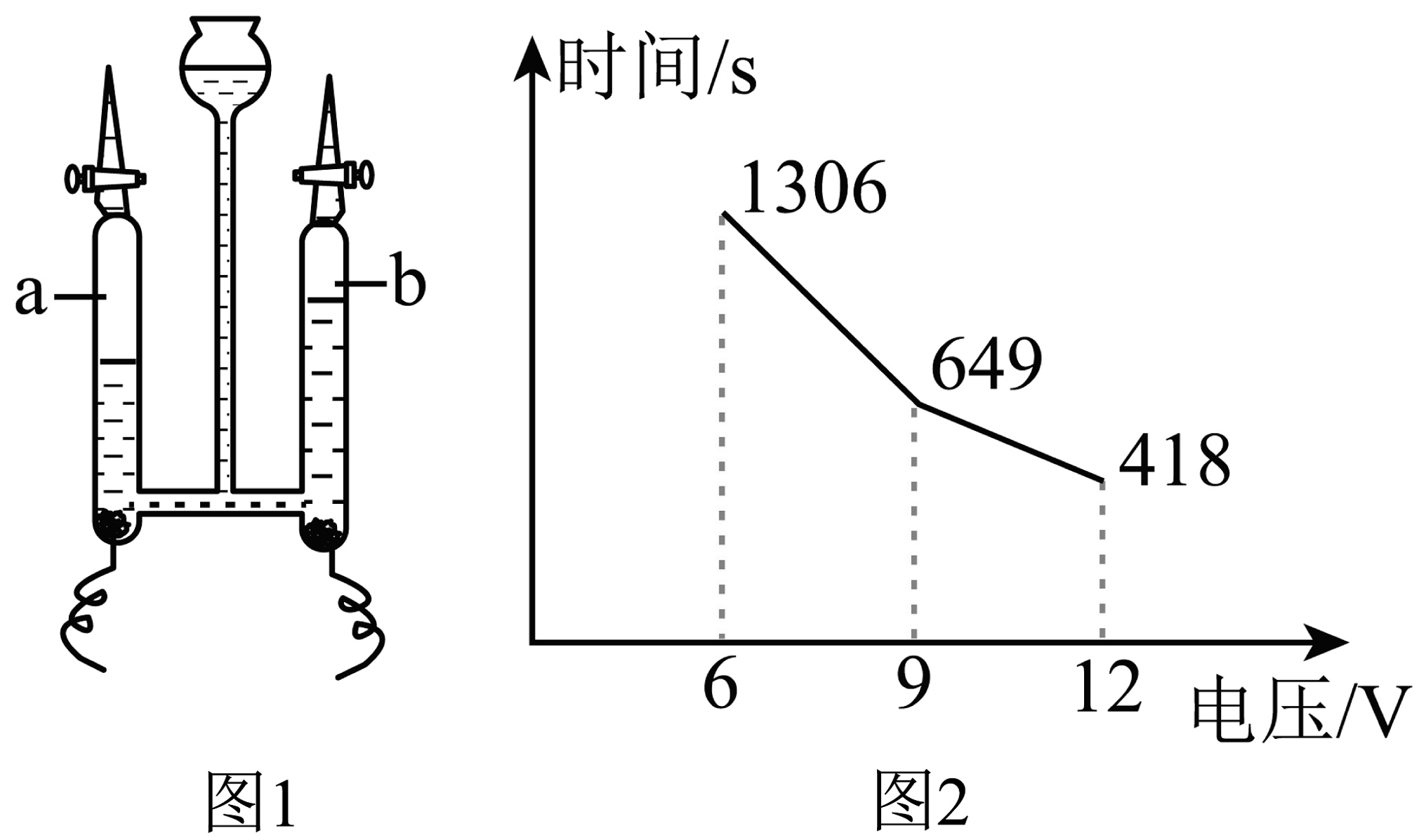
某同学为探究不同电压对电解水速率的影响,用如图1装置进行多次实验,并记录不同电压下生成20mL氢气所需时间如图2所示。
①图1中a管与电源(填“正极”或“负极”)相连。
写出水电解反应的文字表达式: , 该实验说明水是由、组成的。
②由图2分析,可得出的实验结论是。
③若用“
 ”来表示水分子 , 则气体b应该为(填字母)。
”来表示水分子 , 则气体b应该为(填字母)。A.
 B.
B. C.
C.
-
4、下图是实验室制取氧气常见装置及其性质实验,请回答下列问题:
 (1)、仪器①的名称是。(2)、实验室用高锰酸钾制取氧气时,选择的发生装置是(填字母序号),发生反应的文字表达式为。
(1)、仪器①的名称是。(2)、实验室用高锰酸钾制取氧气时,选择的发生装置是(填字母序号),发生反应的文字表达式为。检查该装置气密性的方法是先连接好仪器,打开弹簧夹,将导管放入水中,接下来的操作是 , 若观察到水中导管口有气泡冒出,说明气密性好。
(3)、用装置C收集氧气时,当观察到时,表示氧气已收集满。收集完毕的操作顺序是(填写序号)。①盖上玻璃片 ②正放在实验台上 ③取出集气瓶
(4)、欲收集一瓶干燥的氧气,应选择的收集装置是(填字母序号)。(5)、写出F实验中发生反应的文字表达式。铁丝绕成螺旋状的目的是。F装置中可能存在安全隐患,应如何改进?。 -
5、阅读下面的科普短文,然后回答相关问题:
酿造酱油是将大豆中的蛋白质经发酵分解成有鲜味的氨基酸而制成的调味品,生抽和老抽均属于酿造酱油。生抽颜色浅,味道鲜咸,可替代食盐使用,适合凉拌和炒菜。老抽颜色深,味道鲜美微甜,适合给卤味腊味菜肴上色。
酱油中氨基酸含量越高,酱油品质越好。为探究温度、放置时间及氧气量对酱油品质的影响,实验小组取等量同种酱油,分别装入多个500mL的透明玻璃瓶和透明保鲜瓶(保鲜瓶密封性更好,空气不易进入),密封后置于不同温度的恒温箱中进行实验,检测L*值,L*值越大,酱油品质越好。
实验1
实验2
实验操作
每隔15天,从不同恒温箱中取未开封的玻璃瓶中的酱油,检测L*值
将28℃恒温箱中的两瓶酱油,每隔15天各倒出10mL酱油,检测L*值
检测结果
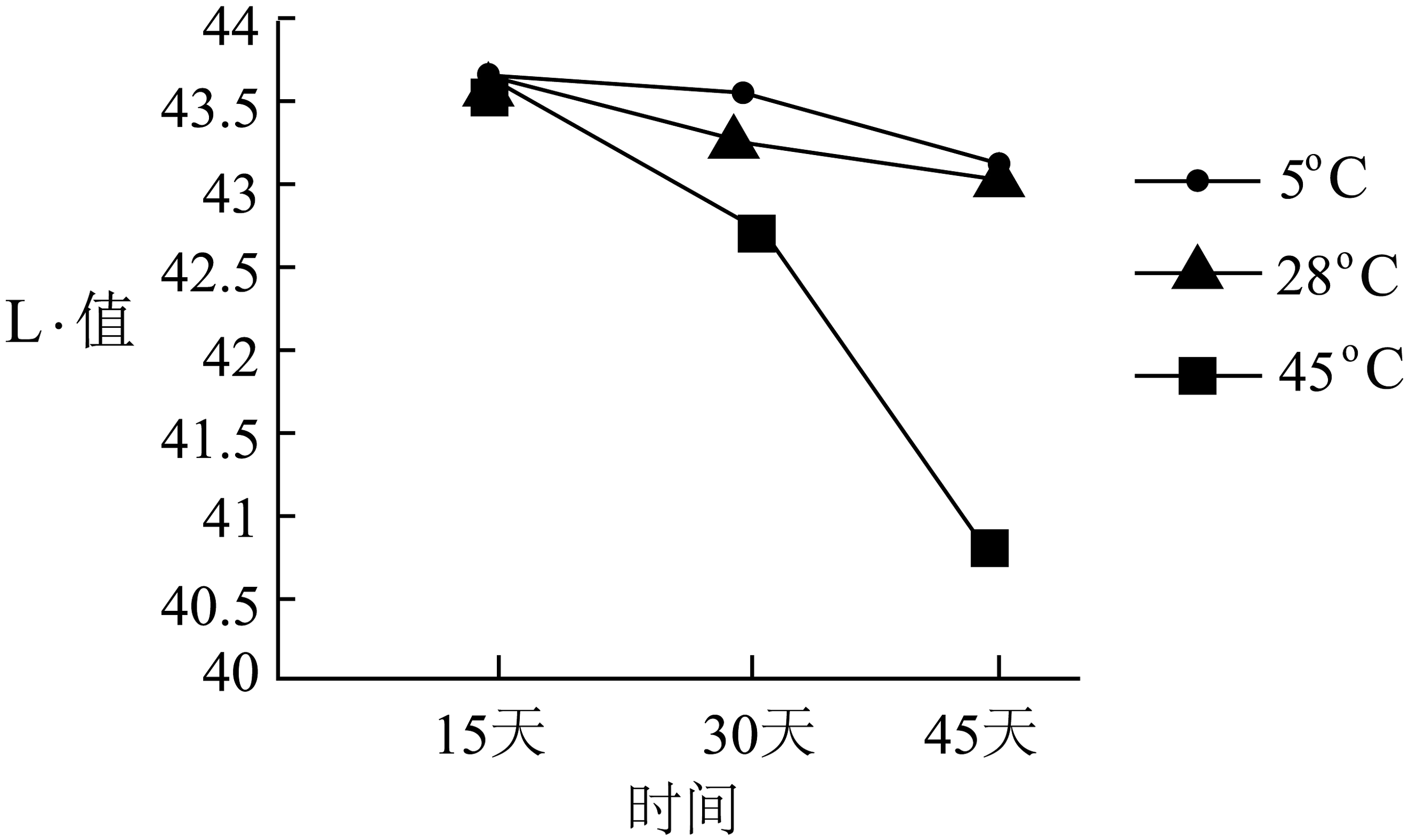

高温会破坏酱油中的氨基酸,使酱油中的糖分焦化变酸。夏天,酱油容易长出一层白膜,这是由于产膜性酵母菌污染后引起酱油发霉的现象,食用后对人体有害。
(1)、你认为区分生抽和老抽可以用的方法是 , 就这一过程而言,属于科学探究环节中的。A.猜想与假设 B.设计实验 C.收集证据 D.解释与结论
(2)、实验1的实验目的是。(3)、分析实验2的检测结果,得出的结论是。(4)、“补铁酱油”中所含的“铁”是指(填“元素”或“单质”)。(5)、根据上述材料,你认为酱油的保存方式为:。 -
6、
建构合理的思维模型,既能促进深度学习,又能提高思维品质。小明建构了“两组份混合物含量测定”的思维模型:

运用该模型对“测定空气中氧气含量”进行实验探究:忽略含量很低的其它物质,空气可以看成由氮气和氧气组成的两组份混合物。
【原理分析】
(1)利用某种化学物质将氧气反应掉以测定空气中氧气的含量属于思维模型中的(填“分离转移”或“反应转化”)。
【操作与观察】

(2)按图甲装置测定空气中氧气含量,写出该反应的文字表达式: , 止水夹最佳打开时间是(填“反应刚结束”或“冷却到室温”)时,打开止水夹,水能倒吸入集气瓶的原因是。
【实验反思】
(3)图乙装置和图甲装置对比,其优点是(写一条)。
运用上述思维模型,小明又设计了图丙的实验装置,试猜想铜粉可代替红磷的主要原因(写两条)。
-
7、化学与社会生活联系紧密。(1)、生产食品时通常在其包装袋中充入氮气,目的是。(2)、便携式制氧器如图所示,甲剂溶于水生成过氧化氢,乙剂为二氧化锰。写出过氧化氢在乙剂催化下生成氧气的反应的文字表达式: , 该反应的基本反应类型属于 , 加湿过滤仓出来的氧气属于(填“纯净物”或“混合物”)。
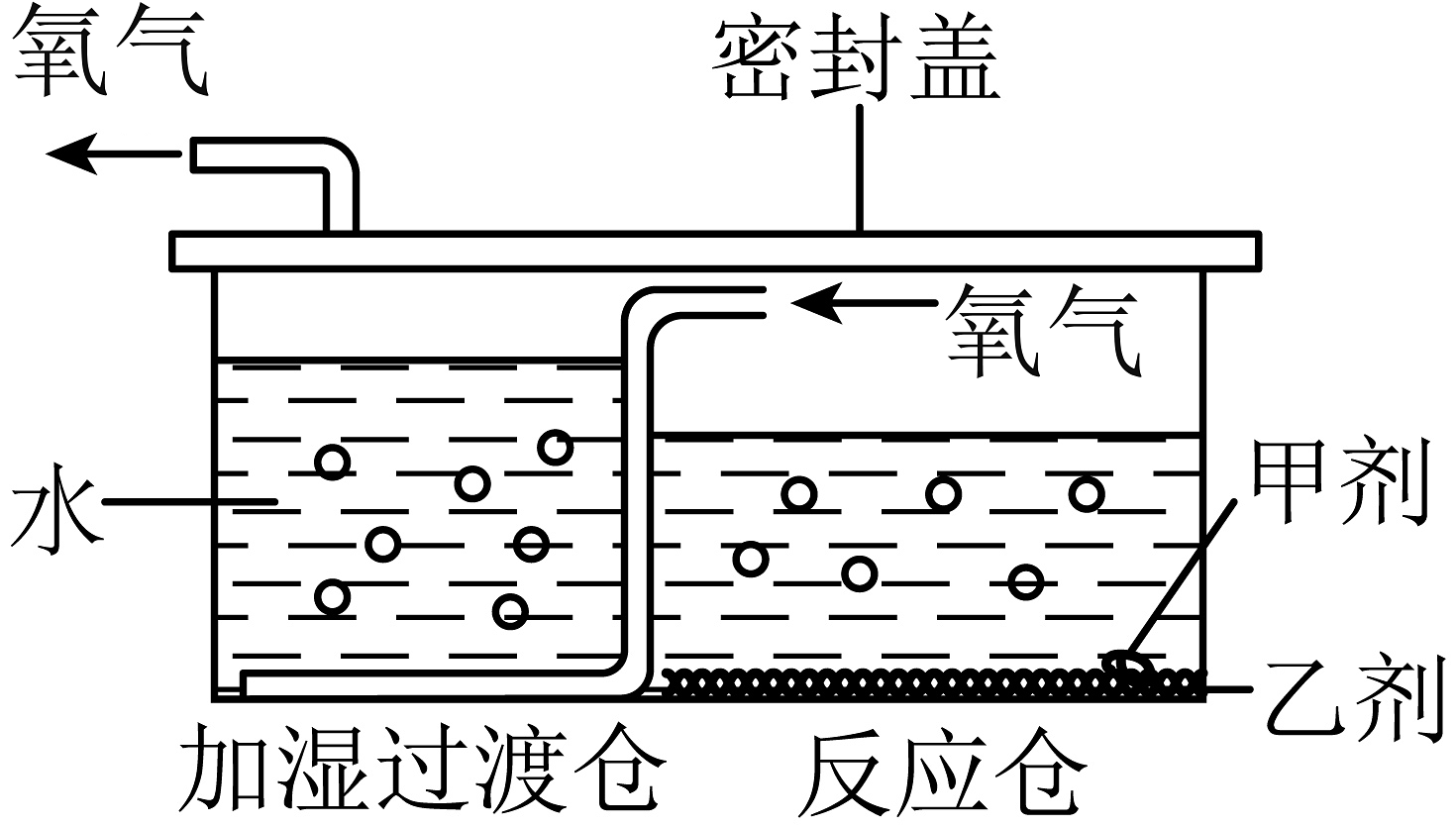 (3)、救生舱在事故救援中起到了关键作用。救生舱中必须储备充足的氧气。若一个成年人每分钟大约要吸8L氧气,已知空气中氧气的体积分数为21%,则每分钟大约需要吸入的空气体积为L(计算结果取整数)。(4)、如图是工业上利用分离液态空气的方法得到氧气的流程示意图FF1A
(3)、救生舱在事故救援中起到了关键作用。救生舱中必须储备充足的氧气。若一个成年人每分钟大约要吸8L氧气,已知空气中氧气的体积分数为21%,则每分钟大约需要吸入的空气体积为L(计算结果取整数)。(4)、如图是工业上利用分离液态空气的方法得到氧气的流程示意图FF1A分离液态空气法的原理是利用氮气和氧气的不同而将氮气和氧气分离。当打开一个装有液态空气的容器盖,并将一根燃着的木条置于容器口上方,观察到的现象是。
-
8、在宏观、微观和符号之间建立联系是学习化学的重要思维方式。(1)、写出下列元素名称或符号:磷;氯;氦;C;Si;Ca。(2)、写出下列符号表示的意义:2O表示;。(3)、原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,科学家都运用了来表达他们的理论成果。如图是两个微粒的结构模型示意图,这两个微粒(填“属于”或“不属于”)同种元素,你的依据是。
 (4)、物质的组成及构成关系如图所示,图中①、②分别可填写的是、。
(4)、物质的组成及构成关系如图所示,图中①、②分别可填写的是、。
-
9、“大象牙膏”是将过氧化氢溶液、催化剂二氧化锰和发泡剂加入容器中,过氧化氢迅速分解,涌出像喷泉一样的柱状泡沫。下列说法正确的是
 A、没有催化剂过氧化氢也会分解 B、反应前后催化剂的质量和性质不变 C、产生的泡沫可用于灭火 D、二氧化锰只能催化过氧化氢分解
A、没有催化剂过氧化氢也会分解 B、反应前后催化剂的质量和性质不变 C、产生的泡沫可用于灭火 D、二氧化锰只能催化过氧化氢分解 -
10、“水循环”是自然界中的重要循环,下列认识中错误的是
 A、水的天然循环实现了水资源的重新分配 B、水在天然循环过程中实现了自身净化 C、水的天然循环是水分子运动的结果 D、地面雨水蒸发变为水蒸气时,水分子变大
A、水的天然循环实现了水资源的重新分配 B、水在天然循环过程中实现了自身净化 C、水的天然循环是水分子运动的结果 D、地面雨水蒸发变为水蒸气时,水分子变大 -
11、木炭在氧气中完全燃烧生成二氧化碳,下列有关叙述中错误的是A、该反应属于化合反应 B、反应前后原子种类不变 C、二氧化碳与氧气的化学性质不同 D、二氧化碳是空气主要污染物之一
-
12、下列化学实验操作正确的是A、
 氧气验满
B、
氧气验满
B、 读取液体体积
C、
读取液体体积
C、 过滤
D、
过滤
D、 熄灭酒精灯
熄灭酒精灯
-
13、陆地探测四号01星的天线用极细钼单丝进行编织。如图为钼的原子结构示意图,下列有关说法正确的是
 A、x为12 B、钼属于非金属元素 C、化学反应中易失电子 D、钼的相对原子质量为42
A、x为12 B、钼属于非金属元素 C、化学反应中易失电子 D、钼的相对原子质量为42 -
14、酒精是常用的消毒剂。以下对酒精性质的描述与其他三个不同的是A、无色透明 B、能与水互溶 C、易挥发 D、易燃烧
-
15、某火力发电厂为防止燃煤烟气中的二氧化硫污染环境,使用石灰石进行烟气脱硫,产生的硫酸钙可用于生产建筑材料。这个过程中会发生化学反应:(1)、中的化学式为。(2)、某火力发电厂每月燃煤产生二氧化硫,如果通过以上反应进行吸收,每月至少需要碳酸钙的质量是多少?
-
16、经研究发现,在人们喜爱的腌制食品中含有致癌物质N-二甲基亚硝铵【化学式为】,试回答:(1)、每个N-二甲基亚硝铵分子共有个原子;(2)、N-二甲基亚硝铵分子的相对分子质量;(3)、N-二甲基亚硝铵中、、、元素的质量比为。
-
17、从不同的角度研究物质是化学中常用的研究思路。请回答下列问题。(1)、人们对水的组成的认识经历了相当长的时间。
①18世纪末,英国化学家普里斯特利( , 1733-1804)把“易燃空气”和空气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内壁出现了液滴。“易燃空气”实际上是。
②在拉瓦锡的实验中,水蒸气通过一根烧红的铁制枪管,枪管内壁有黑色固体(四氧化三铁)生成,同时得到了“易燃空气”。这一化学反应的化学方程式为:。
(2)、在电解水的实验中,与电源正极相连玻璃管内的气体是与电源负极相连玻璃管内的气体是 , 其化学方程式是 , 该化学反应为(填“化合反应”或“分解反应”)。 -
18、在天然气净化和石油炼制过程中回收硫,不仅能减少空气污染,还能为工业制硫酸提供原料。制硫酸时,硫与氧气反应生成二氧化硫,该反应的化学方程式是。这个式子不仅表明反应物是 , 生成物是 , 反应条件是 , 而且表示参与反应的各物质之间的质量比例关系,即在点燃条件下,每份质量的硫与份质量的氧气恰好完全反应,生成份质量的二氧化硫。
-
19、氯化钙的化学式是;中K和O的化合价分别为+1价、-2价,则Mn的化合价为;地壳中含量最高的非金属元素与地壳中含量最高的金属元素组成的化合物的化学式是。
-
20、逐梦航天,建设航天强国,中国九天云外揽月回。月球上有一种富含钛元素的月海玄武岩,如图是钛元素在元素周期表中的信息及部分原子结构示意图。
 (1)、钛元素位于元素周期表中第周期,图2中的X的值为。(2)、A、B、C、D四种粒子中,共属于种元素,具有相对稳定结构的原子是(填字母编号)。(3)、由B、D两种元素形成化合物的化学式。
(1)、钛元素位于元素周期表中第周期,图2中的X的值为。(2)、A、B、C、D四种粒子中,共属于种元素,具有相对稳定结构的原子是(填字母编号)。(3)、由B、D两种元素形成化合物的化学式。