-
1、下列方案设计、现象和结论不正确的是( )
实验目的
实验方案
现象
结论
A
验证(黄色)在高浓度Cl-的条件下稳定
向稀盐酸和FeCl3的混合溶液中,加入NaCl固体
NaCl固体溶解,溶液变为亮黄色
在高浓度Cl-的条件下稳定
B
比较AgI与Ag2S的Ksp
向2 mL0.1 mol/L KI溶液滴加2滴0.1 mol/L硝酸银,然后再滴加2滴0.1 mol/L的K2S溶液
先产生淡黄色沉淀,后转化为黑色沉淀
Ksp (AgI)>Ksp (Ag2S)
C
检验乙酰水杨酸中存在酯基
乙酰水杨酸中滴入稀硫酸,加热,冷却后滴加FeCl3溶液
溶液呈紫色
存在酯基
D
比较Mg与Al的金属性
分别向MgCl2>AlCl3溶液中滴加足量的NaOH溶液
前者产生白色沉淀;后者先产生白色沉淀,沉淀后消失
Mg>Al
A、A B、B C、C D、D -
2、下图是利用铜与浓硫酸反应的产物制备的工艺流程,(已知:常温下,: , ;: , )下列说法正确的是( )
 A、反应Ⅰ的反应为: B、溶液2中 C、反应Ⅱ应需及时补充维持溶液 D、溶液中存在 , 则该溶液中粒子浓度:
A、反应Ⅰ的反应为: B、溶液2中 C、反应Ⅱ应需及时补充维持溶液 D、溶液中存在 , 则该溶液中粒子浓度: -
3、烃基的结构对卤代烃的活性有很大的影响(乙烯型卤代烃很难发生取代反应,而烯丙型卤代烃却很容易发生取代反应)。已知卤代烃能和的醇溶液发生如下反应:(R-为烃基,X-为卤素)。下列说法不正确的是( )A、是一种无机酸酯 B、相比产生沉淀的速度更慢 C、相比更易发生上述反应 D、与加成反应的主要产物是
-
4、锌-空气电池可用作电动车的动力电源。该电池的电解质溶液为KOH溶液,总反应为:。下列有关说法不正确的是( )A、充电时,锌连接电源负极 B、充电时,阳极反应为 C、放电时,电解质溶液中向正极移动 D、放电时,电路中通过电子,可消耗
-
5、已知是原子序数依次增大的前四周期元素。的核外电子总数与其周期数相同,与相邻且的原子序数是的两倍,基态的轨道全部充满。下列说法正确的是( )A、简单氢化物的沸点: B、第一电离能: C、A、B、C三种元素只形成共价化合物 D、B的简单氢化物的水溶液能溶解E的最高价氧化物对应的水化物
-
6、聚乳酸是一种可生物降解的高分子材料,主要用于制造可降解纤维、可降解塑料和医用材料。聚乳酸可用如下路线合成,其中A的产量可衡量一个国家的石油化工发展水平。
下列说法正确的是( )
A、B中碳原子的杂化方式相同 B、反应④的条件为的醇溶液 C、E存在对映异构,易溶于水 D、所有反应均为取代反应 -
7、下列化学反应与方程式相符的是( )A、工业制粗硅: B、铅蓄电池充电时阳极反应: C、氯水中加入小苏打提高漂白性: D、用盐酸处理铜器表面的铜锈:
-
8、下列说法正确的是( )A、根据纤维在火焰上燃烧产生的气味,可鉴别蚕丝与棉花 B、通过石油的常压分馏可获得石蜡等馏分,常压分馏过程是物理变化 C、乙酸、苯甲酸、乙二酸(草酸)均不能使酸性高锰酸钾溶液褪色 D、亚硝酸钠具有一定毒性,还会与食物作用生成致癌物,因此不可做食品添加剂
-
9、下列有关实验设计、操作说法正确的是( )
 A、甲图可用于测定与稀硫酸的反应速率 B、乙图在溶液中加入一些氨水,制成铜氨溶液,可使镀层光亮 C、丙图是转移操作 D、丁图配成同浓度的溶液,有利于比较乙醇和苯酚中羟基的活性
A、甲图可用于测定与稀硫酸的反应速率 B、乙图在溶液中加入一些氨水,制成铜氨溶液,可使镀层光亮 C、丙图是转移操作 D、丁图配成同浓度的溶液,有利于比较乙醇和苯酚中羟基的活性 -
10、根据物质的组成和结构的变化可推测其性能变化及用途,下列推测不合理的是( )
材料
组成和结构变化
性能变化及用途
A
铝
加入等
密度大、强度小
B
奶粉
加入碳酸钙、硫酸锌等
儿童营养强化
C
聚乙炔塑料
掺杂
增强导电性
D
取代部分取代部分
制作LED发光材料
A、A B、B C、C D、D -
11、苯酚是一种重要的化工原料,其废水对生物具有毒害作用,在排放前必须经过处理。为回收利用含苯酚的废水,某小组设计如下方案,有关说法正确的是( )
 A、步骤①中,分液时从分液漏斗下口先放出废水,再放出有机溶液 B、试剂①可用溶液或溶液 C、步骤①②的操作为分液,步骤③的操作为过滤 D、试剂②若为少量 , 则反应为2
A、步骤①中,分液时从分液漏斗下口先放出废水,再放出有机溶液 B、试剂①可用溶液或溶液 C、步骤①②的操作为分液,步骤③的操作为过滤 D、试剂②若为少量 , 则反应为2 +CO2+H2O=2
+CO2+H2O=2 +
+
-
12、下列各组离子在给定溶液中一定能大量共存的是( )A、中性溶液中: B、与铝粉反应放出: C、使甲基橙呈红色的溶液: D、常温下,的溶液中:
-
13、为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。后者常采用作还原剂,其反应之一为: , 下列说法不正确的是(为阿伏加德罗常数)( )A、氧化产物与还原产物的质量比为3∶4 B、生成水转移电子的数目为 C、可使用溶液吸收氮氧化物 D、氮氧化物的排放可形成酸雨
-
14、绿矾具有广泛的用途,下列说法正确的是( )A、医疗上常用于治疗缺铁性贫血 B、工业常用作污水的处理剂,只是利用其还原性 C、高温分解只产生和 D、可用溶液检验其是否变质
-
15、下列化学用语表示正确的是( )A、NH4I的电子式:
 B、船式C6H12:
B、船式C6H12: C、光导纤维主要成分的分子式:SiO2
D、
C、光导纤维主要成分的分子式:SiO2
D、 的名称:2-甲基-3-戊稀
的名称:2-甲基-3-戊稀
-
16、下列物质为含有极性键的非极性分子的是( )A、 B、 C、 D、
-
17、黄酮哌酯是一种解痉药,可通过如图路线合成:

回答问题:
(1)、A→B的反应类型为。(2)、已知B为一元强酸,室温下B与NaOH溶液反应的化学方程式为。(3)、D的结构简式为。(4)、E和F可用(写出试剂)鉴别。(5)、X是F的同分异构体,符合下列条件的X的结构简式为(任写一种)。①含有酯基;②含有苯环;③核磁共振氢谐有两组峰
(6)、已知酸酐能与羟基化合物反应生成酯。写出下列F→G反应方程式中M和N的结构简式、。 (7)、设计以
(7)、设计以 为原料合成
为原料合成 的路线(其他试剂任选)。
的路线(其他试剂任选)。已知:

 +CO2
+CO2 -
18、某合金基体是铁碳合金,还含有一定量的Cr、Ni、Cu、C等元素。回答下列问题:(1)、基态碳原子核外电子所处的最高能层符号为 , 基态的外围电子排布图为。(2)、六羰基铬[Cr(CO)6]中σ键和π键的个数比为 , 与CO互为等电子体的是。
A. B. C. D. E.HCl
(3)、完成下列含碳化合物相关分析:
①A分子中采取sp2杂化的碳原子有个。
②B的沸点低于对羟基苯甲醛(
 )的沸点,其原因是。(4)、是离子晶体,其晶格能可通过Born-Haber循环计算得到。
)的沸点,其原因是。(4)、是离子晶体,其晶格能可通过Born-Haber循环计算得到。
通过图中数据(填“能”或“不能”)计算出Cu原子的第一电离能,的晶格能为kJ∙mol-1。
(5)、的晶胞结构如图所示,A的原子坐标参数为(0,0,0),B为(则C的原子坐标为;已知该晶体的密度为和的半径分别为和 , NA代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为(用代数式表示)。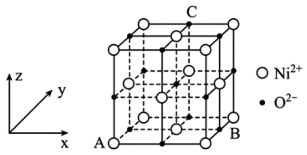
-
19、二氧化碳催化加氢制甲醇,能助力“碳达峰”,涉及反应有:
反应①
反应②
反应③
(1)、反应②自发进行的条件是(填“高温”、“低温”或“任意温度”),反应③。(2)、反应③在热力学上趋势大于反应①,其原因是。(3)、反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低eV(eV为能量单位)。 (4)、在下,和按物质的量之比为进行投料,只发生反应①和反应③,平衡时CO和在含碳产物中的物质的量分数及转化率随温度的变化如图所示。
(4)、在下,和按物质的量之比为进行投料,只发生反应①和反应③,平衡时CO和在含碳产物中的物质的量分数及转化率随温度的变化如图所示。
①图中a代表的物质是。
②q曲线在250℃之后随温度升高而增大的原因是。
③250℃时,反应①的平衡常数(为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)、向一定浓度的溶液通入至饱和,在电极上反应生成 , 电解原理如图所示(阴、阳极区溶液均为溶液)。电解过程中生成尿素的电极反应式为。
-
20、亚硫酰氯(SOCl2)是一种重要化工试剂,被广泛应用于结晶水合物的脱水和有机合成,三氯氧磷(POCl3)常作为半导体掺杂剂及光导纤维原料。工业上合成POCl3和SOCl2的方法之一是:PCl5(s)+SO2(g)=POCl3(l)+SOCl2(l) △H=-101.4kJ/mol。已知相关物质的熔沸点及水解性如表:
物质
熔点
沸点
水解性
POCl3
1.2
105.5
易水解
SOCl2
-104.5
76
易水解
PCl5
160(升华)
167
易水解
某小组在实验室模拟工业制亚硫酰氯设计如图实验。

试回答下列问题:
(1)、A装置中发生反应的化学方程式为。(2)、B装置中盛装的a试剂为;C装置中X仪器的名称是。(3)、①反应过程中C装置的烧瓶要放在冰水浴中,原因是。②判断PCl5已与SO2完全反应的实验现象是。
(4)、反应结束后,应进行(填操作名称),从双颈烧瓶中的液体得到较纯净的POCl3和SOCl2。(5)、测定某掺杂剂中POCl3的含量(杂质不参与反应);准确称取4.000g样品在水解瓶中据动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.400mol/L的AgNO3溶液25.0mL,再加少许硝基苯防止AgCl参与后续反应,用力振荡。加入少量NH4Fe(SO4)2 , 用0.1000mol/LKSCN标准溶液滴定,消耗KSCN标准溶液22.00mL。[已知:Ag3PO4可溶于硝酸,Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2.0×10-12 , POCl3的相对分子质量为153.5]①说明滴定到达终点的实验现象为。
②产品中POCl3的质量分数为(保留一位小数)