-
1、银杏素有“活化石”“植物界的大照猫"之称,在我国云贵川等地分布广泛。银杏除有极高的观贫价值外,其提取物中的双贺酮类化合物在抗氧化、抗炎。抗菌、抗病毒。抗肿衔等方面发挥着重婴的药理作用,下图为某2'。2"一BB型双黄酮类化合钧的分子结构。下列有关该化合物的说法错误的是( )
 A、分子中有三种不同环境的氧原子 B、分子中所有原子都共平面 C、能发生氧化、加成。取代反应 D、苯环上的一氯取代物有7种
A、分子中有三种不同环境的氧原子 B、分子中所有原子都共平面 C、能发生氧化、加成。取代反应 D、苯环上的一氯取代物有7种 -
2、2023年9~10月,第19届亚运会在杭州举办,我国健儿取得了优异成绩,“绿色”“科技”是本届亚运会的关键词。以下说法错误的是( )A、亚运会餐具大量采用了PLA(聚乳酸)、稻壳、纸基等材质,它们都是可降解环保材料 B、主火炬燃料甲醇是以CO2为原料合成再生的,该合成法是实现“碳中和”的重要途径 C、采用全断绿色效字印染技水制边的奖牌姣带十年如新,其主要成分桑蚕丝为合成纤维 D、棒(垒)球主馆膜顶采用了蜍合性能更好的PTFE(聚四氟乙烯),PTFE不能使溴水褪色
-
3、吲哚布芬为抗血栓形成药,用于治疗动脉硬化引起的缺血性心血管、脑血管病变。其合成路线如图所示。

已知:R-XR-CNR-COOH+NH
回答下列问题:
(1)、反应②的反应条件及试剂为。(2)、J中含有官能团的名称为。(3)、反应⑤的化学方程式为。(4)、反应⑦中Na2S2O4的作用是。(5)、已知M的核磁共振氢谱有两组峰,N的结构简式为。(6)、符合下列条件的J的同分异构体共有种(不考虑立体异构)。①含有苯环,且苯环上有三个取代基
②与J含有相同官能团,官能团直接与苯环相连
(7)、仿照上述合成路线设计由丙醇(CH3CH2CH2OH)合成2-甲基丙酸( )的合成路线(其他试剂任选)。
)的合成路线(其他试剂任选)。 -
4、钴(Co)和铜(Cu)是生命体必需的微量元素,且在材料、医药等领域具有广泛应用。回答下列问题:(1)、Cu-Ni-Co-Si合金具有较高的导电、导热性和良好的加工、耐蚀性,是很有发展潜力的材料。
①基态Cu原子的最外层电子轨道表示式为。
②电解熔融的CoCl2或CoO都能制备金属钴。CoCl2的熔点(735℃)低于CoO的熔点(1935℃)的原因是。
(2)、含金属钴和一氧化碳配体的羧基钴配合物具有抗肿瘤和抗炎的潜力。一种羰基钴配合物的合成路线如下:
①化合物I中各元素的电负性由大到小的顺序为。固体I中存在的作用力除共价键外,还有。1mol I中含有的σ键数目为。
②化合物Ⅱ分子中原子的杂化方式有。
③配合物Ⅲ中,配体一氧化碳的配位原子为 , 写出一个与CO互为等电子体的阴离子。
(3)、Cu-Mn-Al合金的晶胞如a图所示,该晶胞可视为Mn,Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。
①该合金的化学式为。
②已知原子半径: , r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为pm。
-
5、煤的气化和天然气净化过程中会产生H2S,将其吸收与转化是环境保护和资源利用的有效措施。回答下列问题:(1)、利用足量纯碱溶液可吸收低浓度H2S,生成的含硫物质主要是(填化学式。H2S的 , ;H2CO3的 , )。(2)、电解氧化法处理H2S的原理是:在氧化反应器中,利用Fe3+氧化H2S;在电解反应器中实现Fe3+的再生,并副产氢气,总反应为 , 相关物质的燃烧热数据如下表:则H=kJmol-1。
物质
H2S(g)
S(s)
H2(g)
燃烧热H/(kJmol-1)
-562.0
-296.8
-285.8
(3)、工业上采用高温热分解H2S的方法制取H2 , 在膜反应器中分离出H2.在恒容密闭容器中,以H2S的起始浓度均为0.009mol/L控制不同温度进行H2S分解: , 实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
①该反应为(填“吸热”或“放热”)反应,985℃时该反应在tmin时达到平衡,则从开始到平衡的平均反应速率为。
②随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是。
③若在一容积可变容器中充入1molH2S进行上述反应,平衡转化率为20%,维持温度和压强不变,欲将H2S的平衡转化率提升至50%,需向反应器中充入molAr作为稀释气。
(4)、工业上采用C6H5Cl和H2S的高温气相反应制备有机合成中间体苯硫酚(C6H5SH),同时有副产物C6H6生成:I.
Ⅱ.
使氯苯和硫化氢按一定的比例进入反应器,定时测定由反应器尾端出来的混合气中各产物的量,得到单程收率(原料一次性通过反应器反应后得到的产品与原料总投入量的百分比)与温度的关系如图所示。

活化能较大的是反应(填“I”或“Ⅱ”)。根据图中曲线判断,下列说法正确的是(填标号)。
A.500℃~540℃反应1已经达到平衡
B.590℃以上,随温度升高,反应1平衡逆向移动
C.590℃以上,随温度升高,反应I消耗H2S减少
D.645℃,反应I、Ⅱ速率相等
-
6、CoCO3可用作选矿剂、催化剂及涂料的颜料。以含钴废渣(主要成分为CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:

已知:碱性条件下,Co2+会转变为Co(OH)2沉淀。
(1)、“酸浸”时需控制温度在40℃左右,原因是。(2)、“除铝”时发生反应的离子方程式为。(3)、上述“萃取”过程可表示为。①下列说法不正确的是。
A.可将废渣粉碎以提高酸浸效率
B.“除铝”时,应加入过量的Na2CO3溶液
C.可选择CCl4作为萃取剂
D.往萃取后的有机层中加水可获得ZnSO4溶液
②若萃取操作是在实验室完成,请选择合适的编号,按正确的操作顺序(有的操作可重复使用),完成萃取实验(假设只放气一次)。
倒入溶液和萃取剂→→→→→f→→→使下层液体慢慢流出→c→上层液体从上口倒出
a.打开分液漏斗上口玻璃塞;b.塞上分液漏斗上口玻璃塞;c.关闭分液漏斗旋塞;
d打开分液漏斗旋塞;e.倒转分液漏斗振摇;
f.将分液漏斗放在铁圈上静置;g.手持分液漏斗静置。
(4)、“沉钴”时,溶液滴加过快会导致产品不纯,请解释可能原因。(5)、该工艺的副产物ZnS可参与H2S与CO2生成COS的反应,反应前后ZnS的质量不变,该过程中涉及到的化学反应有。(6)、在空气中煅烧CoCO3生成钴氧化物和CO2 , 测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为。 -
7、一水硫酸四氨合铜[Cu(NH3)4SO4·H2O]是一种易溶于水,难溶于乙醇的绛蓝色晶体,可作高效安全的广谱杀菌剂。成外某兴趣小组查阅资料后设计实验方案制备出该晶体并对制备出的晶体进行成分检验和性质探究。
I.制备少量Cu(NH3)4SO4·H2O晶体:
 (1)、步骤I中,下列仪器一定需要的有(填仪器名称)。
(1)、步骤I中,下列仪器一定需要的有(填仪器名称)。 (2)、对比铜和浓硫酸加热制备硫酸铜,该方案的优点是。(3)、步骤Ⅲ的离子方程式为。(4)、有同学查阅资料得知:(NH4)2SO4也难溶于乙醇。故对于制备出的晶体的成分,该同学提出如下假设:
(2)、对比铜和浓硫酸加热制备硫酸铜,该方案的优点是。(3)、步骤Ⅲ的离子方程式为。(4)、有同学查阅资料得知:(NH4)2SO4也难溶于乙醇。故对于制备出的晶体的成分,该同学提出如下假设:假设一:只有(NH4)2SO4
假设二:只有Cu(NH3)4SO4·H2O
假设三:(NH4)2SO4和Cu(NH3)4SO4·H2O两种成分都有
已知产物晶体为蓝色,则无需实验即可排除。(填“假设一”、“假设二”、“假设三”)
(5)、Ⅱ.对制备出的晶体的成分进行检验和性质探究检验该晶体中阴离子的方法:。
(6)、用所得晶体加水得到深蓝色溶液。取三份1L试样,分别加入一定量的水、稀硫酸、热的浓氢氧化钠溶液,实验现象记录如下:加入试剂
水
稀硫酸
热的氢氧化钠溶液
现象
深蓝色稍变浅
溶液颜色变成浅蓝色且与同浓度硫酸铜颜色相当
溶液最终变为无色
结合化学用语,解释加入稀硫酸后出现的现象的原因。请补充完整加入热的浓氢氧化钠溶液后的现象:。
(7)、晶体中N含量的测定精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,并用蒸馏水冲洗导管内壁,用V1mLc1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用c2mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL溶液。

通入水蒸气的目的是 , 样品中N的质量分数的表达式为 , 最终通过N的质量分数确定了样品的成分。
-
8、常温下,向A(NO3)2、B(NO3)2和HR的混合液中滴加NaOH溶液,pM与pH的关系如图所示。

已知pM=-1gc(M),c(M代表c(A2+)、c(B2+)或;Ksp[A(OH)2]>Ksp[B(OH)2];当被沉淀的离子的物质的量浓度小于时,认为该离子已沉淀完全,则忽略不计。
下列叙述正确的是( )
A、X、Z分别代表-1gc (A2+)、-1g与pH的关系 B、的平衡常数 C、当溶液的pH=7时,溶液中存在 D、图中a点对应溶液的pH为6.5,此时溶液中c(R-)<c(HR) -
9、一种可充电锂硫电池装置示意图如图。电池放电时,S8与Li+在硫碳复合电极处生成Li2Sx(x=1、2、4、6或8)。已知Li+、S2-和S能通过离子筛,S、S和S不能通过离子筛。下列说法不正确的是( )
 A、S、S和S不能通过离子筛的原因是它们的离子直径较大 B、S8中加入碳得到硫碳复合电极有利于提高电极的导电性 C、充电时,当有0.1 molLi2S转化成S8时,锂电极质量增加0.7g D、放电时,硫碳复合电极中S8转化为Li2S2的电极反应式为
A、S、S和S不能通过离子筛的原因是它们的离子直径较大 B、S8中加入碳得到硫碳复合电极有利于提高电极的导电性 C、充电时,当有0.1 molLi2S转化成S8时,锂电极质量增加0.7g D、放电时,硫碳复合电极中S8转化为Li2S2的电极反应式为 -
10、下列装置或操作能达到实验目的的是( )
 A、甲:除去Fe(OH)3胶体中的NaCl溶液 B、乙:利用牺牲阳极的阴极保护法来保护钢铁输水管 C、丙:测定KI溶液的浓度 D、丁:可通过关闭a,打开b,观察水是否能顺利滴下来判断装置的气密性
A、甲:除去Fe(OH)3胶体中的NaCl溶液 B、乙:利用牺牲阳极的阴极保护法来保护钢铁输水管 C、丙:测定KI溶液的浓度 D、丁:可通过关闭a,打开b,观察水是否能顺利滴下来判断装置的气密性 -
11、短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述不正确的是( )
 A、X2YW3可用于制备木材防火剂 B、离子半径关系:r(Z)>r(W)>r(X) C、W的简单氢化物稳定性比Y的简单氢化物稳定性高 D、化合物M中W不都满足8电子稳定结构
A、X2YW3可用于制备木材防火剂 B、离子半径关系:r(Z)>r(W)>r(X) C、W的简单氢化物稳定性比Y的简单氢化物稳定性高 D、化合物M中W不都满足8电子稳定结构 -
12、布洛芬具有抗炎、镇痛、解热作用。口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的修饰,以降低毒副作用。下列说法错误的是( )
 A、该修饰过程为取代反应 B、水溶性:X小于布洛芬 C、布洛芬和X的苯环上的一氯代物都有2种 D、布洛芬分子中所有碳原子可能在同一个平面
A、该修饰过程为取代反应 B、水溶性:X小于布洛芬 C、布洛芬和X的苯环上的一氯代物都有2种 D、布洛芬分子中所有碳原子可能在同一个平面 -
13、设NA为阿伏加德罗常数的值,下列说法正确的是( )A、体积为1L,浓度均为1mol·L-1的KCl和KClO两种溶液中Cl-的数目之比为1:1 B、标准状况下,22g的CO2中含有的共用电子对数目为2NA C、密闭容器中,1molH2(g)和1molI2(g)充分反应后,转移电子数为2NA D、1LpH=2的草酸溶液中,H+的数目为0.02NA
-
14、2024年成都金沙太阳节在2月8日“龙”重登场,给游客留下了深刻的印象。下列有关叙述正确的是( )A、金沙遗址出土了大量精美的黄金面具,黄金面具的制作利用了金的延展性 B、金沙遗址出土了大量象牙,象牙的化学成分主要是羟基磷灰石,属于有机物 C、考古工作者常用12C确定文物年代 D、古蜀人使用玉器进行祭祀活动,玉器的主要成分是硅
-
15、靛蓝类色素广泛用于食品、医药和印染工业。靛蓝(化合物X)和多环化合物Y的一种合成路线如下所示(部分反应条件或试剂略去)。

已知:i.
 (1)、B的名称是。(2)、E→G的反应类型是 , G中所含官能团的名称是。(3)、符合下列条件的J的同分异构体有种;
(1)、B的名称是。(2)、E→G的反应类型是 , G中所含官能团的名称是。(3)、符合下列条件的J的同分异构体有种;a.苯环上含有两个取代基,其中一个是硝基 b.能发生银镜反应 c.可与氢氧化钠溶液发生化学反应
其中核磁共振氢谱显示4组峰,且峰面积比为6:2:2:1的有机物结构简式是。
(4)、G→J的化学反应方程式是。(5)、已知K中除苯环外还含有一个五元环,K的结构简式是。(6)、已知:ii. iii.
iii. 中C=N键性质类似于羰基,在一定条件下能发生类似i的反应。根据上述信息写出M与L在一定条件下转化为Y的路线图。
中C=N键性质类似于羰基,在一定条件下能发生类似i的反应。根据上述信息写出M与L在一定条件下转化为Y的路线图。 -
16、我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。回答下列问题:(1)、下列不同状态的硼中,失去一个电子需要吸收能量最多的是(填标号,下同),用光谱仪可捕捉到发射光谱的是。
A.
 B.
B.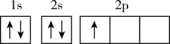 C.
C. D.
D. (2)、IMI的结构为
(2)、IMI的结构为 , IMI中大π键可表示为 , 分子中2号N原子的杂化方式为 , p轨道有孤电子对的N原子是。(填“1号N原子”或“2号N原子”) (3)、镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是。(4)、CeO2是重要的稀土抛光材料,图甲为理想的CeO2的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。
, IMI中大π键可表示为 , 分子中2号N原子的杂化方式为 , p轨道有孤电子对的N原子是。(填“1号N原子”或“2号N原子”) (3)、镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是。(4)、CeO2是重要的稀土抛光材料,图甲为理想的CeO2的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。
已知:CeO2缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为 , 则氧空位处原子的分数坐标为 , 该缺陷晶型的化学式可表示为。设阿伏加德罗常数的值为NA , CeO2理想晶型的密度为 , 则Ce原子与O原子的最近距离为pm(列出表达式)。
-
17、杭州亚运会主火炬燃料是“零碳甲醇”,这是一种利用焦炉气中的H2和工业废气捕获的CO2生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:(1)、①则K1=(用含K2和K3的代数式表示);
②实验测得K1(记作lnK)与温度(T)的关系如下图所示,则该反应0(填“>”“<”或“=”)。
 (2)、从焦炉气中提取氢气,需净化原料气,尤其要脱除其中的含硫杂质。除了从环保角度考虑外,其主要目的是;(3)、250℃,在甲(容积为4L)、乙(容积为2L)两刚性容器中分别充入2molCO2和6molH2 , 在适宜的催化剂作用下发生合成甲醇的反应,容器内总压强随时间变化如图所示:
(2)、从焦炉气中提取氢气,需净化原料气,尤其要脱除其中的含硫杂质。除了从环保角度考虑外,其主要目的是;(3)、250℃,在甲(容积为4L)、乙(容积为2L)两刚性容器中分别充入2molCO2和6molH2 , 在适宜的催化剂作用下发生合成甲醇的反应,容器内总压强随时间变化如图所示:
①其中B曲线对应容器中压强的变化情况(填“甲”或“乙”):
②利用图中数据计算250℃该反应的分压平衡常数Kp=(结果用分数表示)。
(4)、研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如下图所示:
在以上催化剂中,该反应选择的最佳催化剂为;
(5)、在研究该反应历程时发现:反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图所示(吸附在催化剂表面上的物种用*标注):
①写出有水参与时的化学方程式。
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因(任答两点)。
-
18、环己酮可作为涂料和油漆的溶剂。在实验室中以环己醇为原料制备环己酮。

已知:①环己醇、环己酮、醋酸的部分物理性质如下表:
物质
沸(熔)点/(℃,1atm)
密度/(g/cm3)
溶解性
环己醇
161.1(21)
0.96
能溶于水,易溶于常见有机溶剂
环己酮
155.6(47)
0.94
微溶于水
醋酸
118(16.6)
1.05
易溶于水
②两种互不相溶的液体,密度相差越大分层越易发生。
回答下列问题:
(1)、B装置的名称是。(2)、酸化NaClO时一般不选用盐酸,原因是(用离子方程式表示)。(3)、该制备反应很剧烈,且放出大量的热。为控制反应体系温度在30~35℃范围内,可采取的加热方式是。(4)、制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮、水和(填写化学式)的混合物。(5)、环己酮的提纯过程为:①在馏分中加NaCl固体至饱和,静置,分液;加NaCl的目的是。
②加入无水MgSO4块状固体;目的是。
③(填操作名称)后进行蒸馏,收集150~155℃的馏分。
(6)、数据处理。反应开始时加入8.4mL(0.08mol)环己醇,20mL冰醋酸和过量的NaClO溶液。实验结束后收集到产品0.06mol,则该合成反应的产率为。 -
19、SbCl3用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为的Sb2S3 , 还含有As2S3、PbS、CuO和SiO2等)为原料制备SbCl3的工艺流程如下:

已知:①浸出液主要含盐酸和SbCl3 , 还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
②常温下, , ;
③溶液中离子浓度小于或等于mol/L时,认为该离子沉淀完全。
回答下列问题:
(1)、加快辉锑矿“酸浸”的措施有____。A、将辉锑矿粉碎 B、用酒精灯加热 C、用玻璃棒搅拌 D、适当增加酸液浓度(2)、滤渣1中除了S之外,还有。(3)、浸出液中加入适量Sb的目的是。(用化学方程式表示)(4)、已知浸出液中c(Cu2+)=0.01mol/L、c(Pb2+)=0.10mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是(填化学式);常温下,“除铜、铅”时Cu2+和Pb2+均沉淀完全,此时溶液中不低于mol/L,Na2S也不宜过多,其原因为。(5)、在“除砷”过程中,氧化产物为H3PO4 , 则该反应中氧化剂、还原剂的物质的量之比为;已知在“电解”SbCl3溶液时,无气体生成,被氧化的Sb元素与被还原的Sb元素的质量之比为3:2,可在上述流程中循环利用的物质有。 -
20、常温下,AgCl(白色)与(砖红色)的沉淀溶解平衡曲线如图所示, , , 或。下列说法错误的是( )
 A、 B、区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀 C、向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 D、反应的平衡常数K为
A、 B、区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀 C、向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 D、反应的平衡常数K为