-
1、孔雀石的主要成分为CuCO3·Cu(OH)2某同学设计从孔雀石中冶炼铜的方案如图:
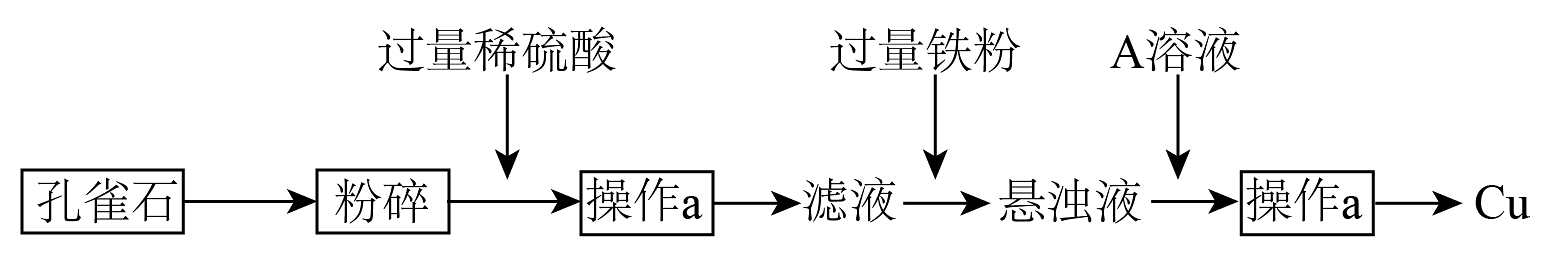
回答下列问题:
(1)、将孔雀石粉碎的目的是 , 加入过量稀硫酸,可观察到的现象是。(2)、操作a的名称是 , 在滤液中加入过量铁粉发生的反应有(用离子方程式表示)(3)、A的化学式为 , 在悬浊液中加入A的目的是。(4)、从滤液中获得铜的另外一种方案是:现有111kgCuCO3·Cu(OH)2 , 通过这种方案理论上可以制取kg铜(5)、由孔雀石冶炼铜还可有第二种方案:将孔雀石与焦炭一起加热,可以生成铜、二氧化碳、水。①该反应的还原剂是
②CuCO3·Cu(OH)2与焦炭物质的量之比应该为 , 实际中碳要过量一些。
-
2、铁元素存在多种价态,且不同价态的铁元素在一定条件下可以相互转化。回答下列问题:(1)、基态Fe3+的简化电子排布式为(2)、向2mL 1mol/L的Fe(NO3)2 , 溶液中加入2mol/L的H2SO4溶液至Fe2+恰好转化为Fe3+ , 该反应的离子方程式为:(3)、K2FeO4是新型水处理剂,将KOH溶液、KClO溶液与Fe2(SO4)3溶液混合可得到K2FeO4。K2FeO4中铁元素的化合价为: , 该反应的离子方程式为: , 当有3mol K2FeO4生成时,反应中转移电子的数目为:NA。(4)、某同学设计如图装置制备一定量的Fe(OH)2 , 并使其能在较长时间内存在。

①仪器X的名称是: , 装置3的作用是。
②实验开始时,开关K2应(填“打开”或“关闭”),这样操作的目的是。
-
3、根据下列实验操作和现象所得结论正确的是
选项
实验操作和现象
实验结论
A
碳和浓硫酸加热所得气体产物依次通过品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊
气体产物中含有和
B
向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝
溶液X中无
C
取少量淀粉溶液于试管,加入稀硫酸混合均匀后,加热一段时间,冷却。向冷却后的溶液中加入足量溶液,再加入少量新制 , 加热,产生砖红色沉淀。
说明淀粉已水解
D
将溶液与溶液等体积混合,取少量混合液滴加KSCN溶液,溶液变红
与的反应有一定限度
A、A B、B C、C D、D -
4、SO2可形成酸雨,是大气污染物。利用如图装置既可以吸收工厂排放的SO2又可以制得硫酸溶液。下列说法正确的是
 A、a极为负极,发生还原反应 B、b极的电极反应式为 C、电子的流动方向:a极→电解质溶液→b极 D、从左下口流出的硫酸溶液的质量分数一定大于50%
A、a极为负极,发生还原反应 B、b极的电极反应式为 C、电子的流动方向:a极→电解质溶液→b极 D、从左下口流出的硫酸溶液的质量分数一定大于50% -
5、设为阿伏加德罗常数的值,下列说法正确的是A、足量MnO2和80mL10mol/L浓盐酸共热可生成Cl2的分子数为 B、标准状况下,22.4LSO3所含分子数为 C、标准状况下,1mol聚丙烯中含有碳碳双键的数目为 D、1molCH3CH2CH2CH3中含有极性键的数目为
-
6、达菲(磷酸奥司他韦,分子式为C16H28N2O4·H3PO4)为治疗流感的首选药,莽草酸作为合成达菲的中间体而受到重视,其结构简式如图所示。下列关于莽草酸的说法正确的是
 A、莽草酸与
A、莽草酸与 为同种物质
B、0.1mol莽草酸与足量Na反应生成4.48LH2
C、莽草酸分子中一定共面的碳原子有5个
D、将莽草酸加入酸性高锰酸钾溶液中,溶液褪色,说明莽草酸中含有碳碳双键
为同种物质
B、0.1mol莽草酸与足量Na反应生成4.48LH2
C、莽草酸分子中一定共面的碳原子有5个
D、将莽草酸加入酸性高锰酸钾溶液中,溶液褪色,说明莽草酸中含有碳碳双键
-
7、物质A能发生连续氧化(其他反应条件未标出),下列说法错误的是
 A、若A为常见的碱性气体,C为红棕色气体,则由A反应生成1molB时,转移的电子数为 B、若B在常温下是能使品红溶液褪色的气体,则C溶于水形成的酸一定是强酸 C、若C的分子式为C2H4O2 , 且为一元弱酸,则A中可能含羟基 D、若C能使澄清石灰水变浑浊,则A在常温下一定是气体
A、若A为常见的碱性气体,C为红棕色气体,则由A反应生成1molB时,转移的电子数为 B、若B在常温下是能使品红溶液褪色的气体,则C溶于水形成的酸一定是强酸 C、若C的分子式为C2H4O2 , 且为一元弱酸,则A中可能含羟基 D、若C能使澄清石灰水变浑浊,则A在常温下一定是气体 -
8、已知H2O2(aq)分解为H2O(l)和O2(g)的能量变化如图曲线A所示,若在H2O2溶液中加入少量KI,则H2O2的分解过程可表示为:①H2O2+I-=H2O+IO- , ②H2O2+IO-=H2O+O2+I- , 其能量变化如图曲线B所示。下列有关说法不正确的是
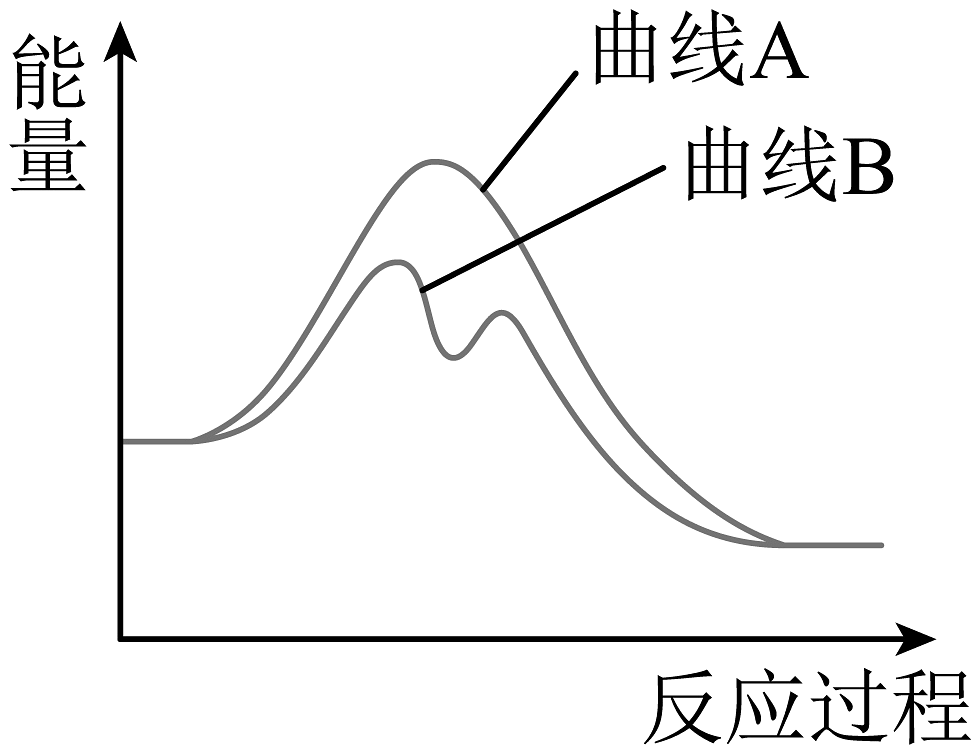 A、上述反应①为吸热反应,反应②为放热反应 B、2molH2O2(aq)具有的能量大于2molH2O(l)和1molO2(g)具有的总能量 C、I-在H2O2分解过程中起到催化剂作用 D、催化剂不参与化学反应,反应前后性质、质量不变
A、上述反应①为吸热反应,反应②为放热反应 B、2molH2O2(aq)具有的能量大于2molH2O(l)和1molO2(g)具有的总能量 C、I-在H2O2分解过程中起到催化剂作用 D、催化剂不参与化学反应,反应前后性质、质量不变 -
9、下列变化对应的离子方程式正确的是A、室温下用稀硝酸溶解铜: B、碘化亚铁溶液中滴加少量稀硝酸: C、用漂白粉溶液脱除废气中的少量SO2: D、硅酸钠溶液通入过量CO2:
-
10、金属钛()抗腐蚀性能好,露置于空气中数年,仍光亮如初.以金红石(主要成分是)为原料生产金属钦的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(),得到和一种可燃性气体;②在稀有气体环境和加热条件下,用和反应得到和 , 下列说法不正确的是A、①中的反应 B、②中的稀有气体的作用是隔绝空气 C、②中发生的反应为置换反应 D、金属钛在常温下不与反应
-
11、劳动创造美好生活,下列物质的应用与所述的化学知识无关联性的是
选项
生活实践或劳动项目
化学知识
A
手工制豆腐时用MgCl2点卤
利用MgCl2使豆浆中的蛋白质聚沉
B
糕点师用小苏打作发泡剂烘焙面包
Na2CO3与酸反应生成气体
C
交警用含有酸性重铬酸钾溶液的酒精测试仪查酒驾
乙醇能使酸性重铬酸钾溶液变色
D
兴趣小组用食醋清除水壶中的少量水垢(主要成分是碳酸钙)
酸性:乙酸>碳酸
A、A B、B C、C D、D -
12、下列说法正确的是A、多电子原子不同能级能量高低的比较中:4s>3d>3p B、某元素基态原子的最外层电子数是次外层电子数的1.5倍,则该元素基态原子的核外电子排布式为:1s22s22p1 C、基态K原子的核外电子的空间运动状态共有19种 D、根据洪特规则可知1s22s22p2的价层电子的轨道表示为:

-
13、我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示。下列说法正确的是
 A、从物质分类的角度看,图中的物质属于酸性氧化物的有5种 B、1molSO2与足量的O2在一定条件下反应,生成1molSO3 C、实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处 D、铜单质和稀HNO3反应的离子方程式:Cu+2H+=Cu2++H2
A、从物质分类的角度看,图中的物质属于酸性氧化物的有5种 B、1molSO2与足量的O2在一定条件下反应,生成1molSO3 C、实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处 D、铜单质和稀HNO3反应的离子方程式:Cu+2H+=Cu2++H2 -
14、化学无处不在,下列与化学有关的说法正确的是A、淀粉、纤维素、油脂和蛋白质都属于天然高分子化合物 B、手术刀高温消毒的目的是使细菌的蛋白质变性 C、清华大学打造的类脑芯片——“天机芯”的主要成分与光导纤维相同 D、我国实现了高性能纤维锂离子电池(放电时,电能转化为化学能)的规模化制备
-
15、下列有关化学用语或化学知识的理解正确的是A、甲烷、四氯甲烷都是正四面体结构 B、CH3CH2OOCH属于羧酸类 C、一氯甲烷的电子式为
 D、乙醇能与钠反应,证明乙醇是一种弱酸
D、乙醇能与钠反应,证明乙醇是一种弱酸
-
16、近年来,我国在探索太空、开发5G等方面都取得了举世瞩目的成就,这些成就都离不开化学材料的开发和利用,下列有关说法正确的A、大飞机C919采用了大量复合材料与铝锂合金,铝锂合金比其纯金属具有更高的强度、韧性和熔点 B、5G技术的应用离不开光缆,我国光缆线路总长度超过了三千万千米,光缆的主要成分是晶体硅 C、“神舟十二号”宇宙飞船返回舱外表面使用的高温结构陶瓷属于有机高分子材料 D、碳纳米管有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等
-
17、肼()是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用和NaClO溶液反应制备肼,装置如图所示(夹持装置未画出)。
 (1)、装置A中制备的化学方程式为。(2)、装置B中长颈漏斗的作用是;仪器C中盛放的试剂为。(3)、的电子式为 , 装置B中制备的化学方程式为;(4)、由于反应放热,通常把B装置放于温度较低的水浴中,目的是;实验时,先打开A中的分液漏斗活塞得到饱和氨水后,再打开D中的漏斗活塞的原因是。(5)、测定产品中的质量分数
(1)、装置A中制备的化学方程式为。(2)、装置B中长颈漏斗的作用是;仪器C中盛放的试剂为。(3)、的电子式为 , 装置B中制备的化学方程式为;(4)、由于反应放热,通常把B装置放于温度较低的水浴中,目的是;实验时,先打开A中的分液漏斗活塞得到饱和氨水后,再打开D中的漏斗活塞的原因是。(5)、测定产品中的质量分数取装置B中的溶液4.00g,并调节为弱酸性,加水配成500mL溶液,从中取25.00mL溶液与0.2000mol/L的溶液反应(只有参与反应,其他物质不反应),反应过程中有无污染性的气体生成,消耗溶液的体积为20.00mL,则该产品中的质量分数为%。
-
18、图示分析是学习化学重要手段之一,学习过程中常遇到各类“数形结合”问题。结合所给图示回答相关问题:(1)、从元素化合价和物质类别两个维度学习、研究物质的性质及转化,是一种行之有效的方法。图1是氮元素的“价类二维图”的部分信息。

①X、Y的化学式分别为、。
②图中关于NO2转化为HNO3的反应过程,下列说法不正确的是。
a.氮元素的化合价不发生变化
b.该转化过程中,NO2一定既是氧化剂,又是还原剂
c.若用NO2与H2O反应制取HNO3 , 可生成另一种产物NO
(2)、NO2、NO和SO2是大气初期污染物的主要成分,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图2所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应,该反应的化学方程式为。 (3)、研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2 , 弱酸),然后才转化成NO2 , 如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸。图3为金属在不同浓度的HNO3—H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图,请回答下列问题:
(3)、研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2 , 弱酸),然后才转化成NO2 , 如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸。图3为金属在不同浓度的HNO3—H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图,请回答下列问题:
①最佳溶解金属的混合溶液中HNO3的质量分数为 , 理由是。
②过氧化氢与亚硝酸反应的化学方程式为。
-
19、臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)
 N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3 , 经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3 , 经过一段时间后达到平衡。反应过程中测定的部分数据见下表:t/s
0
3
6
12
24
n(O2)/mol
0
0.36
0.60
0.80
0.80
下列有关说法正确的是
A、反应在0~3 s内的平均速率v(NO2)=0.24 mol·L−1·s−1 B、在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2 , 反应达到平衡时,压强为起始时的0.88倍 C、24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L−1 , 则反应的ΔH>0 D、在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2 , 达到平衡时,N2O5的转化率大于20% -
20、一定条件下,在体积为10L的固定容器中发生反应:反应过程如图示。下列说法不正确的是
 A、时正反应速率大于逆反应速率 B、X曲线表示的物质的量随时间的变化 C、 , 的平均反应速率 D、达到平衡状态时,相同时间内与断键的数目之比是
A、时正反应速率大于逆反应速率 B、X曲线表示的物质的量随时间的变化 C、 , 的平均反应速率 D、达到平衡状态时,相同时间内与断键的数目之比是