-
1、在2 L密闭容器中,3 mol A和1 mol B发生反应: , 10 s末时,物质C的浓度为0.6 mol/L,下列说法正确的是A、10 s内, mol/(L·s) B、10 s内,物质A的转化率为60% C、10 s末,B的物质的量为0.2 mol D、10 s末,C的物质的量分数为15%
-
2、向10 mL 0.1 mol/L的醋酸溶液中加蒸馏水,将其稀释到1 L,下列说法中不正确的是,A、的电离程度增大 B、增大 C、的数目增多 D、增大
-
3、下列电离方程式正确的是A、 B、 C、 D、
-
4、锌铜原电池的装置如图,下列说法正确的是
 A、若用乙醇代替CuSO4溶液,则也能构成原电池 B、铜电极的电极反应式为Cu2++2e-=Cu C、电子由锌电极流出,经电解质溶液传递到铜电极 D、电池工作时,溶液中的Cu2+向锌电极迁移
A、若用乙醇代替CuSO4溶液,则也能构成原电池 B、铜电极的电极反应式为Cu2++2e-=Cu C、电子由锌电极流出,经电解质溶液传递到铜电极 D、电池工作时,溶液中的Cu2+向锌电极迁移 -
5、菠萝酯(
 )是一种具有菠萝香味的赋香剂,其合成路线如下(部分反应试剂、反应条件略):
)是一种具有菠萝香味的赋香剂,其合成路线如下(部分反应试剂、反应条件略): (1)、化合物iv的分子式为。化合物为iii的同分异构体,其核磁共振氢谱有一组峰,的结构简式为 , 其名称为。(2)、反应④中,化合物与无色无味气体反应,生成化合物vi,原子利用率为 , 为。(3)、根据化合物vi(
(1)、化合物iv的分子式为。化合物为iii的同分异构体,其核磁共振氢谱有一组峰,的结构简式为 , 其名称为。(2)、反应④中,化合物与无色无味气体反应,生成化合物vi,原子利用率为 , 为。(3)、根据化合物vi( )的结构特征,分析预测可能的化学性质,完成下表。
)的结构特征,分析预测可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
取代反应
消去反应
(4)、关于反应⑤的说法不正确的有_____。A、反应过程中,有键的断裂和形成 B、化合物viii中,碳原子只有杂化方式 C、化合物vii中键电子云成镜面对称 D、另一种无机生成物是含有极性键的非极性分子(5)、以甲醇、环戊二烯和丙酮为含碳原料,利用反应①、②和③的原理,合成化合物甲( )。
)。(a)最后一步反应的化学方程式为。
(b)从甲醇出发,第一步中反应条件为。
(c)写出利用③的原理转化的方程式。
-
6、银及其化合物在催化、工农业等方面具有重要应用。(1)、受热分解生成单质,同时按物质的量比为2:1产生2种气体。
①是第五周期、ⅠB族元素,基态的价层电子排布式为。
②受热分解的化学方程式为。
③氧化成的反应机理如下,请补充完整方程式完善反应机理:
反应1:
反应2:
已知:反应1为总反应的决速步,则正反应的活化能(填“<”“=”或“>”)。
(2)、向饱和溶液(有足量的)中滴加氨水,本题只考虑以下平衡:(i)
(ii)
(iii)
①对上述平衡体系说法正确的是。
A.加入少量固体,反应(i)的平衡正向移动
B.加入少量水稀释,溶液中离子的总浓度减小
C.通入少量氨气,平衡时比值增大
D.加入少量固体,反应(ii)的平衡逆向移动
②滴加氨水过程中与的关系如图所示(其中代表、、或),其中代表的曲线是(填Ⅰ、Ⅱ、Ⅲ、Ⅳ);反应(ii)的平衡常数为。

③溶液中,加入的氨水(以氨分子计),计算平衡后溶液中水中(写出计算过程,近似只转化为)
-
7、
稀土抛光粉有优良抛光性能。某抛光后产生的抛光渣(含、、、、、等的化合物)进行提纯的工艺如下:

已知:25℃时, , , 。一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物
开始沉淀的
2.3
3.5
6.4
7.2
6.2
完全沉淀的
3.2
4.6
9.0
9.1
8.2
(1)“酸溶”时,需控制80℃水浴加热,若温度过高浸出率降低的原因是。发生反应的离子方程式为。(2)“滤渣1”的主要成分为。(3)“除杂1”中,加入氨水控制范围为 , 溶液中(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为。(4)的晶胞结构如图1所示,晶胞参数为 , 原子处于形成的四面体间隙中。则原子的配位数为 , 晶胞密度为。(列出计算式,的式量为 , 阿伏加德罗常数为)(5)
(5)

纳米分散液用于光学玻璃抛光时,值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳值为 , 在较低值,抛光效果不理想的原因为。
-
8、漂白液是生活中常见的一种含氯消毒剂,工业上采用与过量溶液制备。实验室采用图8所示装置模拟制备漂白液。
 (1)、实验开始,烧瓶中反应的化学方程式为。(2)、试剂a为。(3)、用移液管吸取漂白液,稀释成的试样。再量取试样置于碘量瓶中,加入适量的稀硫酸溶液和过量的KI溶液,摇匀后在暗处静止。然后用的标准溶液滴至淡黄色,加几滴淀粉溶液做指示剂,溶液立即变蓝色,继续滴定至蓝色消失,读取滴定体积。已知:
(1)、实验开始,烧瓶中反应的化学方程式为。(2)、试剂a为。(3)、用移液管吸取漂白液,稀释成的试样。再量取试样置于碘量瓶中,加入适量的稀硫酸溶液和过量的KI溶液,摇匀后在暗处静止。然后用的标准溶液滴至淡黄色,加几滴淀粉溶液做指示剂,溶液立即变蓝色,继续滴定至蓝色消失,读取滴定体积。已知:①上述滴定操作中用到的仪器有碘量瓶、胶头滴管、。
②该漂白液中的浓度为。
(4)、某合作学习小组研究温度对漂白液的影响:①同学甲认为温度升高,漂白液将变大,理由是溶液中存在平衡i:(用化学方程式表示),温度升高促进平衡正向移动。
②同学乙采用传感器测定不同温度漂白液的数据如下表所示:
实验
1
2
3
温度(℃)
25
30
40
漂白液
数据发现 , 同学乙分析,认为结果出现异常受到水电离平衡的影响,请结合该角度及平衡移动原理进行解释。
③同学乙通过查阅纯水在不同温度的变化,与实验漂白液对比如下表:
实验
1
2
3
温度(℃)
25
30
40
漂白液
纯水
为证明同学甲理由中平衡随温度升高向正反应移动,则(填“<”“=”或“>”)。
④同学丙猜想温度升高还可能发生。已知:为强酸。请设计实验证明同学丙的猜想。
-
9、某低成本储能电池原理如图所示。下列说法正确的是
 A、放电时,负极质量逐渐减小 B、放电时,电路中通过 , 则有被氧化 C、储能过程中,左池溶液浓度增大 D、充电时总反应:
A、放电时,负极质量逐渐减小 B、放电时,电路中通过 , 则有被氧化 C、储能过程中,左池溶液浓度增大 D、充电时总反应: -
10、生物质X(
 )与Y(
)与Y( )同时反应如下:
)同时反应如下:反应Ⅰ:(
 )
)反应Ⅱ:(
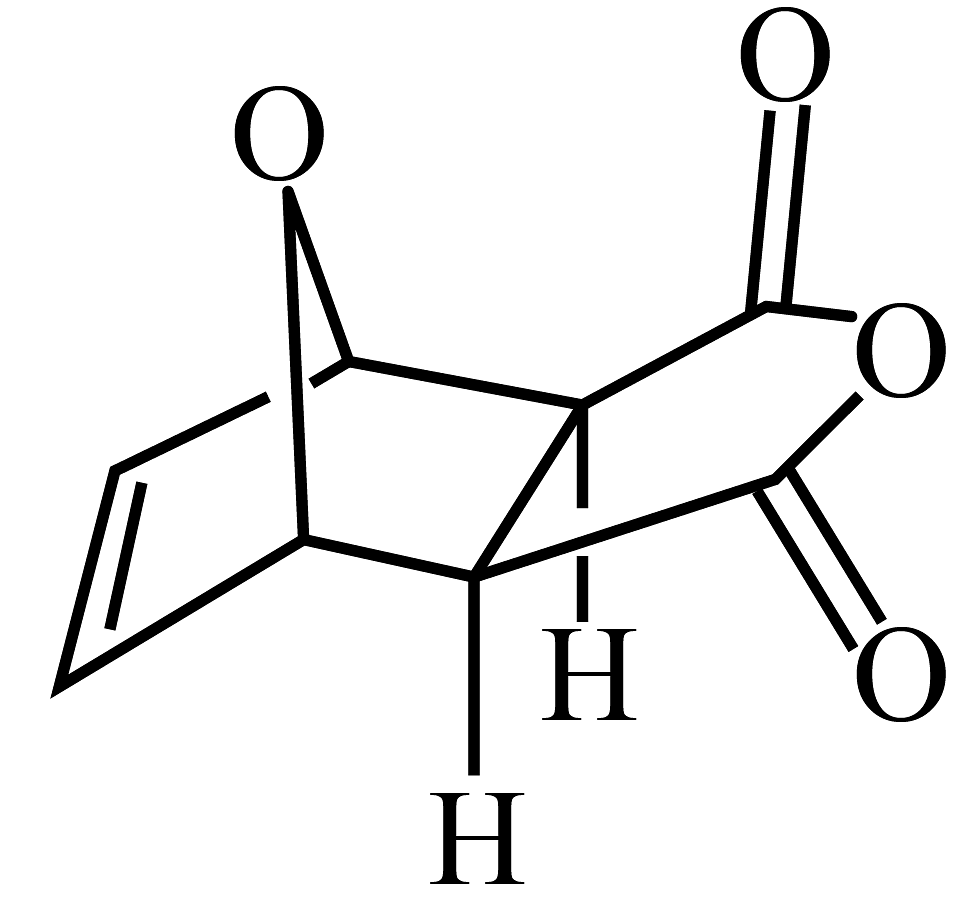 ) , 反应历程如图,下列说法不正确的是
) , 反应历程如图,下列说法不正确的是 A、 B、相同条件下,反应Ⅰ更快达到平衡 C、降低温度,的平衡物质的量分数增大 D、升高温度,反应Ⅰ、Ⅱ的反应速率都增大
A、 B、相同条件下,反应Ⅰ更快达到平衡 C、降低温度,的平衡物质的量分数增大 D、升高温度,反应Ⅰ、Ⅱ的反应速率都增大 -
11、用如图装置分别进行两个实验:①先注入 , 再打开止水夹;②先打开止水夹 , 再将中水注入烧瓶。下列说法正确的是
 A、实验室可以加热直接制取 B、实验②观察到烧瓶中产生红色的“喷泉” C、实验①先产生白雾,然后观察到喷泉现象 D、实验①后烧瓶中一定存在
A、实验室可以加热直接制取 B、实验②观察到烧瓶中产生红色的“喷泉” C、实验①先产生白雾,然后观察到喷泉现象 D、实验①后烧瓶中一定存在 -
12、探究蔗糖与浓硫酸反应及气体产物的性质,设计如图所示实验,下列说法正确的是
 A、蔗糖变为黑色,说明浓硫酸有强氧化性 B、品红和酸性溶液褪色原理相同 C、石蕊变红,说明气体产物溶于水有酸性 D、澄清石灰水变浑浊,气体产物一定含
A、蔗糖变为黑色,说明浓硫酸有强氧化性 B、品红和酸性溶液褪色原理相同 C、石蕊变红,说明气体产物溶于水有酸性 D、澄清石灰水变浑浊,气体产物一定含 -
13、MMA结构简式如图所示,可用于合成有机玻璃聚甲基丙烯酸甲酯(PMMA)。有关MMA说法正确的是
 A、是PMMA的链节 B、所有碳原子一定共平面 C、能发生加成、水解和消去反应 D、能使溴水和酸性溶液褪色
A、是PMMA的链节 B、所有碳原子一定共平面 C、能发生加成、水解和消去反应 D、能使溴水和酸性溶液褪色 -
14、2022年我国十大科技突破——海水直接电解制 , 其工作原理如图,防水透气膜只能水分子通过。下列说法正确的是
 A、a为电解池的阴极 B、b的电极反应方程式: C、去除透气膜,a极发生的电极反应不变 D、电解池工作时,海水侧的离子浓度理论上逐渐减小
A、a为电解池的阴极 B、b的电极反应方程式: C、去除透气膜,a极发生的电极反应不变 D、电解池工作时,海水侧的离子浓度理论上逐渐减小 -
15、一种新型离子液体溶剂结构简式如图所示。下列说法正确的是
 A、电负性: B、离子液体中存在离子键 C、的空间构型为平面四边形 D、该离子液体中的所有元素都分布在区
A、电负性: B、离子液体中存在离子键 C、的空间构型为平面四边形 D、该离子液体中的所有元素都分布在区 -
16、下列装置按制备、收集、验证漂白性及尾气处理的顺序进行实验(“→”表示气流方向),能达到实验目的的是A、
 B、
B、 C、
C、 D、
D、
-
17、非物质文化遗产是中华优秀传统文化的重要组成部分。下列广东的非遗项目中涉及的主要物质由硅酸盐材料制成的是




A.粤绣
B.西关打铜
C.石湾陶塑
D.潮州木雕
A、A B、B C、C D、D -
18、反应 , 在温度为T1、T2时,平衡体系中的体积分数随压强变化曲线如图所示。下列说法正确的是
 A、A、C两点的反应速率:A>C B、A、C两点气体的颜色:A深,C浅 C、A、C两点气体的平均相对分子质量:A>C D、由状态B到状态A,可以采用升温的方法
A、A、C两点的反应速率:A>C B、A、C两点气体的颜色:A深,C浅 C、A、C两点气体的平均相对分子质量:A>C D、由状态B到状态A,可以采用升温的方法 -
19、据文献报道,我国学者提出O2氧化HBr生成Br2反应历程如图所示。下列有关该历程的说法错误的是
 A、O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O B、中间体HOOBr和HOBr中Br的化合价相同 C、发生步骤②时,断裂的化学键既有极性键又有非极性键 D、步骤③中,每生成1molBr2转移2mol电子
A、O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O B、中间体HOOBr和HOBr中Br的化合价相同 C、发生步骤②时,断裂的化学键既有极性键又有非极性键 D、步骤③中,每生成1molBr2转移2mol电子 -
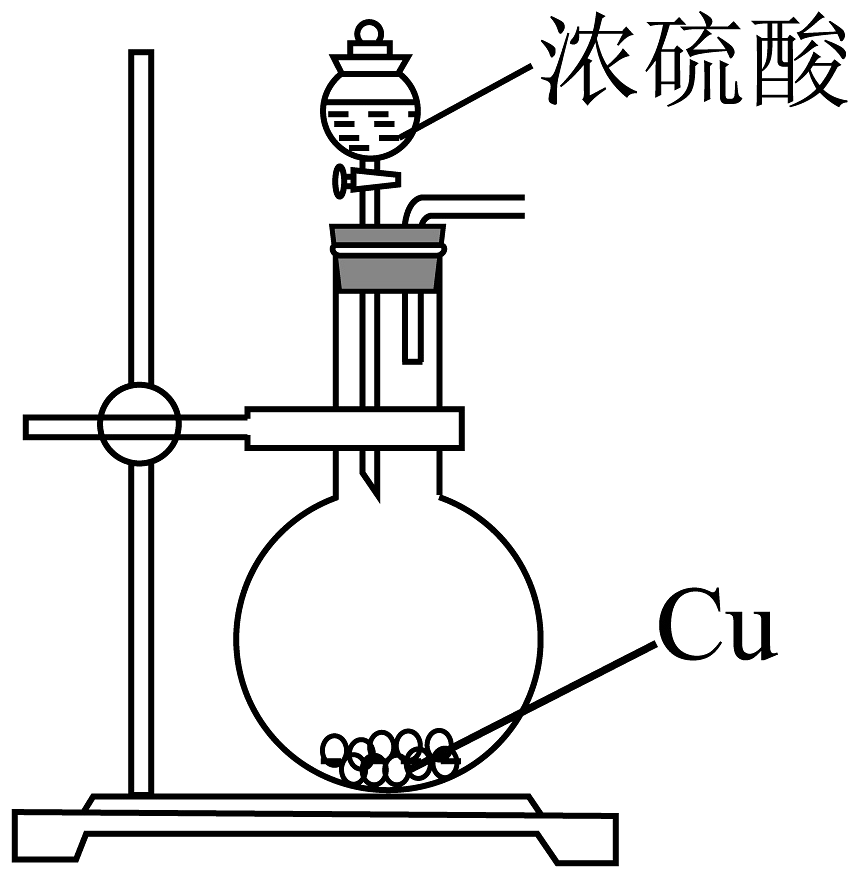
20、下列实验方案不能达到实验目的的是
A.检验乙醇与浓硫酸共热生成乙烯
B.检验1-溴丁烷发生消去反应生成丁烯


C.验证乙酸、碳酸、苯酚的酸性强弱
D.检验电石与水反应生成乙炔

 A、A B、B C、C D、D
A、A B、B C、C D、D