相关试卷
- 江苏省如皋中学2025-2026学年高三上学期测试(一)化学试题
- 广西壮族自治区来宾市多校2025-2026学年高二上学期11月期中联考 化学试题
- 江苏省苏州市吴江区汾湖高级中学2025-2026学年高二上学期9月月考化学试题
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 江苏省泰州市靖江高级中学2025-2026学年高一上学期9月月考化学试题
- 2026届广东省六校联盟高三年级第一次联考化学试题
- 四川省大数据智学领航联盟2026届高三上学期一模考试 化学试题
- 广西南宁市名校联盟2026届高三上学期8月一模化学试题
- 江苏省徐州市第七中学2025-2026学年高二上学期9月月考 化学试卷
-
1、唑草酮是一种药性强、易降解、污染少的除草剂,其中一种合成路线为:

已知:①DPPA是一种叠氮化试剂
②

回答下列问题:
(1)、A中含有官能团的名称为。(2)、下列说法正确的是 。A、唑草酮含有两个手性碳原子 B、A与B反应得到C的目的是保护氨基 C、F→G的反应类型包括加成反应和消去反应 D、碱性由弱到强的顺序为:E<A<F(3)、G的结构简式为。(4)、D→E的化学方程式为。(5)、C存在多种同分异构体,写出符合下列条件的结构简式(不考虑立体异构)。①分子中含有苯环,且能发生银镜反应;
②核磁共振氢谱图中有5组峰;
③分子中含有手性碳原子
(6)、结合本题流程,以苯胺( )和苯甲醛(
)和苯甲醛(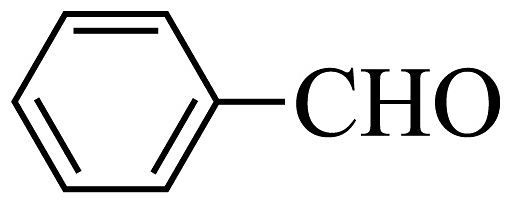 )为有机原料,无机试剂任选,合成化合物M(
)为有机原料,无机试剂任选,合成化合物M( )的合成路线。
)的合成路线。 -
2、实验室分离提纯甲苯、苯胺与苯甲酸的混合物的方案如下。
 (1)、写出水洗操作中用到最主要的玻璃仪器名称:;苯胺沸点高于甲苯沸点的原因是。(2)、步骤①加入盐酸发生反应的化学方程式为。(3)、步骤②利用强酸制弱酸得到的产物固体的主要成分为苯甲酸,为进一步分离提纯固体 , 下列操作步骤正确的排序为(填序号)。
(1)、写出水洗操作中用到最主要的玻璃仪器名称:;苯胺沸点高于甲苯沸点的原因是。(2)、步骤①加入盐酸发生反应的化学方程式为。(3)、步骤②利用强酸制弱酸得到的产物固体的主要成分为苯甲酸,为进一步分离提纯固体 , 下列操作步骤正确的排序为(填序号)。a.趁热过滤 b.冷却结晶 c.加热溶解 d.常温过滤 e.洗涤、干燥
(4)、当时,认为苯甲酸沉淀完全,则苯甲酸恰好沉淀完全时,溶液的(已知:苯甲酸的)。(5)、粗品有机相Ⅲ需要通过水蒸气蒸馏进一步提纯,该方法是将水蒸气通入有机物中,使该有机物在低于100℃的温度下,随着水蒸气一起蒸馏出来,从而保证有机物不被破坏。装置如图所示(夹持装置已略去)。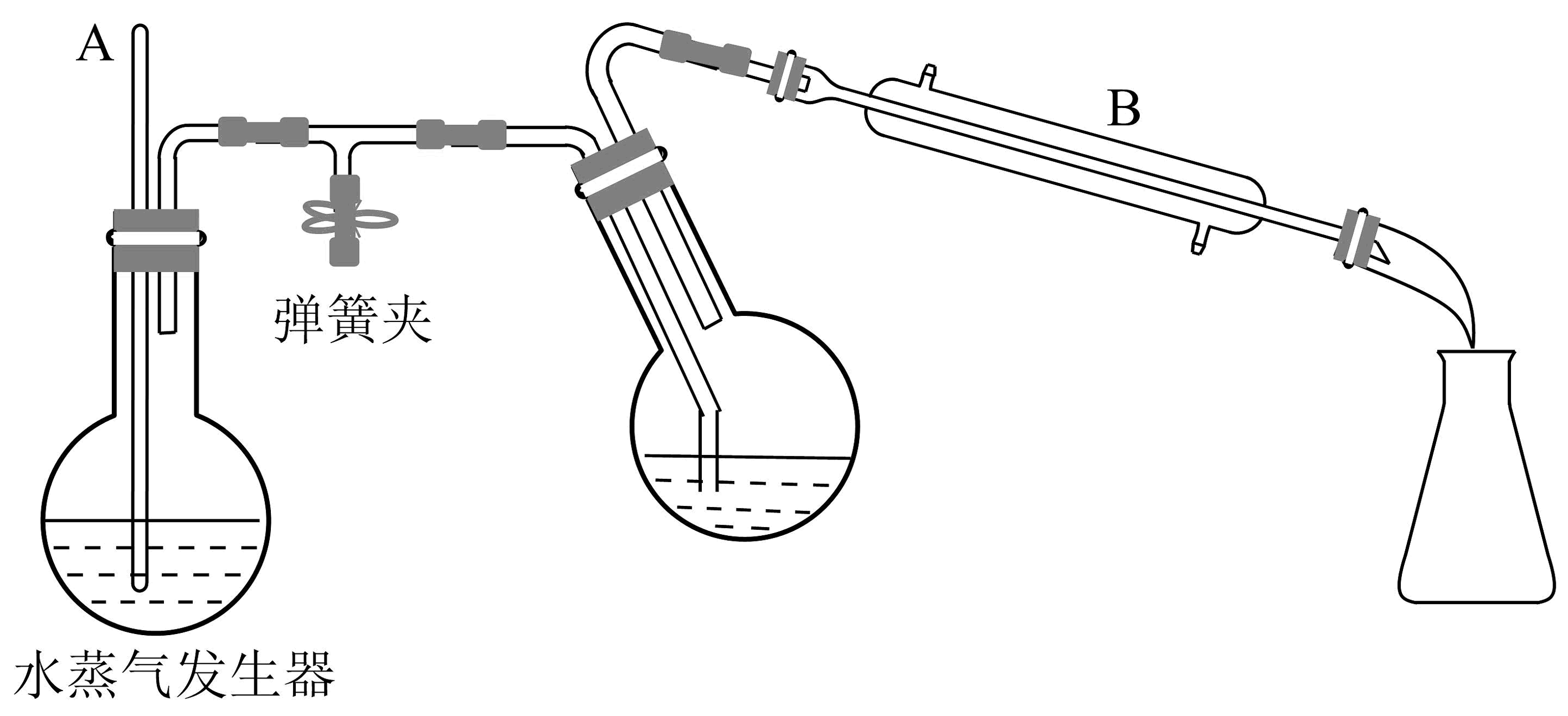
①装置中长玻璃管A的作用是。
②实验结束后,锥形瓶中的现象为。
-
3、Al元素具有很广泛的应用。(1)、请写出基态Al原子价层电子的电子排布图。(2)、与Al同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表 。
 A、a为I1、b为I2、c为I3 B、a为I2、b为I3、c为I1 C、a为I3、b为I2、c为I1 D、a为I1、b为I3、c为I2(3)、已知某晶体晶胞中阴离子做面心立方堆积,阴离子的位置(隐去阳离子)如图1所示,其晶胞中的阳离子在xy、xz、yz平面投影(隐去阴离子)均如图2所示,晶胞参数为apm。
A、a为I1、b为I2、c为I3 B、a为I2、b为I3、c为I1 C、a为I3、b为I2、c为I1 D、a为I1、b为I3、c为I2(3)、已知某晶体晶胞中阴离子做面心立方堆积,阴离子的位置(隐去阳离子)如图1所示,其晶胞中的阳离子在xy、xz、yz平面投影(隐去阴离子)均如图2所示,晶胞参数为apm。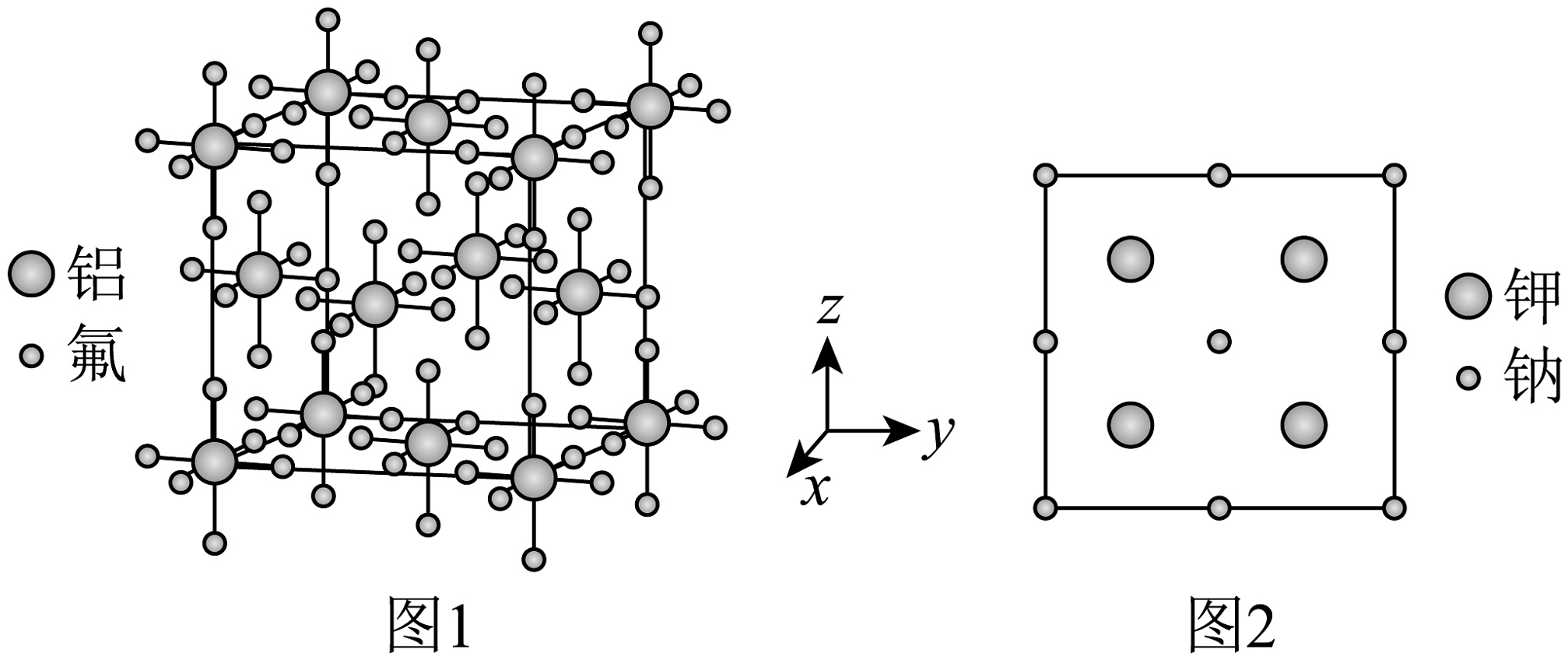
该物质的化学式为 , K+的配位数(紧邻的阴离子数)为。
(4)、聚合氯化铝是一种介于AlCl3和Al(OH)3之间的水溶性无机高分子聚合物,兴趣小组以铝土矿(主要成分为Al2O3 , 还含有少量Fe2O3和SiO2)为主要原料制备聚合氯化铝和金属铝的流程如图所示。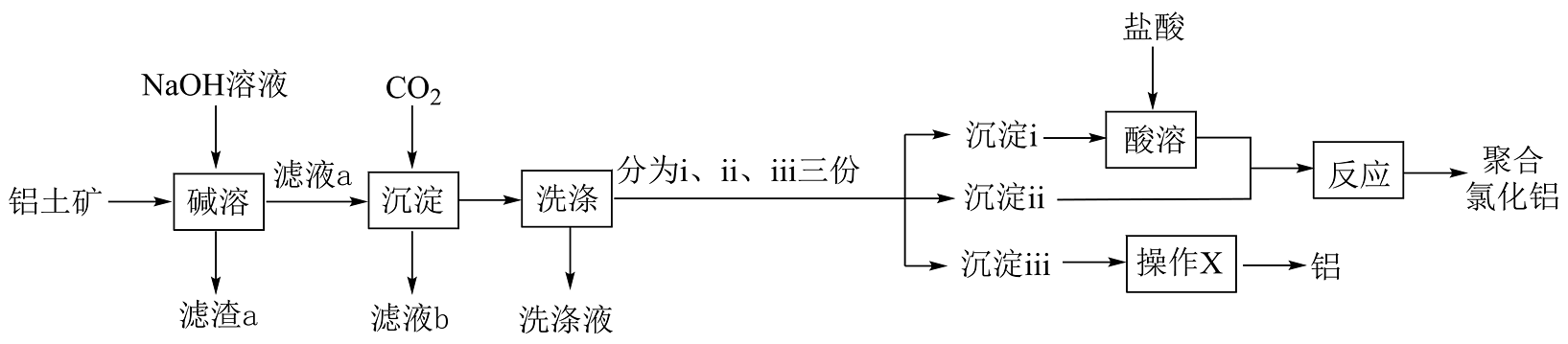
已知滤渣a中含有难溶的铝硅酸盐。
①下列说法正确的是。
A.“碱溶”时,所用NaOH溶液不能更换为氨水“碱溶”
B.滤液a中的溶质主要成分为NaOH、Na[Al(OH)4]、Na2SiO3
C.“操作X”可以是盐酸溶解、HCl气流中结晶、脱水、电解
D.通过控制沉淀ⅰ、ⅱ的比例可改变聚合氯化铝的组成
②若滤液a浓度较大,“沉淀”时通入过量CO2不利于减少生成沉淀中的杂质,原因是。
(5)、比较四羟基合铝酸根和硼酸根的碱性强弱[Al(OH)4]-[B(OH)4]-(填“>”、“<”);并从两者化学键的角度说明理由。(6)、无水氯化铝常用熔融盐电镀铝工艺中,在熔融的AlCl3、NaCl、KCl盐中存在着AlCl、Al2Cl、Na+、K+和Cl-离子,写出Al2Cl的结构式:。 -
4、以炼铁厂锌灰(主要成分为ZnO,含少量的CuO、MnO2、Fe2O3)原料制备的流程如图所示,已知:“浸取”工序中ZnO、CuO分别转化为可溶性的[Zn(NH3)4]2+和[Cu(NH3)4]2+。下列说法正确的是
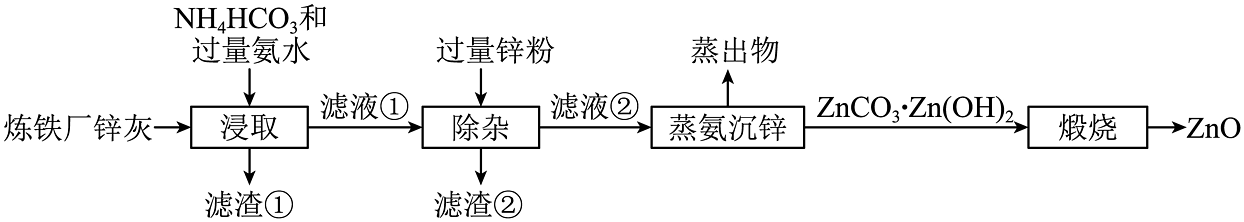 A、H-N-H的键角:[Cu(NH3)4]2+<NH3 B、滤渣②的主要成分为Fe2O3、Cu和Zn C、“滤渣①”经稀盐酸溶浸、过滤可获得MnO2 D、“浸取”采用较高温度更有利于提高浸取率
A、H-N-H的键角:[Cu(NH3)4]2+<NH3 B、滤渣②的主要成分为Fe2O3、Cu和Zn C、“滤渣①”经稀盐酸溶浸、过滤可获得MnO2 D、“浸取”采用较高温度更有利于提高浸取率 -
5、HA是一元弱酸,难溶盐MA的饱和溶液中c2(M+)随c(H+)而变化,已知M+不发生水解。实验发现,298K时c2(M+)—c(H+)为线性关系,如下图中实线所示。下列叙述正确的是
 A、溶液pH=4时,c(A-)=1.0×10-4mol·L-1 B、HA的电离常数Ka≈2.0×10-5 C、 D、溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
A、溶液pH=4时,c(A-)=1.0×10-4mol·L-1 B、HA的电离常数Ka≈2.0×10-5 C、 D、溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-) -
6、氮氧化物(NOx)是硝酸和肼等工业的主要污染物。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,反应物A在沸石笼内转化为B、C、D等中间体的过程如图2所示。下列说法正确的是
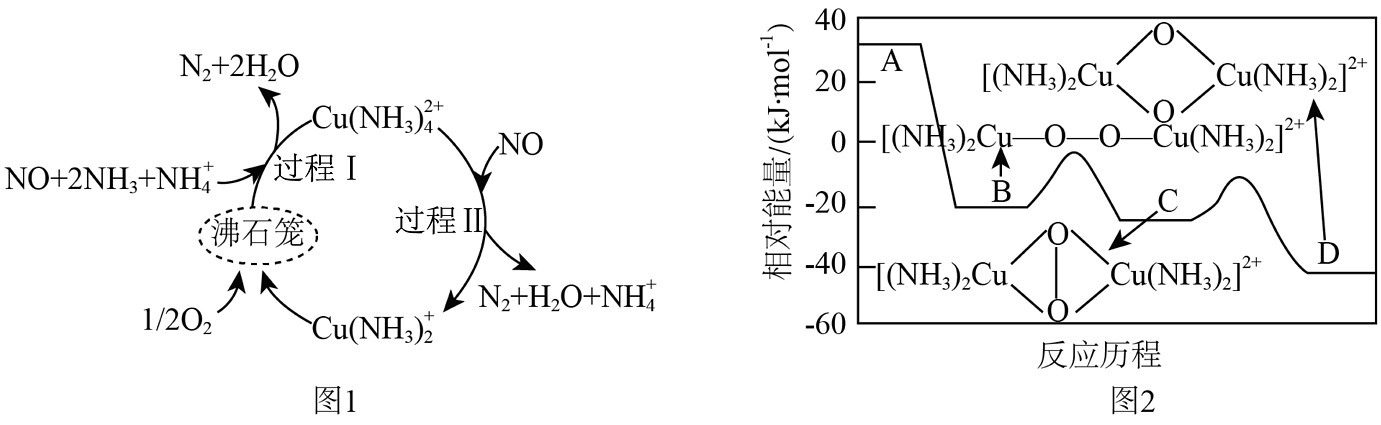 A、过程Ⅰ涉及非极性共价键的断裂与生成 B、过程Ⅱ中,脱除1molNO转移6mol电子 C、脱除NO的总反应中,氧化剂和还原剂的物质的量之比为4:5 D、图1总反应的化学方程式为4NO+4NH3+O24N2+6H2O
A、过程Ⅰ涉及非极性共价键的断裂与生成 B、过程Ⅱ中,脱除1molNO转移6mol电子 C、脱除NO的总反应中,氧化剂和还原剂的物质的量之比为4:5 D、图1总反应的化学方程式为4NO+4NH3+O24N2+6H2O -
7、工业上以氨基丙醇(H2NCH2CH2CH2OH)和乙二酸为原料电解,制备氨基丙酸和乙醛酸(HOOC-CHO)。装置如图所示,两级室之间以能透过H+的阳离子交换膜隔开。电解过程中温度保持不变。下列说法不正确的是
 A、Pb电极为阴极,H+通过离子交换膜从左室迁移至右室 B、反应过程中两室pH均变小 C、若将两电极材料互换,会使两种产品产量下降 D、PbO2电极上的电极反应:H2NCH2CH2CH2OH + H2O -4e-= H2NCH2CH2COOH + 4H+
A、Pb电极为阴极,H+通过离子交换膜从左室迁移至右室 B、反应过程中两室pH均变小 C、若将两电极材料互换,会使两种产品产量下降 D、PbO2电极上的电极反应:H2NCH2CH2CH2OH + H2O -4e-= H2NCH2CH2COOH + 4H+ -
8、硼及其化合物在材料制造、有机合成等方面应用广泛。图(a)为一种无限长单链状结构的多硼酸根,图(b)硼氢化钠晶胞结构。下列说法正确的是
 A、图a中多硼酸根的化学式为 [BO3] B、硼氢化钠晶体中BH周围紧邻且等距的Na+数为4 C、图(a)中O-B-O的键角大于BH中的H-B-H的键角 D、硼氢化钠晶体属于混合晶体,有较强的还原性
A、图a中多硼酸根的化学式为 [BO3] B、硼氢化钠晶体中BH周围紧邻且等距的Na+数为4 C、图(a)中O-B-O的键角大于BH中的H-B-H的键角 D、硼氢化钠晶体属于混合晶体,有较强的还原性 -
9、工业通过高温煅烧焦炭与SrSO4(硫酸锶)混合物,并通入一定量的空气,采用反应一或反应二制备SrS(s):
反应一:SrSO4(s) + 2C(s) 2CO2(g) + SrS(s) ΔH1
反应二:SrSO4(s) + 4CO(g) 4CO2(g) + SrS(s) ΔH2 = -118.8kJ·mol−1
已知:CO2(g) + C(s) = 2CO(g) ΔH3 = +172.5kJ·mol−1
C(s) + O2(g) = CO2(g) ΔH4 = -393.5kJ·mol−1
随温度升高,反应产物种类、物质的量的变化如图所示:
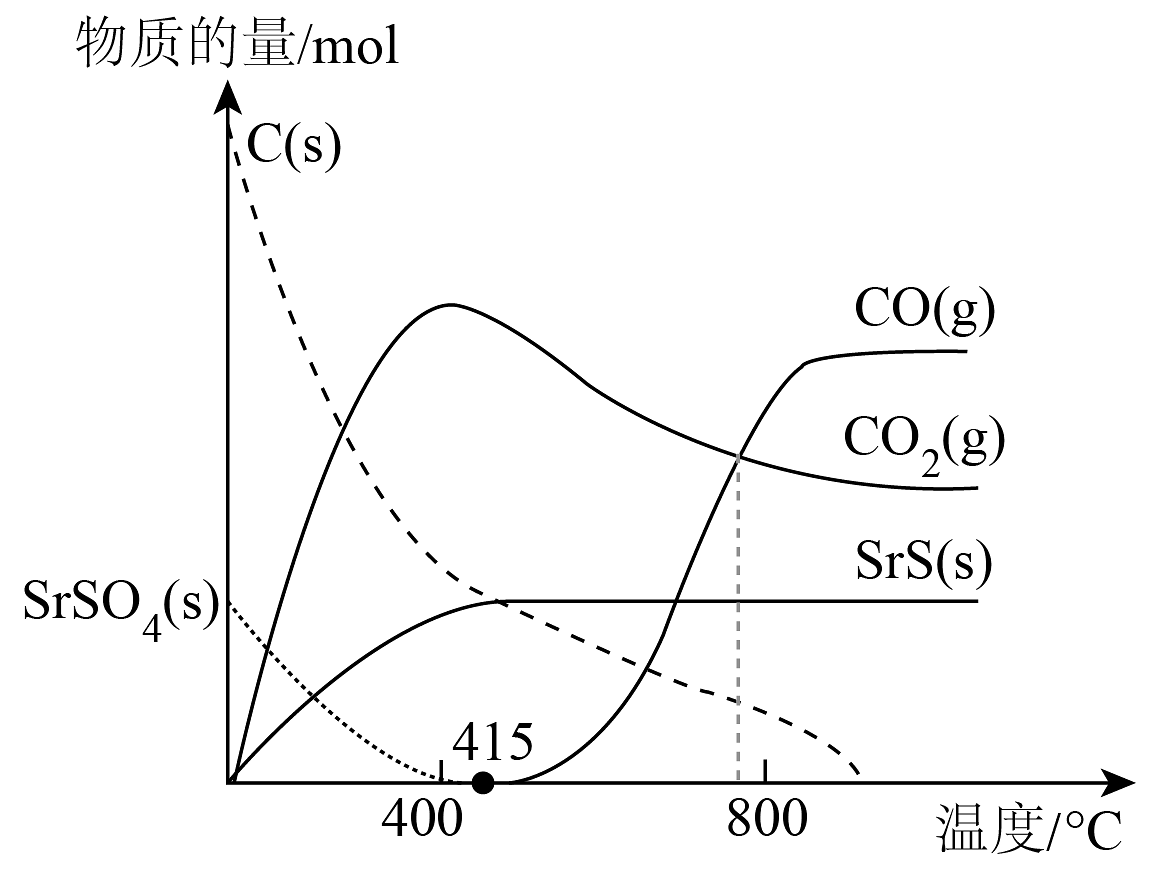
下列说法正确的是
A、ΔH1 = -226.2kJ·mol−1 B、800℃时,反应二的平衡常数K<1 C、当温度高于415℃时,体系内的主反应变为SrSO4(s)+ 4C(s)= 4CO(g)+ SrS(s) D、通入空气的作用是只是利用CO和O2反应放出的热量为制备过程供能 -
10、有机物P是一种治疗心律失常的药物,其部分合成路线如图所示(部分反应条件已略去)。

下列说法中错误的是
A、M→N为取代反应 B、M与溴水反应最多消耗 C、P完全氢化后有4个手性碳 D、P不能使酸性高锰酸钾溶液褪色 -
11、下列离子方程式书写正确的是A、烧碱溶液吸收少量二氧化硫:SO2+OH-=HSO B、草酸(H2C2O4)与酸性KMnO4溶液反应:5C2O+2MnO+16H+=10CO2↑+2Mn2++8H2O C、向Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO+4OH-=Mg(OH)2↓+2CO+2H2O D、CO2通入足量的NaClO溶液中:CO2+2ClO-+H2O=2HClO+CO
-
12、关于反应2MnSO4+5Na2S2O8+8H2O=2NaMnO4+4Na2SO4+8H2SO4 , 下列说法正确的是A、MnSO4是氧化剂 B、Na2S2O8中S元素化合价为+7价 C、生成284 g NaMnO4时转移10 mol电子 D、Mn位于第四周期VIB族
-
13、结构决定性质,性质决定用途。下列结构或性质不能解释其用途的是A、植物油可通过催化加氢提高饱和度,可制取肥皂 B、乙醇极性较小,可将95%乙醇加入[Cu(NH3)4]SO4溶液中析出深蓝色晶体 C、维生素C具有强还原性,可做水果罐头中常用的抗氧化剂 D、石墨中C原子未杂化的p轨道重叠,电子在整个平面内运动,可制成导电材料
-
14、下列有关实验的说法中不正确的是A、对于含重金属离子的废液,可利用沉淀法进行处理 B、发生火情时,若火势不大,可用湿布或石棉布覆盖火源以灭火 C、实验室中未用完的白磷:放回原试剂瓶 D、如果不慎将苯酚沾到皮肤上,应立即用大量水冲洗,再用乙醇溶液冲洗
-
15、下列性质的比较正确的是A、酸性:硬脂酸>CH3COOH B、化合物中键的极性:NCl3>NF3 C、原子半径:Mg>Si>O D、第一电离能: Li<Na<K
-
16、下列描述原子结构的化学用语正确的是A、氨基的电子式:
 B、乙烯分子的结构简式为
C、基态铜原子的价层电子排布式:3d94s2
D、H2O的VSEPR模型:
B、乙烯分子的结构简式为
C、基态铜原子的价层电子排布式:3d94s2
D、H2O的VSEPR模型:
-
17、下列分子属于非极性分子的是A、CH2Cl2 B、CS2 C、NCl3 D、H2S
-
18、一种生物质基乙醛催化合成高端稽细化工品对甲基苯甲醛的绿色路线如下(虚线框部分)。
 (1)、化合物ⅲ的分子式为 , 其官能团的名称为。(2)、化合物v的某同分异构体为芳香化合物,其能与FeCl3溶液发生显色反应,核磁共振氢谱图上有五组峰,且峰面积比为3:2:2:2:1,则该化合物的结构简式为。(3)、关于上述合成路线中的相关物质及转化,下列说法正确的有___________。A、纤维素和葡萄糖均属于糖类,且都是纯净物 B、化合物i在铜的催化下被O2氧化成ⅱ,涉及σ键的断裂和π键的生成 C、化合物iv和v的分子中均存在手性碳原子,且手性碳原子的数量相同 D、化合物v到vi的转化中存在碳原子的杂化方式由sp3到sp2的转变(4)、对化合物ⅲ,分析预测其可能的化学性质,完成下表。
(1)、化合物ⅲ的分子式为 , 其官能团的名称为。(2)、化合物v的某同分异构体为芳香化合物,其能与FeCl3溶液发生显色反应,核磁共振氢谱图上有五组峰,且峰面积比为3:2:2:2:1,则该化合物的结构简式为。(3)、关于上述合成路线中的相关物质及转化,下列说法正确的有___________。A、纤维素和葡萄糖均属于糖类,且都是纯净物 B、化合物i在铜的催化下被O2氧化成ⅱ,涉及σ键的断裂和π键的生成 C、化合物iv和v的分子中均存在手性碳原子,且手性碳原子的数量相同 D、化合物v到vi的转化中存在碳原子的杂化方式由sp3到sp2的转变(4)、对化合物ⅲ,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
①
银氨溶液,加热
②
加成反应
(5)、在一定条件下,反应物x和y以原子利用率100%的反应制备乙醛。该反应中:①若x为V形无机物分子,y为直线形有机分子,则y的名称为。
②若x为单质,且x+2y→2CH3CHO,则y的结构简式为。
(6)、以丙醛和甲醇为有机原料,利用合成路线中ⅱ→ⅲ的原理,合成高分子化合物 的单体。基于你设计的合成路线,回答下列问题:
的单体。基于你设计的合成路线,回答下列问题:①利用合成路线中ⅱ→ⅲ的原理,得到的产物的结构简式为。
②若最后一步为酯的生成,则反应的化学方程式为(注明反应条件)。
-
19、甲酸(HCOOH)等羧酸在能源与化工领域中具有重要应用。(1)、将回收的CO2还原为甲酸是CO2资源化利用的途径之一。
已知:
①

②2H2(g)+O2(g)=2H2O(g) ΔH4
则ΔH1=(用含ΔH2、ΔH3和ΔH4的式子表示)。
(2)、甲酸甲酯水解可制取甲酸,反应为HCOOCH3(1)+H2O(l)HCOOH(1)+CH3OH(l)。ΔH>0,一定条件下,HCOOCH3的转化率随时间的变化如图所示(反应前后溶液体积不变)。
①实验i中HCOOCH3的起始浓度为1.0mol·L-1 , 则20~40min内,v(HCOOH)=mol·L-1·min-1。
②下列说法中正确的有。
A.与实验i相比,实验ii改变的条件是升高温度
B.平衡后加水稀释,甲酸的平衡产率增大
C.平衡后加入少量NaOH固体,甲酸甲酯的平衡浓度降低
D.选用合适的催化剂可减小反应的焓变,加快甲酸甲酯的水解速率
(3)、甲酸在催化剂[L-Fe-H]+作用下能发生分解,其反应机理和相对能量变化如图所示。
①基态Fe原子的价层电子排布式为。
②反应机理图中,阴离子X为 , 阳离子Y为。
③上述反应进程中,反应速率较慢的一步为(填“b”、或“d”)。
(4)、羧酸与其盐组成的混合溶液可作为缓冲溶液,能维持溶液酸碱性的稳定。室温下,不同组成的缓冲溶液中,pH随的变化如图所示(R为烃基或氢)。
①R1COOH、HCOOH和R2COOH三种酸中,酸性最强的为。
②=1时,HCOOH与HCOONa的混合溶液的pH=。
③室温下、将同物质的量浓度的VLHCOOH溶液和0.5VLNaOH溶液混合配制缓冲溶液,则缓冲溶液的pH(填“>”、“<”或“=”)3.75,理由为。
-
20、一种从锌冶炼渣(主要含Zn、CuO、ZnFe2O4、PbO2、SiO2和少量Ga2O3、Ga2S3、GeO2、GeS2等)中提取镓(Ga)和储(Ge)的工艺流程如下。

已知:①25℃时,H2C2O4的Ka1=5.6×10-2 , Ka2=1.5×10-4;Ksp(PbC2O4)=4.8×10-10 , Ksp(PbSO4)=1.6×10-8。
②c{[Fe(C2O4)3]3-}对Ga、Ge的萃取率(进入有机层中金属离子的百分数)的影响如下表。
c{[Fe(C2O4)3]3-}
0
0.5
1
4
6
8
Ga的萃取率/%
84.78
81.32
79.41
52.24
44.32
23.16
Ge的萃取率/%
99.96
99.88
99.86
99.68
99.52
99.35
(1)、“低酸浸出”后滤液中含有的金属阳离子主要有。(2)、“酸浸”时,加入H2O2能将Ga和Ge的硫化物转化为对应相同价态的氧化物,氧化物再与草酸反应生成配合物。①Ga2O3被草酸浸出生成[Ga(C2O4)3]3-的离子方程式为。
②加入草酸后,PbSO4(填“能”或“不能”)完全转化为PbC2O4 , 请结合平衡常数K计算说明原因(一般认为K>105时,反应基本能完全进行;K<10-5时,则反应很难进行)。
(3)、加Fe粉“还原”的目的为。(4)、不同浓度的H2SO4和NaOH洗脱剂对Ga和Ge的洗脱率(进入水层中金属离子的百分数)如图所示。由图可知,洗脱剂2应选用(填化学式)。 (5)、砷化镓(GaAs)是一种应用广泛的半导体材料,与GaN、GaP晶体类型相同。
(5)、砷化镓(GaAs)是一种应用广泛的半导体材料,与GaN、GaP晶体类型相同。①已知GaP的熔点为1480℃,则GaAs的熔点(填“低于”、“等于”或“高于”)1480℃。
②GaAs的一种立方晶胞中,As原子仅有两种位置,一种As原子位于晶胞顶点,晶体中与As原子最近且等距的As原子有12个,Ga原子均位于晶胞内,该立方晶胞中含有个Ga原子。
③下列图示不可能是上述②中GaAs晶胞的结构单元的是。
