相关试卷
- 广东省广州市广州中学2025-2026学年九年级上学期九月月考化学试题
- 广东省深圳市多校联考2025-2026学年九年级上学期10月期中化学试题
- 湖南省长沙市开福区青竹湖湘一外国语学校2025-2026学年九年级上学期化学第一次月考试卷
- 湖南省岳阳市岳阳楼区2025-2026学年九年级上学期化学10月月考试卷
- 黑龙江省哈尔滨市2025年化学中考真题试卷
- 河北省石家庄市第四十一中学2025-2026学年九年级上学期10月月考化学试卷
- 青海省西宁市2025年中考化学真题
- 广东省广州外国语学校2025-2026年度九年级上学期9月月考化学试卷
- 四川省自贡市蜀光绿盛实验学校2025-2026学年九年级上学期9月月考化学试题
- 人教版(五四学制)初中化学八年级全一册单元测试-第六单元 碳和碳的氧化物(提升卷)
-
1、、、、、均含同一种元素,它们之间的转化关系如图所示(“→”表示反应可一步实现,“—”表示相连的物质能相互反应,部分物质和反应条件略去)。已知:、是组成元素完全相同的液态物质,很不稳定,能使紫色石蕊溶液变为红色。
 (1)、写出的一种用途 , 物质的名称是。(2)、反应的化学方程式为。(3)、从微观角度解释性质有差异的原因:。
(1)、写出的一种用途 , 物质的名称是。(2)、反应的化学方程式为。(3)、从微观角度解释性质有差异的原因:。 -
2、实验小组利用如下图装置测定空气中氧气的含量。

实验操作:在容积为的集气瓶中加入水,按如图所示组装装置,用下端烧红热的玻璃棒引燃红磷。
(1)、红磷燃烧反应的文字表达式为。(2)、待装置冷却后,测得集气瓶中水的体积为 , 则空气中氧气的含量为(写出计算式即可)。 -
3、请填空。(1)、对量筒内液体读数,开始仰视读数为 , 倒出一部分液体,平视读数为 , 则倒出的液体的体积(填“大于”“小于”“等于”或“无法计算”,下同)。(2)、某同学在实验中需要量取水,现发现该同学俯视读数了,则他所量取的水的体积。
-
4、根据图示,回答问题:
 (1)、硅在北斗导航卫星中有着不可替代的作用,硅原子的质子数是。(2)、请写出A的化学符号。(3)、写出B与C两种元素组成化合物的化学式:。
(1)、硅在北斗导航卫星中有着不可替代的作用,硅原子的质子数是。(2)、请写出A的化学符号。(3)、写出B与C两种元素组成化合物的化学式:。 -
5、水在生活、生产中应用非常广泛。请回答下列问题。
(1)净水时利用活性炭的性除去臭味。
(2)除去水中不溶性杂质的操作是。
(3)生活中可用区分软水和硬水。
-
6、在空气中含量高且化学性质不活泼的气体是;二氧化锰()中锰元素的化合价为。
-
7、A原子与B原子的质量之比为 , 而B原子与作为相对原子质量标准的碳原子质量之比 , 则A原子的相对原子质量A、 B、 C、 D、
-
8、下列关于火灾、灭火与逃生的说法错误的是A、严禁携带易燃、易爆物品乘坐火车 B、遭遇火灾,如果火势较大,立即拨打119电话报警 C、生活中常用水来灭火,其原理是能降低可燃物的着火点 D、从火灾中逃生时,应有序撤离着火区域
-
9、下列实验操作不正确的是A、
 水的蒸发
B、
水的蒸发
B、 闻气体气味
C、
闻气体气味
C、 倾倒液体
D、
倾倒液体
D、 比较火焰各层温度
比较火焰各层温度
-
10、下列说法错误的是A、地球上可利用的淡水资源是有限的 B、二氧化碳是空气污染物 C、生活污水的任意排放会造成水体的污染 D、被污染的空气会严重损害人体健康
-
11、下列叙述与化学无关的是A、“天问一号”飞行轨迹的追踪 B、人类战胜新冠疫情所需药物的研发 C、人类对生态环境和自然资源的综合利用 D、农业上粮食高产所需化肥的生产
-
12、维生素是人体必备的营养物质,维生素D2的化学式为C28H44O,试计算:(1)、维生素D2的相对分子质量。(2)、维生素D2中的碳、氢、氧三种元素的比。(3)、99g维生素D2中含碳元素的质量为(写出计算过程)。
-
13、催化剂可改变反应速率,氯化铁对过氧化氢分解也有催化作用。为比较二氧化锰和氯化铁对过氧化氢分解速率的影响,用下图左装置进行对比实验:启动传感器,注入过氧化氢溶液。氧气体积分数随时间变化情况如下:

分析以上实验,回答下列问题:
(1)、初始时氧气的体积分数不为0,原因是。(2)、反应结束,氧气体积分数达到相同的值,说明。(3)、使过氧化氢分解较快的催化剂是 , 判断依据是。(4)、FeCl3催化H2O2溶液产生氧气,该反应的文字表达式是。(5)、某实验小组设计如图实验对过氧化氢分解继续探究。
下列说法合理的是______(填标号)。
A、对比实验甲和乙,探究H2O2浓度对H2O2分解速率的影响 B、对比实验乙和丁,探究MnO2对H2O2分解速率的影响 C、对比实验甲和丙,探究温度对H2O2分解速率的影响 -
14、实验室制取氧气的相关装置如图所示,回答下列有关氧气的制取和性质等问题。
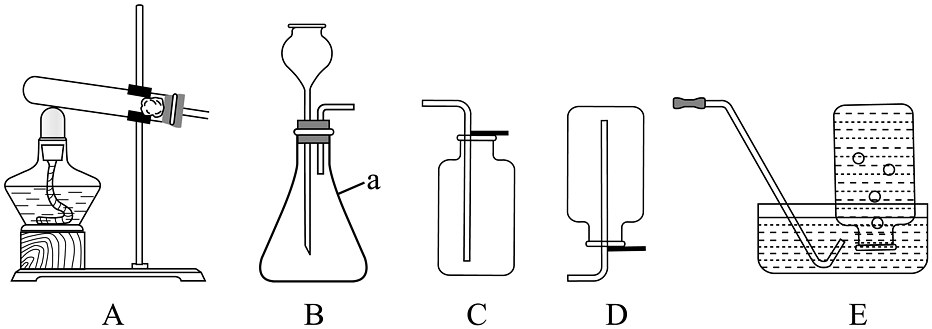 (1)、仪器a的名称是。(2)、实验室用A装置制备氧气,在装入高锰酸钾前应先 , 其反应的文字表达式为。(3)、某气体只能用E装置收集,推测该气体具有的性质可能为______(填标号)。A、能与水反应 B、能与空气反应 C、密度与空气接近(4)、用排水集气法收集氧气,当集气瓶里的水排完后在水里用玻璃片(填“磨砂”或“光滑”)一面盖住集气瓶口,将集气瓶移出水面,(填“正”或“倒")放在桌面上,如果用排水法收集的氧气不纯,可能的原因是(答一点即可)。(5)、将收集的氧气倒入如图所示烧杯中,观察到带火星的木条自下而上依次复燃,说明氧气具有的性质是和 , 写出一个能体现氧气化学性质的反应,其文字表达式为。
(1)、仪器a的名称是。(2)、实验室用A装置制备氧气,在装入高锰酸钾前应先 , 其反应的文字表达式为。(3)、某气体只能用E装置收集,推测该气体具有的性质可能为______(填标号)。A、能与水反应 B、能与空气反应 C、密度与空气接近(4)、用排水集气法收集氧气,当集气瓶里的水排完后在水里用玻璃片(填“磨砂”或“光滑”)一面盖住集气瓶口,将集气瓶移出水面,(填“正”或“倒")放在桌面上,如果用排水法收集的氧气不纯,可能的原因是(答一点即可)。(5)、将收集的氧气倒入如图所示烧杯中,观察到带火星的木条自下而上依次复燃,说明氧气具有的性质是和 , 写出一个能体现氧气化学性质的反应,其文字表达式为。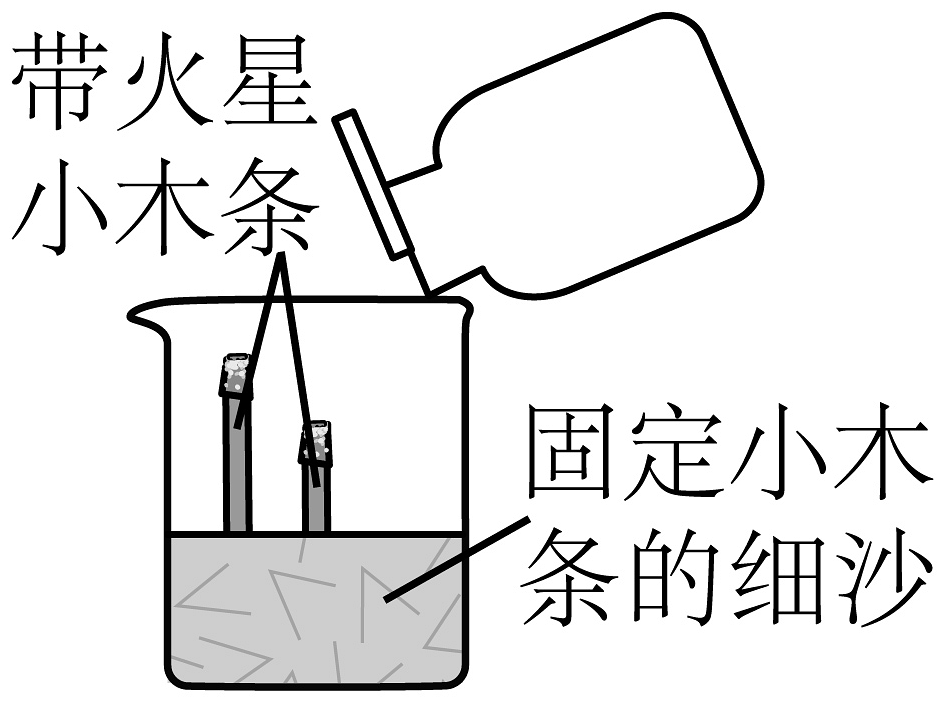
-
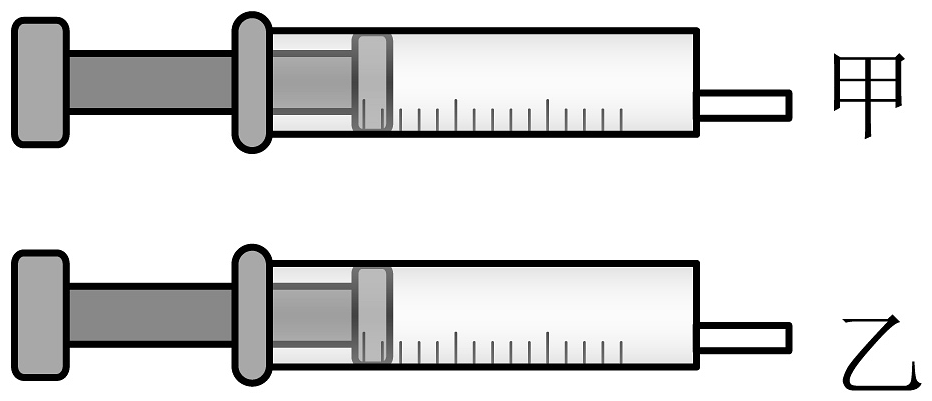
15、为探究分子的基本性质,某同学进行下列探究,请回答下列问题:(1)、如图所示,两支大小相同的医用注射器,分别(填操作),再用手指顶住末端小孔,推入栓塞,观察现象,得到的结论是。
 (2)、探究分子运动性质
(2)、探究分子运动性质【查阅资料】浓氨水具有挥发性,挥发出的氨气极易溶于水,与水反应生成氨水,氨水显碱性可以使无色酚酞试液变红色。

按上图1所示,进行以下操作。
①取一条滤纸,在滤纸条上等距离滴加无色酚酞试液;
②将滴加了无色酚酞试液的滤纸条放入一洁净的试管中,并在试管口塞一团脱脂棉;
③在脱脂棉上滴加几滴浓氨水。
图1所示实验,说明分子是不断运动的,依据的现象是。
(3)、拓展研究。如上图2所示的装置。在A、D两试管中分别加入等量的少许浓氨水,B、C两试管中加入等量的少许无色酚酞溶液,立即用带导管的橡皮塞按图2连接好,并将D试管放置在盛有热水的烧杯中,观察。按照图2所示的装置进行操作,观察到的现象是 , 由该现象得出的结论是。
(4)、小组同学对氨水的制取产生了兴趣,查阅资料后获悉,高温高压、催化剂条件下反应合成氨气的微观示意图如下图所示,据图分析化学变化中没有发生变化的粒子是(填“分子”或“原子”)。用化学式表示该反应的文字表达式中的物质,并注明反应条件和基本反应类型。
氮气( )+氢气(H2)氨气( ), , (填基本反应类型)。
-
16、
某兴趣小组追寻科学家的足迹,对水进行探究。
【水的净化】
(1)自来水厂对水源进行净化的步骤有:①吸附沉淀(用明钒) ②投药消毒 ③静置沉淀 ④过滤等,其合理的顺序是(填序号)。
【水的组成】从物质的“分”、“合”视角认识水的组成
(2)水的合成:在密闭容器中将氢气和氧气的混合气体点燃,容器内有小水珠生成。写出该反应的文字表达式 , 根据实验过程和现象可推测,水是由组成的化合物。
(3)水的分解:如图所示,电解水一段时间后,观察到管a管a和管b中气体体积比为2:1,经检验管b中的气体是(填化学式)。
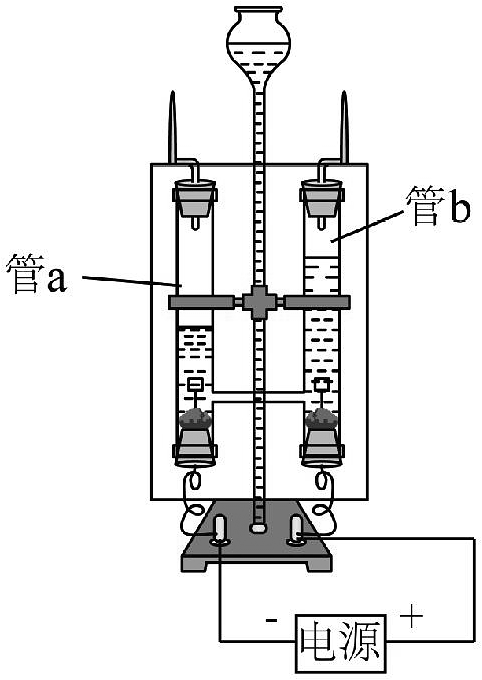
(4)根据实验数据推算水分子中氢、氧原子个数比。
方法一:根据相同条件下气体的体积比等于其分子的个数比,得出电解水的产物中氢、氧原子个数比为 , 进而推算出结果。
方法二:已知电解水实验中氢气和氧气的体积比和正、负极产生气体的 , 可计算出水中各元素质量比,结合氢、氧原子的相对原子质量,可进一步推算出结果。
【思路总结】
(5)以分子构成的物质为例,图中“▲”处的内容是。

-
17、按示例要求用元素符号补充成语。
例、十全十(Mg),雪中送 , 兔赛跑,粗茶饭。
-
18、已知氚属于氢元素的一种原子。下列示意图能表示氚原子的是
 A、
A、 B、
B、 C、
C、 D、
D、
-
19、秋分吃桂花糕。桂花中含甜菜碱(C5H11NO2),下列关于C5H11NO2的说法正确的是A、由三种元素组成 B、是氧化物 C、氢元素的质量分数最小 D、碳、氧原子个数比为2:5
-
20、下图是从海水中获取淡水的简易装置。下列说法错误的是
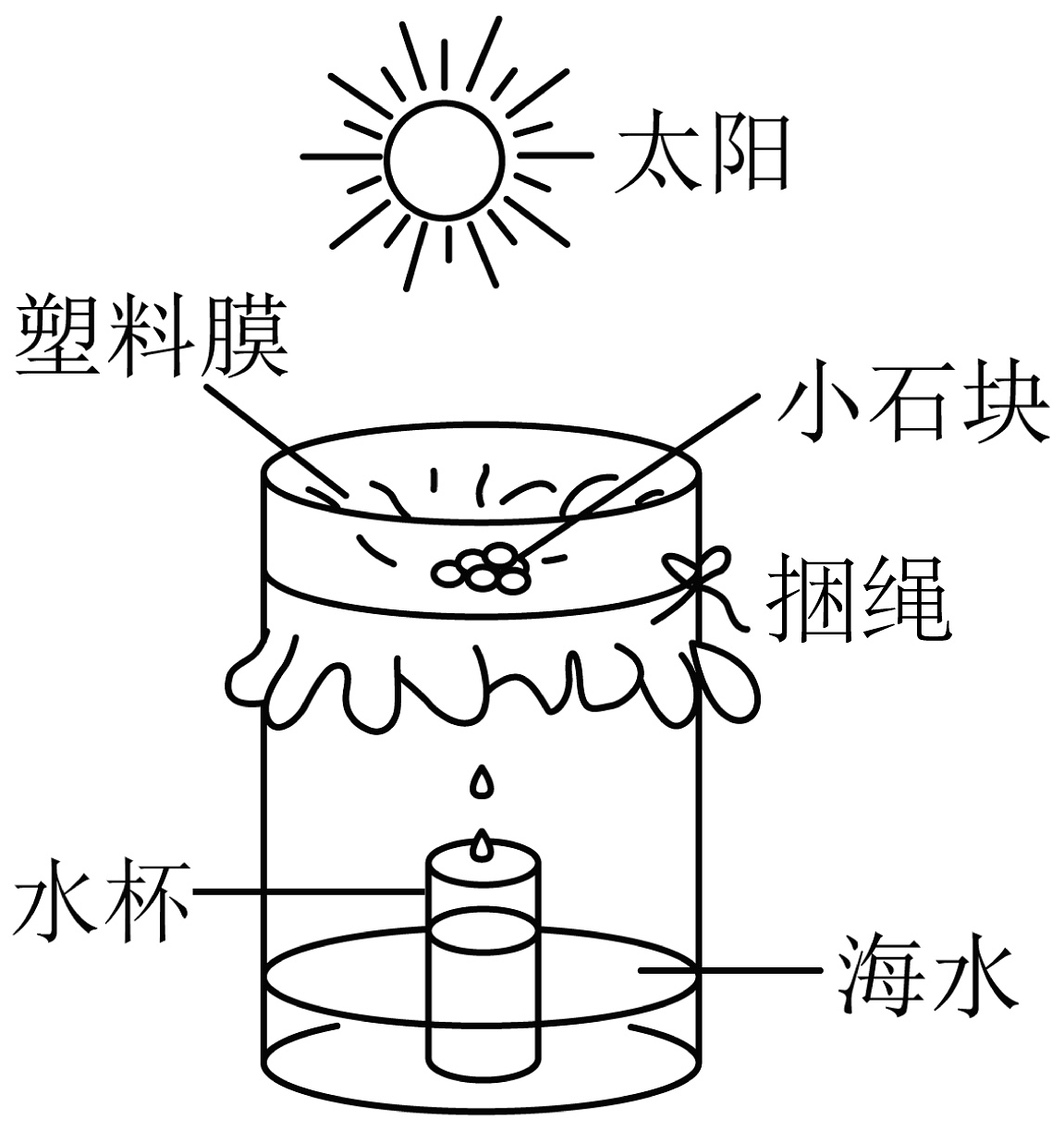 A、水杯中接到的水是混合物 B、该过程中水发生物理变化 C、该过程中用到蒸馏的方法 D、获取淡水的快慢与温度有关
A、水杯中接到的水是混合物 B、该过程中水发生物理变化 C、该过程中用到蒸馏的方法 D、获取淡水的快慢与温度有关