相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、用反萃取原理可从的萃取液中回收 , 流程如图所示。下列说法不正确的是
 A、“反应Ⅰ”的离子方程式为 B、“操作Ⅰ”为分液 C、利用反萃取原理可实现碘单质的重新富集 D、通过升华可将粗碘提纯
A、“反应Ⅰ”的离子方程式为 B、“操作Ⅰ”为分液 C、利用反萃取原理可实现碘单质的重新富集 D、通过升华可将粗碘提纯 -
2、实验室进行制备并验证性质的实验,下列相关原理、装置及操作正确的是
 A、用装置甲制取 B、用装置乙验证漂白性 C、用装置丙收集 D、用装置丁吸收尾气
A、用装置甲制取 B、用装置乙验证漂白性 C、用装置丙收集 D、用装置丁吸收尾气 -
3、硫及其化合物部分转化关系如图所示。下列说法正确的是A、常温下,32gS单质中含1.0molS原子 B、反应①每消耗3.4g , 得到0.4mol电子 C、0.1mol·L-1溶液中,为0.1mol·L-1 D、标准状况下,11.2L中原子总数约为
-
4、阅读下列材料,完成下面小题:
周期表中ⅣA族元素及其化合物应用广泛。石墨烯、碳纳米管、富勒烯等单质是常见的碳纳米材料;能与氢氟酸(HF,弱酸)反应生成(在水中完全电离为和);将硫化锗()与共热制得锗;还原性比还原性强;与浓盐酸反应生成。
(1)、石墨烯结构如图所示。下列有关说法正确的是 A、石墨烯纳米材料属于胶体 B、石墨烯是一种新型化合物 C、石墨烯能导电,石墨烯属于电解质 D、从石墨剥离出石墨烯需克服分子间作用力(2)、碳及其化合物的多样性是构成物质多样性的重要原因。下列说法中正确的是A、乙醇和二甲醚互为同位素 B、富勒烯、金刚石化学性质相似 C、碳纳米管、石墨烯互为同分异构体 D、12C、13C、14C三种核素互为同素异形体(3)、下列化学反应表示正确的是A、与HF溶液反应: B、高温下还原硫化锗: C、强酸溶液中,与反应: D、与浓盐酸反应:(浓)
A、石墨烯纳米材料属于胶体 B、石墨烯是一种新型化合物 C、石墨烯能导电,石墨烯属于电解质 D、从石墨剥离出石墨烯需克服分子间作用力(2)、碳及其化合物的多样性是构成物质多样性的重要原因。下列说法中正确的是A、乙醇和二甲醚互为同位素 B、富勒烯、金刚石化学性质相似 C、碳纳米管、石墨烯互为同分异构体 D、12C、13C、14C三种核素互为同素异形体(3)、下列化学反应表示正确的是A、与HF溶液反应: B、高温下还原硫化锗: C、强酸溶液中,与反应: D、与浓盐酸反应:(浓) -
5、氯及其化合物的转化具有重要应用。下列说法正确的是A、制漂白粉:NaCl溶液漂白粉 B、HCl制备:NaCl溶液和 C、纯碱工业:NaCl溶液 D、金属Mg制备:溶液
-
6、化学创造美好生活。下列有关物质的性质与用途具有对应关系的是A、浓硫酸具有吸水性,可用作干燥剂 B、次氯酸具有弱酸性,可用于杀菌消毒 C、钠具有强还原性,可用于制作高压钠灯 D、受热易分解,可治疗胃酸过多
-
7、反应可作呼吸面具的供氧剂。下列说法正确的是A、的结构示意图为
 B、空间填充模型为
B、空间填充模型为 C、仅含离子键
D、中子数为10的氧原子可表示为
C、仅含离子键
D、中子数为10的氧原子可表示为
-
8、2024年12月26日,我国第六代战机首飞成功。战机中常使用高强度、耐高温的钛合金材料,钛合金材料属于A、分子晶体 B、离子晶体 C、金属晶体 D、共价晶体
-
9、工业尾气中的氮氧化物是大气主要污染源之一、消除氮氧化物对环境保护有着重要意义。(1)、SNCRSCR脱硝技术是一种新型除去烟气(含NOx和O2等)中氮氧化物的方法,以NH3作还原剂,其脱硝流程如图1,其中SNCR脱硝效率与体系温度关系如图2所示。
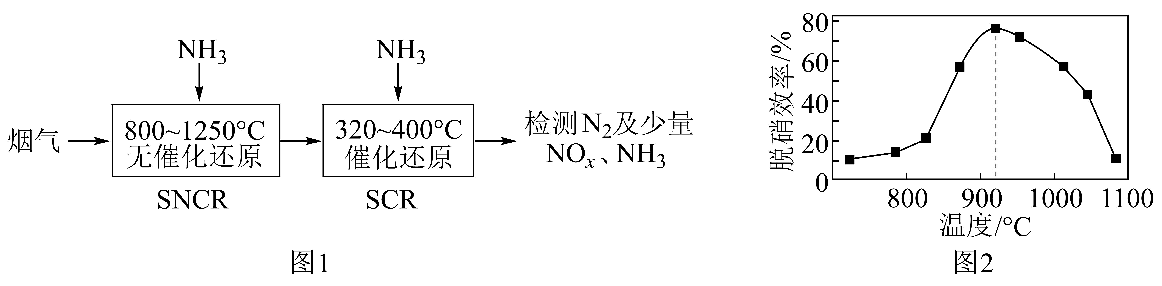
①当体系温度高于950℃时,SNCR脱硝效率明显降低,其可能的原因是;
②SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是。
(2)、氢气选择性催化还原(H2-SCR)是一种理想的方法。其相关反应如下:主反应:2NO(g)+2H2(g)=N2(g)+2H2O(g) ΔH1
副反应:2NO(g)+H2(g)=N2O(g)+H2O(g) ΔH2<0
①已知:2H2(g)+O2(g)=2H2O(g) ΔH3=-483.5 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH4=+180.5 kJ·mol-1
ΔH1=。
②一定温度下用H2还原NO,测得反应后尾气中NO、N2O、N2的体积分数随H2的体积分数的变化如图3所示。当H2的体积分数大于750×10-6时,N2的体积分数下降的原因是。

③在Pt表面H2、O2和NO会解离成H、O、N,其中H与O生成H2O,而Pt表面的N会与邻位的N反应生成N2 , 与NO反应生成N2O,与邻位的H反应生成NH3 , 过程如图4所示。当Pt的载体酸性增强时,会产生更多的N2 , 原因是。

-
10、银及其化合物在催化与电化学等领域中具有重要应用。(1)、一定条件下,在银催化剂表面存在反应: , 该反应平衡时体系的压强(Pc)与温度(T)的关系如表:
T/K
401
443
463
Pc/kPa
10
51
100
已知:在平衡体系中,用气体物质的分压替换浓度计算得到的平衡常数称为压强平衡常数,用Kp表示。气体物质X的分压。
①401K时,该反应的压强平衡常数Kp=kPa。
②起始状态Ⅰ中有Ag2O、Ag和O2 , 经下列过程达到各平衡状态:

已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是(填序号)。
A.从状态Ⅰ到状态Ⅱ的过程,△S<0 B.体系压强:
C.平衡常数: D.若体积 , 则
请补全图中的v逆-t图像。

图1
③某温度下,向恒容容器中加入Ag2O,分解过程中反应速率v(O2)与压强p的关系为 , k为速率常数(一定温度下,k为常数)。当固体质量减少4%时,逆反应速率最大。当转化率为14.5%时,v(O2)(用k表示)。
(2)、固体离子导体α-AgI可通过加热γ-AgI制得。上述两种晶体的晶胞如图所示(省略了Ag+在晶胞中的位置)。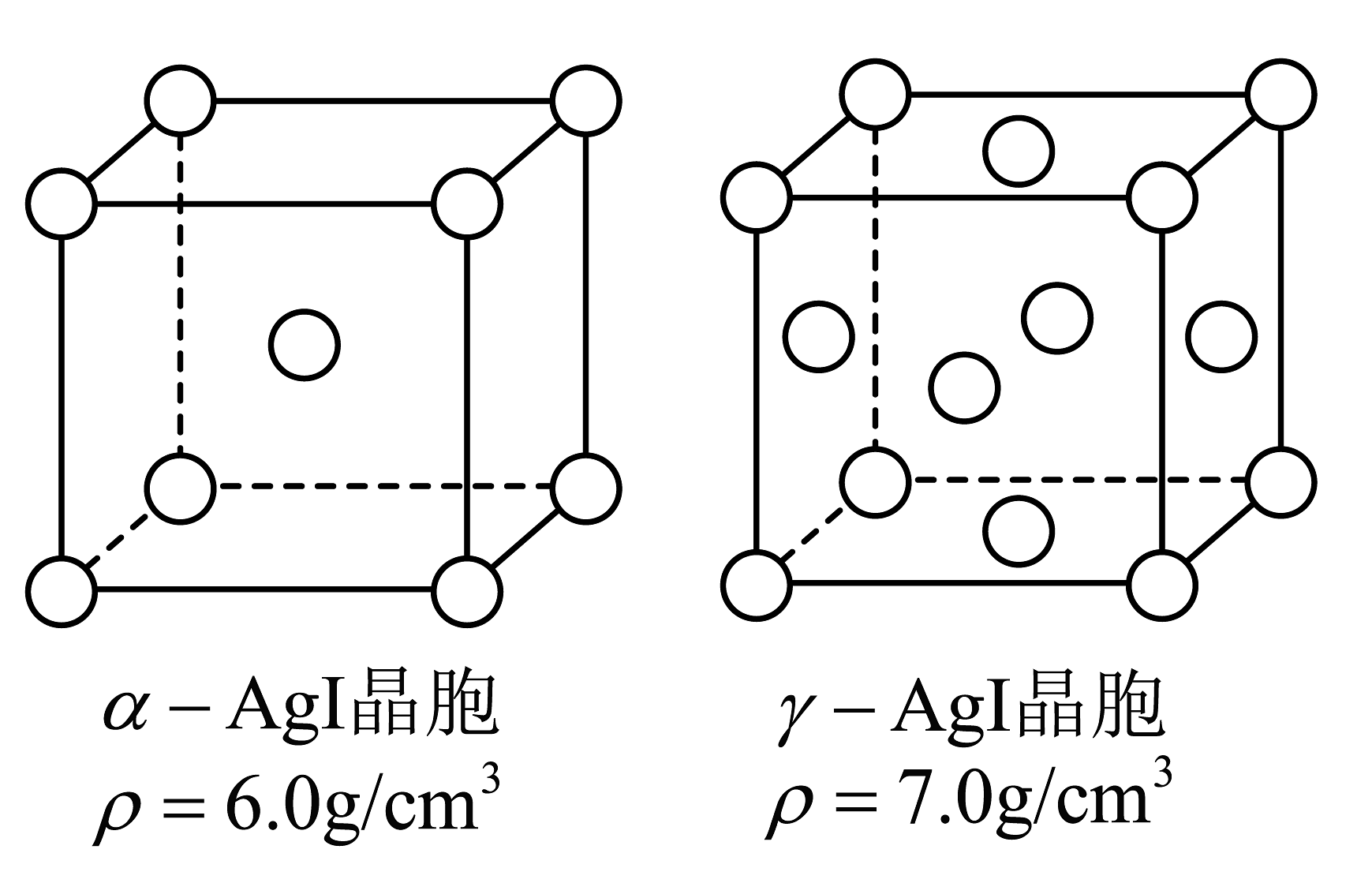
①测定晶体结构最常用的仪器是。
②α-AgI与γ-AgI晶胞的体积之比为。
③判定α-AgI中导电离子类型的实验装置如图所示。实验前,H型管内填充满a-AgI,竖管a和b(含a-AgI)的质量相同,两支Ag电极的质量也相同。通电一段时间后,可判定导电离子是Ag+而不是I-的实验数据是。

-
11、有机物G(药名selecal)能有效治疗心绞痛,一种合成G的路线如下:
 (1)、X的化学式为 , 其分子中采取杂化方式的原子数目是。(2)、C→D的转化中还生成另外一种有机产物,其结构简式为。(3)、F→G的反应会生成一种与G互为同分异构体的副产物,该副产物的结构简式为。(4)、D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:(写出一种即可)。
(1)、X的化学式为 , 其分子中采取杂化方式的原子数目是。(2)、C→D的转化中还生成另外一种有机产物,其结构简式为。(3)、F→G的反应会生成一种与G互为同分异构体的副产物,该副产物的结构简式为。(4)、D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:(写出一种即可)。①能发生银镜反应,不能与发生显色反应;
②酸性条件下水解产物之一能与发生显色反应;③分子中有3种不同化学环境的氢。
(5)、已知: (易被氧化)。设计以
(易被氧化)。设计以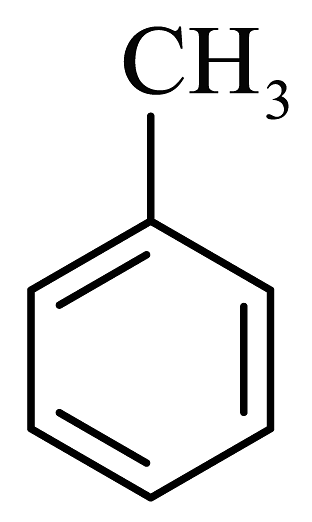 、
、 为原料制取
为原料制取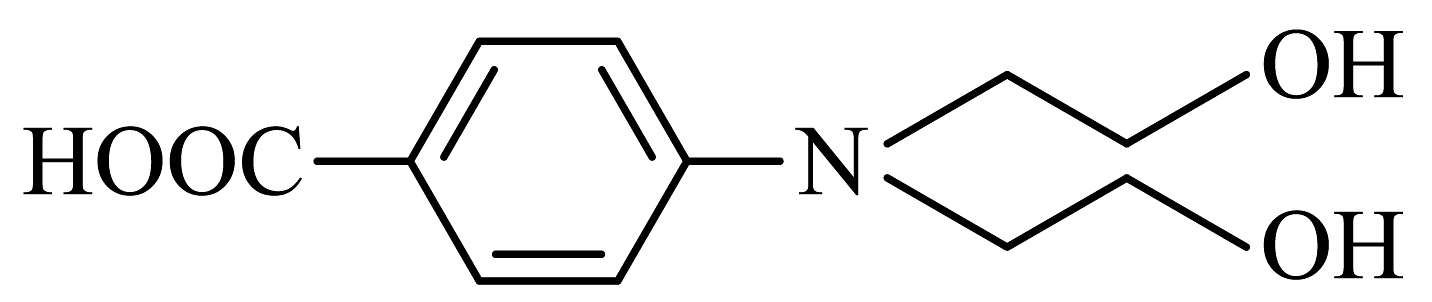 的合成路线流程图(无机试剂及有机溶剂任选,合成示例见本题题于)。
的合成路线流程图(无机试剂及有机溶剂任选,合成示例见本题题于)。 -
12、实验室以碳酸铈[]为原料制备氧化铈()粉末,部分实验过程如下:
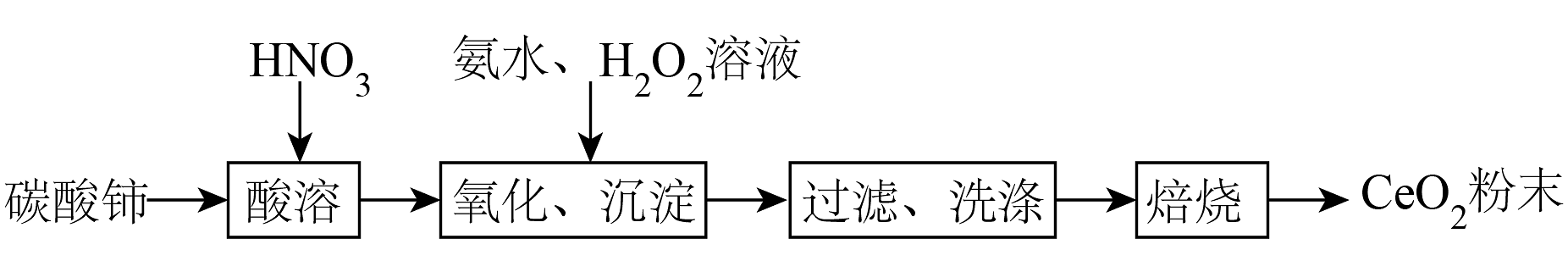
已知:难溶于稀硝酸;极易水解,酸性较强时有强氧化性。
(1)、“氧化、沉淀”过程①向酸溶后的溶液中加入氨水和溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[]。反应生成过氧化铈的离子方程式为。
②双氧水与氨水的加入量之比对氧化率的影响如图所示,与物质的量之比大于1.20时,氧化率下降的原因是。
 (2)、“过滤、洗涤”过程
(2)、“过滤、洗涤”过程①“过滤”需用到的玻璃仪器有烧杯、漏斗和。
②“洗涤”的实验操作是。
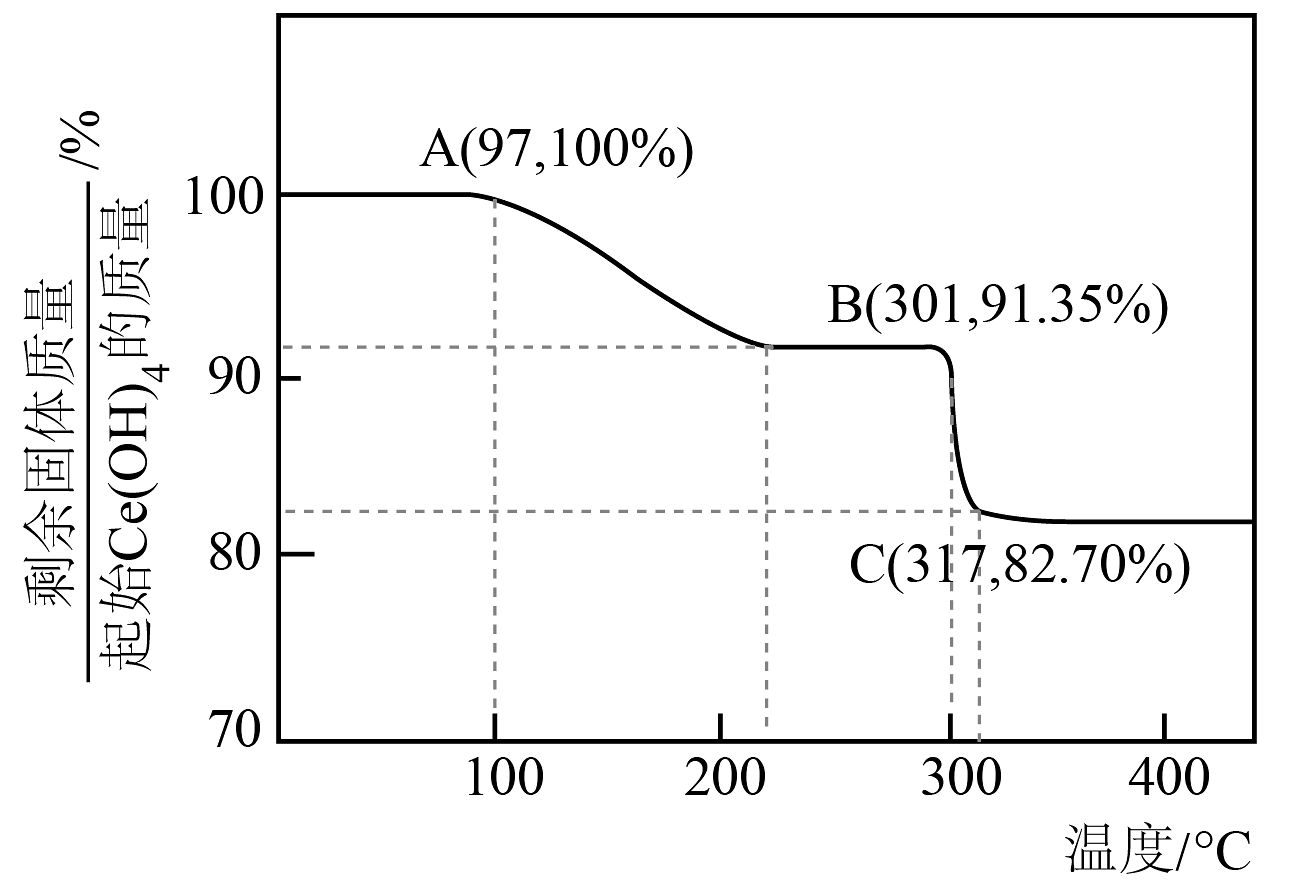
(3)、“焙烧”过程焙烧过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为(写出确定物质化学式的计算过程)。
 (4)、由稀土碳酸盐获取
(4)、由稀土碳酸盐获取以稀土碳酸盐样品[含有、和可溶性]为原料可获得纯净的请补充实验方案:向稀土碳酸盐样品中 , 烘干,得到固体。[已知:不与反应;、开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1氨水、30%溶液、2溶液、2mol·L-1HCl溶液、1mol·L-1溶液、去离子水]
-
13、可协同催化的氢化,体系中涉及以下两个反应:
反应1:
反应2:
将一定比例的、以一定流速通过催化剂,在一定温度下反应,的转化率、或CO的选择性[]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
 A、反应 B、曲线Y表示的转化率随催化剂中NiO的质量分数的变化 C、其他条件不变,催化剂中NiO的质量分数为1%时,的产率最高 D、其他条件不变,NiO的质量分数从25%增加到50%,的平衡选择性降低
A、反应 B、曲线Y表示的转化率随催化剂中NiO的质量分数的变化 C、其他条件不变,催化剂中NiO的质量分数为1%时,的产率最高 D、其他条件不变,NiO的质量分数从25%增加到50%,的平衡选择性降低 -
14、室温下:、、、。本小组同学进行如下实验:
实验
实验操作和现象
1
测定溶液的
2
向溶液中通入少量
3
向20mL溶液中逐滴加入等浓度NaOH溶液10mL
4
配制的、、三种溶液
下列所得结论正确的是
A、实验1溶液中存在: B、实验2反应的离子方程式: C、实验3反应后的溶液中存在: D、实验4中各溶液pH大小: -
15、探究0.1 mol/LCuSO4溶液的性质,下列实验方案不能达到探究目的是
选项
探究目的
实验方案
A
Cu2+是否水解
测定0.1 mol/LCuSO4溶液的pH值
B
Cu2+能否催化H2O2分解
向2 mL1.5%的H2O2溶液中滴加5滴0.1 mol/LCuSO4溶液,观察气泡产生情况
C
Cu2+是否具有氧化性
向2 mL0.1 mol/LCuSO4溶液中通入一定量的HI气体,观察实验现象
D
Cu2+能否形成配位键
向2 mL0.1 mol/LCuSO4溶液中,边振荡边滴加过量浓氨水,观察实验现象
A、A B、B C、C D、D -
16、生物体内以L—酪氨酸为原料可合成多巴胺,其合成路线如下。
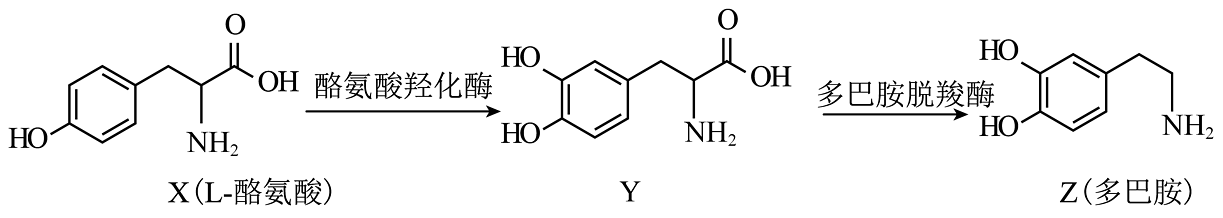
下列说法正确的是
A、X中含有酰胺基和羟基 B、X与足量加成后的产物中含有1个手性碳原子 C、1molZ最多能与发生反应 D、X、Y、Z可用溶液进行鉴别 -
17、一种浓差电池的放电原理是利用电解质溶液的浓度不同而产生电流。某浓差电池装置示意图如图所示,该电池使用前将开关K先与a连接一段时间后再与b连接。下列说法不正确的是
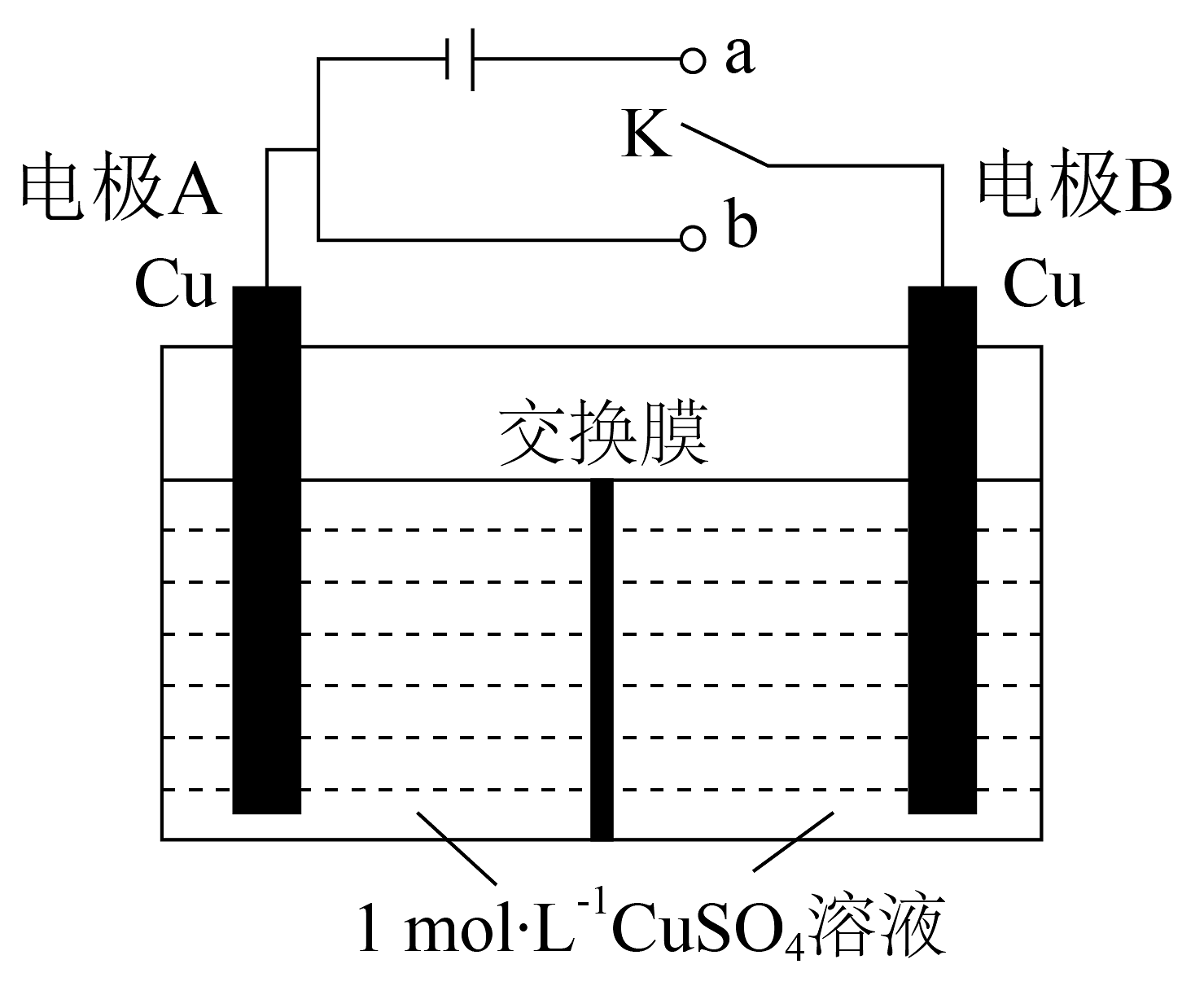 A、交换膜应当选择阳离子交换膜 B、K与a连接的目的是形成两电极区溶液的浓度差 C、K与b连接时,电极B上发生的反应为Cu2++2e-=Cu D、K与b连接时,导线中通过2mol电子,约有1mol离子通过交换膜
A、交换膜应当选择阳离子交换膜 B、K与a连接的目的是形成两电极区溶液的浓度差 C、K与b连接时,电极B上发生的反应为Cu2++2e-=Cu D、K与b连接时,导线中通过2mol电子,约有1mol离子通过交换膜 -
18、元素及其化合物的转化在工业生产中具有极其重要的用途。下列物质间转化能实现的是A、工业制取漂白粉:饱和食盐水漂白粉 B、工业制取镁:溶液无水Mg C、工业制取硫酸: D、工业制取纯碱:饱和食盐水固体固体
-
19、ⅤA族元素及其化合物应用广泛。 催化氧化生成继续被氧化为 , 将通入水中制取。工业上用白磷与反应生成和一种盐,该盐可与反应制备一元弱酸。雌黄和在盐酸中反应转化为雄黄和(沸点)并放出气体。砷化镓是第三代半导体材料,熔点高,硬度大。请回答下列小题。(1)、氨硼烷是最具潜力的储氢材料之一,与乙烷的相对分子质量相近,但沸点却比乙烷高得多。下列说法不正确的是A、分子内存在配位键 B、是由极性键构成的极性分子 C、中含有共价键 D、固态和砷化镓晶体都是分子晶体(2)、下列化学反应表示不正确的是A、制的离子方程式: B、白磷与溶液反应: C、与足量的溶液反应的离子方程式: D、雌黄制备雄黄的方程式:(3)、下列氮及其化合物的性质与用途具有对应关系的是A、难溶于水,可用作瓜果保护气 B、具有还原性,可用作制冷剂 C、具有强氧化性,可用于制硝酸铵 D、溶液呈酸性,可用于除铁锈
-
20、氨是重要的化工原料,能与结合生成 , 加热条件下NH3能将CuO还原成Cu,实验室制取少量NH3并探究其性质。下列装置不能达到实验目的的是
 A、用装置甲制取NH3 B、用装置乙干燥NH3 C、用装置丙检验NH3水溶液呈碱性 D、用装置丁探究的NH3还原性
A、用装置甲制取NH3 B、用装置乙干燥NH3 C、用装置丙检验NH3水溶液呈碱性 D、用装置丁探究的NH3还原性