相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、下列实验操作对应的现象及结论均正确的是
实验操作
现象
结论
A
分别向盛有和的试管中滴加浓盐酸
盛的试管中产生黄绿色气体
氧化性:
B
用标准溶液滴定未知浓度的溶液,用甲基橙作指示剂
终点的颜色变化为橙色到黄色
反应终点在指示剂变色范围内,误差较小
C
量取同体积不同浓度的溶液,分别加入等体积等浓度的溶液
浓度大的溶液产生气泡速度快
反应物浓度越大,化学反应速率越快
D
用玻璃棒摩擦装有明矾过饱和溶液的烧杯内壁
快速析出晶体
烧杯内壁产生微小的玻璃微晶来充当晶核
A、A B、B C、C D、D -
2、逆水煤气变换体系中存在以下两个反应:
反应I:
反应II:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法错误的是
 A、反应I的 , 反应II的 B、M点反应I的平衡常数 C、点的压强是的3倍 D、若按投料,则曲线之间交点位置不变
A、反应I的 , 反应II的 B、M点反应I的平衡常数 C、点的压强是的3倍 D、若按投料,则曲线之间交点位置不变 -
3、是一种用途广泛的磁性材料,以为原料制备并获得副产物水合物的工艺如下。

25℃时各物质溶度积见下表:
物质
溶度积
下列说法错误的是
A、反应釜1中的反应需在隔绝空气条件下进行 B、反应釜2中反应的离子方程式为 C、反应釜3中,25℃时,浓度为 , 理论上不超过10 D、获得水合物的操作为:蒸发浓缩、冷却结晶 -
4、一种可用于海水淡化的新型网状高分子材料,其制备原理如图(反应方程式未配平)。

下列说法正确的是
A、中碳原子均为杂化 B、的重复结构单元中, C、该反应属于加聚反应 D、完全水解消耗 -
5、化合物和所含元素相同,相对分子质量相差7,含电子, , 和三种元素位于同周期,原子最外层电子数是原子核外电子数的一半。下列说法正确的是A、同周期第一电离能比大的元素有3种 B、电负性顺序: C、常温常压下和的单质均为固体 D、和互为同素异形体
-
6、有机化合物与在的催化作用下可反应生成 , 其反应如图:

下列说法正确的是
A、分子中最多有15个碳原子共面 B、与同类别的同分异构体还有2种 C、该反应的副产物为和 D、分子中键角大小: -
7、纤维素可以多条单链的形式存在,在低温下溶于溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,可使纤维素绿色再生利用。下列说法错误的是
 A、纤维素难溶于水的主要原因是其链间有多个氢键 B、提供破坏纤维素链之间的氢键,引发溶胀 C、加入尿素形成动态“包覆层”,防止链间重新结合 D、低温时纤维素分子链间的相互作用力增强,更易被溶解
A、纤维素难溶于水的主要原因是其链间有多个氢键 B、提供破坏纤维素链之间的氢键,引发溶胀 C、加入尿素形成动态“包覆层”,防止链间重新结合 D、低温时纤维素分子链间的相互作用力增强,更易被溶解 -
8、下列玻璃仪器(含活塞)在相应实验中选用不合理的是
 A、重结晶法提纯乙酰苯胺(
A、重结晶法提纯乙酰苯胺( ):⑥⑦⑧
B、蒸馏法分离苯(沸点80.1℃)和甲苯(沸点111℃):①③⑤⑨
C、用标准液滴定测量溶液中的含量:③④
D、用作萃取剂,萃取溴水中的溴:②⑥
):⑥⑦⑧
B、蒸馏法分离苯(沸点80.1℃)和甲苯(沸点111℃):①③⑤⑨
C、用标准液滴定测量溶液中的含量:③④
D、用作萃取剂,萃取溴水中的溴:②⑥
-
9、下列化学用语或图示错误的是A、用电子式表示的形成:
 B、用亚铜氨溶液除去合成氨原料气中的:
C、用电子云轮廓图示意键的形成:
B、用亚铜氨溶液除去合成氨原料气中的:
C、用电子云轮廓图示意键的形成: D、用对苯二甲酸与对苯二胺制备芳纶纤维:
D、用对苯二甲酸与对苯二胺制备芳纶纤维: +
+

-
10、关于物质的分离、提纯,下列说法错误的是A、蒸馏法分离乙醇和乙醛 B、重结晶法提纯含有少量食盐的苯甲酸 C、过滤法分离2,4,6-三溴苯酚和乙醚 D、萃取和柱色谱法从青蒿中提取分离青蒿素
-
11、齐鲁大地人杰地灵,辛弃疾和李清照是宋朝词人的杰出代表,下列诗句所涉及的化学知识错误的是A、“稻花香里说丰年,听取蛙声一片”,稻花香气的主要成分是无机化合物 B、“东风夜放花千树,更吹落星如雨”,烟花燃烧涉及氧化还原反应 C、“三杯两盏淡酒,怎敌他晚来风急”,酒的制作过程涉及糖类的水解 D、“轻解罗裳,独上兰舟”,在古代,罗裳的主要成分是蛋白质
-
12、某抗凝血作用的药物Z可用下列反应合成。下列说法正确的是
 A、X与NaHCO3溶液反应可以生成
A、X与NaHCO3溶液反应可以生成 B、1molY与NaOH溶液反应,最多消耗2molNaOH
C、Z中所有碳原子可能共平面
D、X、Y、Z均易溶于水
B、1molY与NaOH溶液反应,最多消耗2molNaOH
C、Z中所有碳原子可能共平面
D、X、Y、Z均易溶于水
-
13、连二亚硝酸(HON=NOH)是一种还原剂,可由反应HNO2+H2NOH→HON=NOH+H2O制备。下列说法正确的是A、中子数为8的氮原子:N B、H2NOH分子含极性键和非极性键 C、H2O的电子式为
 D、HON=NOH中N元素的化合价为+1
D、HON=NOH中N元素的化合价为+1
-
14、甲烷和水蒸气催化重整制氢过程中的主要反应为
①
②
在装有催化剂的密闭容器中,、时,若仅考虑上述反应,平衡时转化率和CO转换率随温度的变化如图所示。
CO转换率

下列说法正确的是
A、反应的焓变 B、曲线a表示平衡时转化率随温度的变化 C、850℃平衡时生成的比550℃平衡时生成的多 D、相同条件下,和总物质的量不变,越大,产量越高 -
15、、在环境保护中用途广泛。碱性条件下稳定存在。
 (1)、可用于氧化去除高氯(含高浓度)废水中的有机物。
(1)、可用于氧化去除高氯(含高浓度)废水中的有机物。①酸性条件下,在水中产生氢氧化铁沉淀,该反应的离子方程式为。
②酸性溶液中的氧化性大于的氧化性。处理高氯废水中的有机物在酸性条件下有机物去除率较低,其主要原因是。
(2)、高铁酸钠()也可用于氨氮处理。的氧化性受溶液中的H+浓度影响较大。如图所示。①碱性条件下,可将水中的转化为除去,该反应的化学方程式为。
②用氧化含氨氮废水,其他条件相同时,废水pH对氨氮去除率及氧化时间影响如图所示。当pH小于9时,随着pH的增大,氧化所需时间明显增长原因是。
(3)、水中的+6价铬元素对水质严重的损害作用,使用可进行无害化处理。即转化为产品磁性铁铬氧体()沉降。方法是先向含的污水中加入适量的硫酸及溶液,待充分反应后再通入适量空气(氧化部分)并加入NaOH溶液,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出在酸性条件下被还原为的离子方程式。
②若处理含0.5mol(不考虑其他含铬微粒)污水时恰好消耗760g , 并消耗0.125mol氧气。则加入NaOH溶液后最终得到的磁性铁铬氧体的化学式为(x、y、z取正整数)。
-
16、下列为某有机物的合成路线。
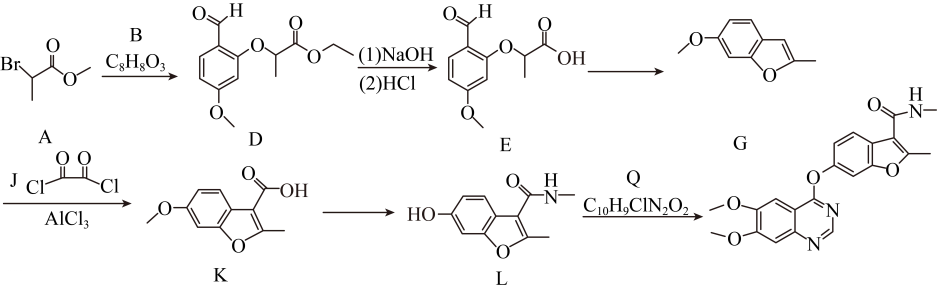 (1)、A 中含氧官能团名称 为 , A到D的反应灾害为。(2)、B的结构简式为。(3)、D到E的反应产物,除E外,另一产物的结构简式为。(4)、下列说法正确的是( )____。A、G中存在大键 B、K中碳原子来自于J C、L中存在氢键 D、(5)、G的同分异构体中,满足下列条件的有种。
(1)、A 中含氧官能团名称 为 , A到D的反应灾害为。(2)、B的结构简式为。(3)、D到E的反应产物,除E外,另一产物的结构简式为。(4)、下列说法正确的是( )____。A、G中存在大键 B、K中碳原子来自于J C、L中存在氢键 D、(5)、G的同分异构体中,满足下列条件的有种。①:存在
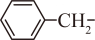 和2个环外键
和2个环外键②:不含与sp杂化的碳原子
写出其中核磁共振氧谱峰面积比为()的结构简式。
(6)、有机物Q的合成路线如下: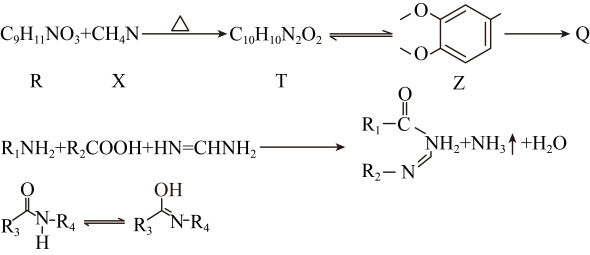
根据已知信息,由R和X生成T的化学方程式为。
-
17、水是重要的生活资源,根据题意回答下列问题。(1)、天然水中提纯得到重水,重水中存在电离平衡 , 其图像如图,回答下列问题:
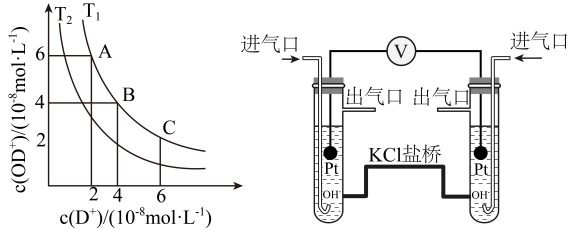
①“A、B、C”三点中呈中性的是。
②(填写“>”“<”或者“=”)
(2)、有如右图所示原电池,回答下列问题:①用进行实验,左侧通入 , 产物为 , 盐桥中移向(填“左侧”或者“右侧”),总反应方程式为。
②用进行实验,一侧通入 , 电池总反应方程式不变,该侧的电极反应方程式为。
(3)、利用驰豫法可研究快捷反应的速率常数(k在一定温度下为常数),其原理是通过微扰(如瞬时升温)使化学平衡发生偏离,观测体系微扰后从不平衡态趋向新平衡态所需的驰豫时间 , 从而获得k的信息对于若将纯水瞬时升温到25℃,测得。已知:25℃时, , , , (为的平衡浓度)。
①25℃时, , 的平衡常数(保留2位有效数字)。
②下列能正确表示瞬时升温后反应建立新平衡的过程示意图为。
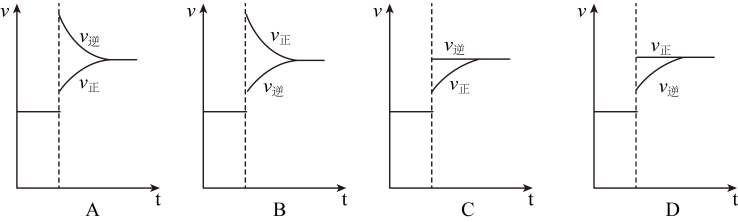
③25℃时,计算得为
-
18、糖精钠是一款易溶于水的甜味剂,其甜度是蔗糖的300倍。糖精钠的制备流程包含磺化、胺化、氧化以及结晶等过程。
Ⅰ.磺化过程及实验装置如图:
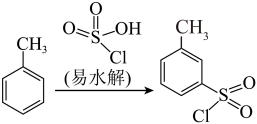
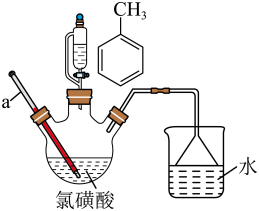 (1)、仪器a的名称为:水吸收的尾气是(填化学式)(2)、Ⅱ.胺化过程:
(1)、仪器a的名称为:水吸收的尾气是(填化学式)(2)、Ⅱ.胺化过程: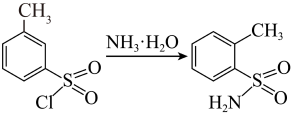
0.3mol邻甲基磺酸氯中加入15mol/L的氨水,充分反应后,消耗的的体积为mL。
(3)、Ⅲ.氧化: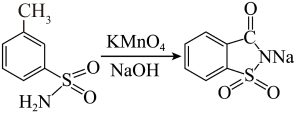
氧化过程中为保证氧化完全,需要加入过量的 , 反应完全后,向其中滴加以除去过量溶液,反应完全的现象是。涉及到的离子方程式为。
(4)、Ⅳ.结晶: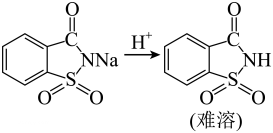
过滤需要用到下列哪些仪器。
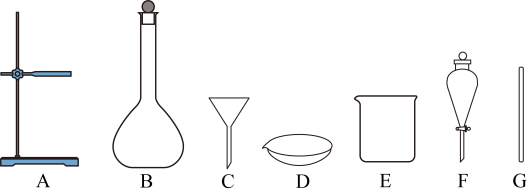 (5)、与反应,产生大量的气体,该气体是。当完全反应,趁热过滤,冷却结晶的后续操作是。
(5)、与反应,产生大量的气体,该气体是。当完全反应,趁热过滤,冷却结晶的后续操作是。
-
19、工业上利用如下流程将粗硒进行精制,结合流程,回答下列问题
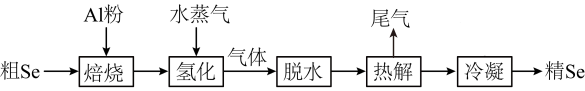 (1)、Ⅰ.焙烧产物为 , 其中Se的化合价为 , 铝的基态电子排布式为。(2)、“氢化”过程涉及到的化学方程式为。(3)、已知热解方程式为: , 回答下列问题:热解后,温度迅速从1000K降至500K,对于Se蒸汽而言,从气态变为固态的过程为。热解后迅速降温的目的。尾气的成分为(填化学式)。(4)、Ⅱ.取0.1g样品,加入 , 生成 , 向其中加入0.1mol/L的和少量的淀粉KI溶液,用去40.00mL的溶液,反应完成后,再加: (),至蓝色消失,通过反应②Se(IV)与反应的物质的量之比为。
(1)、Ⅰ.焙烧产物为 , 其中Se的化合价为 , 铝的基态电子排布式为。(2)、“氢化”过程涉及到的化学方程式为。(3)、已知热解方程式为: , 回答下列问题:热解后,温度迅速从1000K降至500K,对于Se蒸汽而言,从气态变为固态的过程为。热解后迅速降温的目的。尾气的成分为(填化学式)。(4)、Ⅱ.取0.1g样品,加入 , 生成 , 向其中加入0.1mol/L的和少量的淀粉KI溶液,用去40.00mL的溶液,反应完成后,再加: (),至蓝色消失,通过反应②Se(IV)与反应的物质的量之比为。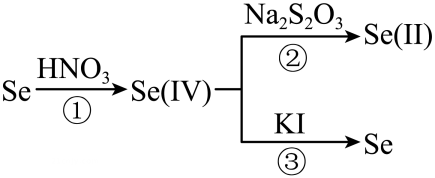
反应③的离子方程式为。
(5)、样品中Se的含量。 -
20、已知为两性氢氧化物,在不同pH条件下,与的总和为c,现有如下图:下列说法正确的是( )
 A、由M点可以计算 B、恰好完全沉淀的 C、P点溶液质量小于Q点溶液质量 D、随着pH的增大溶液中比值先增大后减小
A、由M点可以计算 B、恰好完全沉淀的 C、P点溶液质量小于Q点溶液质量 D、随着pH的增大溶液中比值先增大后减小