山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
试卷更新日期:2017-10-13 类型:期中考试
一、选择题
-
1. 下列说法或表示方法正确的是( )A、等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量一样多 B、需要加热才能发生的反应一定是吸热反应 C、在101kpa时,2gH2完全燃烧,生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8kJ/mol D、在强酸强碱稀溶液中:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ2. N2H4是一种重要的火箭燃料,能在空气中燃烧生成氮气和水,放出大量的热.室温时,已知各共价键的键能如下表,通过计算N2H4的燃烧热是( )
键
N﹣H
N﹣N
O=O
N≡N
H﹣O
键能/kJ•mol﹣1
391
193
497
946
463
A、1088 kJ•mol﹣1 B、544 kJ•mol﹣1 C、790 kJ•mol﹣1 D、382 kJ•mol﹣13. 已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ/molNa2O2(s)+CO2(g)═Na2CO3(s)+O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A、CO的燃烧热为283kJ B、25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等 C、2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<﹣452 kJ/mol D、CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×10234. 对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )A、达到化学平衡时,4υ正(O2)=5υ逆(NO) B、若单位时间内生成x mol NO的同时,消耗x mol NH3 , 则反应达到平衡状态 C、达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 D、化学反应速率关系是:2υ正(NH3)=3υ正(H2O)5. 在密闭容中发生下列反应aA(g)⇌cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )A、A的转化率变大 B、平衡向正反应方向移动 C、D的体积分数变大 D、a<c+d6. 可逆反应2A(g)+B(g) 2C(g),根据下表中的数据判断下列图象错误的是( )
p1(Mpa)
p2(Mpa)
400℃
99.6
99.7
500℃
96.9
97.8
A、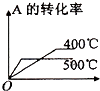 B、
B、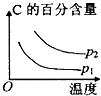 C、
C、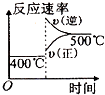 D、
D、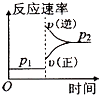 7. 下列能用勒夏特列原理解释的是( )A、高温及加入催化剂都能使合成氨的反应速率加快 B、H2、I2、HI平衡时的混合气体加压后颜色变深 C、SO2催化氧化生成SO3的反应,往往需要使用催化剂 D、红棕色的NO2加压后颜色先变深后变浅8. 已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 mol•L﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
7. 下列能用勒夏特列原理解释的是( )A、高温及加入催化剂都能使合成氨的反应速率加快 B、H2、I2、HI平衡时的混合气体加压后颜色变深 C、SO2催化氧化生成SO3的反应,往往需要使用催化剂 D、红棕色的NO2加压后颜色先变深后变浅8. 已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 mol•L﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )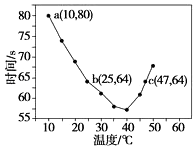 A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 B、图中a点对应的NaHSO3反应速率为5.0×10﹣5 mol•L﹣1•s﹣1 C、图中b、c两点对应的NaHSO3反应速率相等 D、40℃之后,淀粉不宜用作该实验的指示剂9. 在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)⇌CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )A、1.2 mol B、1.5 mol C、1.8 mol D、2.1 mol10. 高温下,某反应平衡常数K= .恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 B、图中a点对应的NaHSO3反应速率为5.0×10﹣5 mol•L﹣1•s﹣1 C、图中b、c两点对应的NaHSO3反应速率相等 D、40℃之后,淀粉不宜用作该实验的指示剂9. 在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)⇌CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )A、1.2 mol B、1.5 mol C、1.8 mol D、2.1 mol10. 高温下,某反应平衡常数K= .恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
A、该反应的化学方程式为CO+H2O CO2+H2 B、该反应的焓变为正值 C、恒温恒容下,增大压强,H2浓度一定减小 D、升高温度,平衡右移,逆反应速率减小11. 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g).达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为( )A、9 B、16 C、20 D、2512. 下列各表述与示意图一致的是( )A、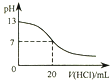 图表示25℃时,用0.1 mol•L﹣1盐酸滴定20 mL 0.1 mol•L﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B、
图表示25℃时,用0.1 mol•L﹣1盐酸滴定20 mL 0.1 mol•L﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B、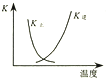 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C、
图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C、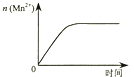 图③表示10 mL 0.01 mol•L﹣1 KMnO4 酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D、
图③表示10 mL 0.01 mol•L﹣1 KMnO4 酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D、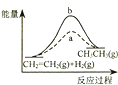 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化
13. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )A、保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 B、通入CO后,正反应速率逐渐增大 C、反应前H2S物质的量为7 mol D、CO的平衡转化率为80%14. c(H+)均为0.1mol•L﹣1的两种一元酸HX和HY溶液,分别取100mL加入足量的镁粉.充分反应后,收集到体积分别为VHX和VHY若相同条件下VHX>VHYX , 则下列说法正确的是( )A、HX可能是强酸 B、HY一定是强酸 C、HX的酸性强于HY的酸性 D、反应开始时二者生成的速率相等15. pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化
13. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )A、保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 B、通入CO后,正反应速率逐渐增大 C、反应前H2S物质的量为7 mol D、CO的平衡转化率为80%14. c(H+)均为0.1mol•L﹣1的两种一元酸HX和HY溶液,分别取100mL加入足量的镁粉.充分反应后,收集到体积分别为VHX和VHY若相同条件下VHX>VHYX , 则下列说法正确的是( )A、HX可能是强酸 B、HY一定是强酸 C、HX的酸性强于HY的酸性 D、反应开始时二者生成的速率相等15. pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )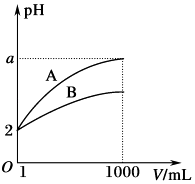 A、A,B两酸溶液的物质的量浓度一定相等 B、稀释后,A酸溶液的酸性比B酸溶液强 C、a=5时,A是强酸,B是弱酸 D、若a小于5,则A,B都是弱酸,且A的酸性弱于B16. 下列叙述正确的是( )A、95℃纯水的pH<7,说明加热可导致水呈酸性 B、向水中加入少量稀硫酸,c(H+)增大,KW不变 C、向水中加入氨水,水的电离平衡向正反应方向移动,c(OH﹣)增大 D、pH=3的醋酸溶液,稀释至10倍后pH=417. 常温下,向一定体积的0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )A、溶液中导电粒子的数目减少 B、醋酸的电离程度增大,c(H+)亦增大 C、溶液中 不变 D、溶液中 不变
A、A,B两酸溶液的物质的量浓度一定相等 B、稀释后,A酸溶液的酸性比B酸溶液强 C、a=5时,A是强酸,B是弱酸 D、若a小于5,则A,B都是弱酸,且A的酸性弱于B16. 下列叙述正确的是( )A、95℃纯水的pH<7,说明加热可导致水呈酸性 B、向水中加入少量稀硫酸,c(H+)增大,KW不变 C、向水中加入氨水,水的电离平衡向正反应方向移动,c(OH﹣)增大 D、pH=3的醋酸溶液,稀释至10倍后pH=417. 常温下,向一定体积的0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )A、溶液中导电粒子的数目减少 B、醋酸的电离程度增大,c(H+)亦增大 C、溶液中 不变 D、溶液中 不变二、非选择题
-
18. 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.(1)、在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .(2)、化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)、CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)、FeCO3在空气中加热反应可制得铁系氧化物材料.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
19. 废旧印刷电路板的回收利用可实现资源再生,并减少污染.(1)、用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ•mol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJ•mol﹣1
H2(g)+ O2(g)=H2O(l)△H=﹣285.84kJ•mol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)、控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).温度(℃)
20
30
40
50
60
70
80
铜平均溶解速率
(10﹣3mol•L﹣1•min﹣1)
7.34
8.01
9.25
7.98
7.24
6.73
5.76
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)、在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .20. 工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)(1)、判断反应达到平衡状态的依据是(填字母序号,下同) .
A、生成CH3OH的速率与消耗CO的速率相等 B、混合气体的密度不变 C、混合气体的相对平均分子质量不变 D、CH3OH、CO、H2的浓度都不再发生变化 E、气体的压强不再改变(2)、表所列数据是该反应在不同温度下的化学平衡常数(K).温度
250℃
300℃
350℃
K
2.041
0.270
0.012
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)、要提高CO的转化率,可以采取的措施是 .a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)、在250℃时,测得某密闭容器中各物质的物质的量浓度见表:CO
H2
CH3OH
0.5mol•L﹣1
2mol•L﹣1
6mol•L﹣1
此时反应的正、逆反应速率的关系是:v(正)v(逆)(填“>”“<”或“═”).
21. CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)⇌H2(g)+CO2(g)的平衡常数随温度的变化如表:
温度/℃
400
500
800
平衡常数K
9.94
9
a
(1)、上述反应的逆反应是(填“放热”或“吸热”)反应.(2)、已知在一定温度下:C(s)+CO2(g)⇌2CO(g) KC(s)+H2O (g)⇌H2(g)+CO(g) K1
CO(g)+H2O (g)⇌H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是 .
(3)、800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)⇌H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.①0~4min内,CO2的平均反应速率为mol•L﹣1•min﹣1 , 800℃时a= .
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(mol•L﹣1)如表,其中达到平衡状态的是(填字母).
A
B
C
D
c(CO2)
3
1
0.8
1
c(H2)
2
1
0.8
1
c(CO)
1
2
3
0.5
c(H2O)
2
2
3
2
22. 在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率,某同学设计实验如表所示:
0.01mol•L﹣1
KIO3酸性溶液(含淀粉)的体积/mL
0.01mol•L﹣1
Na2SO3溶液的体积/mL
H2O的体积
/mL
实验
温度
/℃
溶液出现蓝色时所需时间/s
实验1
5
V1
35
25
实验2
5
5
40
25
实验3
5
5
V2
0
(1)、该实验的目的是 ,(2)、表中V1=mL.23. 可逆反应C(s)+H2O(g)⇌H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.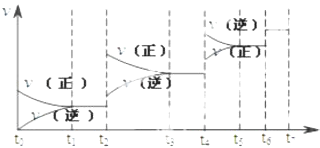
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
24. 电解质溶液与人类生活息息相关,请回答下列问题(1)、某温度下,Kw=1×10﹣12( mol•L﹣1)2 , 若保持温度不变,向水中滴入稀硫酸恰好使溶液中c(H+)/c(OH﹣)=1×1010 , 则此时水电离出的c(H+)=mol•L﹣1 .(2)、常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是 .A、若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7mol/L B、若V1=V2 , 混合后溶液的pH一定等于7 C、若混合后溶液呈酸性,则V1一定大于V2 D、若混合后溶液呈碱性,则V1一定小于V2(3)、下列曲线中,可以描述乙酸(甲,Ka=1.8×10﹣5 mol/L)和一氯乙酸(乙,Ka=1.4×10﹣3 mol/L)在水中的电离度与浓度关系的是 .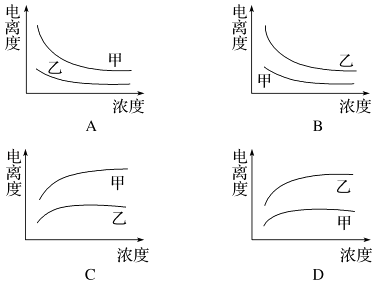 (4)、在下列实验中,能证明醋酸酸性比盐酸酸性弱的是 .A、将等体积、pH=4的盐酸和醋酸稀释成pH=5的溶液,测量所需加入水量的多少 B、向等体积、等pH的盐酸和醋酸中分别加入同量的相应钠盐固体,测溶液的pH有无变化 C、向等体积、等浓度的盐酸和醋酸分别加入足量锌粉,测量产生氢气的体积 D、用等体积、等浓度的盐酸和醋酸做导电性实验,根据灯泡的明亮程度.
(4)、在下列实验中,能证明醋酸酸性比盐酸酸性弱的是 .A、将等体积、pH=4的盐酸和醋酸稀释成pH=5的溶液,测量所需加入水量的多少 B、向等体积、等pH的盐酸和醋酸中分别加入同量的相应钠盐固体,测溶液的pH有无变化 C、向等体积、等浓度的盐酸和醋酸分别加入足量锌粉,测量产生氢气的体积 D、用等体积、等浓度的盐酸和醋酸做导电性实验,根据灯泡的明亮程度.