相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、工业上以软锰矿(主要成分为MnO2)为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如下。下列说法错误的是
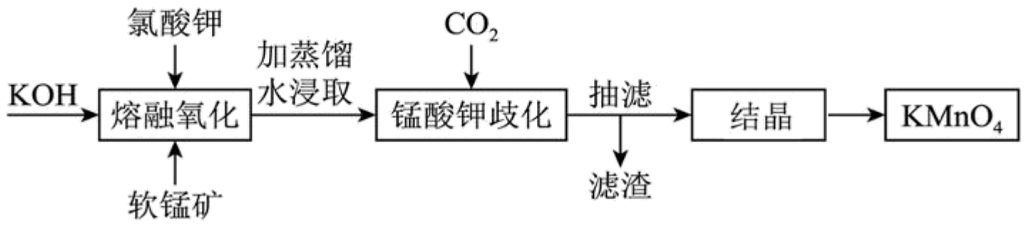 A、“熔融氧化”应在铁坩埚中进行,陶瓷坩埚或Al2O3坩埚均不行 B、“锰酸钾歧化”可以用H2SO4但不能用盐酸代替CO2 C、“结晶”操作与从NaCl溶液得NaCl晶体操作相同 D、该流程中可循环使用的物质是MnO2
A、“熔融氧化”应在铁坩埚中进行,陶瓷坩埚或Al2O3坩埚均不行 B、“锰酸钾歧化”可以用H2SO4但不能用盐酸代替CO2 C、“结晶”操作与从NaCl溶液得NaCl晶体操作相同 D、该流程中可循环使用的物质是MnO2 -
2、丙烯与氢卤酸的加成反应过程主要分两步完成,如图:

其中,反应速率主要由第一步烯烃与H+结合生成碳正离子决定。下列说法错误的是
A、反应物丙烯不存在顺反异构 B、上述条件下,丙烯生成中间产物a的反应活化能较低 C、若使用CF3CH=CH2进行上述反应,则主要产物可能为CF3CH2CH2Cl D、上述反应,在适当条件下氢卤酸中卤素离子浓度越大反应速率越快 -
3、电动汽车电池一直是研究热点,高能量密度的全固态电池有望在2027年投入应用,2030年左右实现大规模商用。现有某可充放电的全固态钠电池,工作原理如图所示,下列说法正确的是
 A、为了降低成本,可以将固态聚合物电解质换为Na3PO4溶液 B、放电时,电极电势N极高于M极 C、充电时,M极电极反应式为:Na3V2(PO4)3-2e—=NaV2(PO4)3+2Na+ D、充电时,Na+由N极迁移至M极
A、为了降低成本,可以将固态聚合物电解质换为Na3PO4溶液 B、放电时,电极电势N极高于M极 C、充电时,M极电极反应式为:Na3V2(PO4)3-2e—=NaV2(PO4)3+2Na+ D、充电时,Na+由N极迁移至M极 -
4、环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包含某些分子形成超分子。图1、2、3分别表环六糊精结构、超分子示意图及相关应用。下列说法正确的是
 A、环六糊精属于多糖 B、邻氯苯甲醚、对氯苯甲醚均易被环六糊精包合形成超分子 C、通过图2、图3可知对氯苯甲醚与环六糊精形成的超分子甲氧基、氯原子均暴露在反应环境中 D、由题目信息可知,分离环六糊精和氯代苯甲醚通常采用蒸馏法
A、环六糊精属于多糖 B、邻氯苯甲醚、对氯苯甲醚均易被环六糊精包合形成超分子 C、通过图2、图3可知对氯苯甲醚与环六糊精形成的超分子甲氧基、氯原子均暴露在反应环境中 D、由题目信息可知,分离环六糊精和氯代苯甲醚通常采用蒸馏法 -
5、下列实验操作或现象和相应结论均正确的是
选项
实验操作或现象
结论
A
向2mL0.1mol·L-1K2Cr2O7溶液中滴加5~10滴6mol/LNaOH溶液,溶液由橙色变黄色
减小生成物浓度,K2Cr2O7反应的平衡正移
B
用pH计测定SO2、CO2饱和溶液的pH,前者pH小
Ka:H2SO3>H2CO3
C
将含NaOH、乙醇的1-溴丁烷混合体系加热后产生的气体通入酸性KMnO4溶液中,紫红色褪去
1-溴丁烷发生了消去反应
D
用饱和Na2CO3溶液浸泡BaSO4一段时间后过滤洗涤,向所得的滤渣上滴加稀盐酸,有气泡冒出
Ksp(BaSO4)>Ksp(BaCO3)
A、A B、B C、C D、D -
6、实验室制取FeSO4溶液和NaHCO3溶液,并利用两者反应制取FeCO3 , 下列有关实验装置和操作不能达到实验目的的是
 A、用装置甲制取FeSO4溶液 B、用装置乙制取NaHCO3溶液 C、用装置丙制取FeCO3 D、用装置丁过滤所得的浊液
A、用装置甲制取FeSO4溶液 B、用装置乙制取NaHCO3溶液 C、用装置丙制取FeCO3 D、用装置丁过滤所得的浊液 -
7、M、W、X、Y、Z是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的核外s能级电子数等于p能级电子数,X的核外电子有4种空间运动状态;五种主族元素组成的化合物Q的结构如图所示。下列说法错误的是
 A、原子半径:X>Y>Z B、Y元素组成的最常见单质和M的单质,在加热条件下生成的化合物中只含离子键 C、Q的结构存在配位键,除M外的原子最外层均满足8电子稳定结构 D、含X、Y、Z等元素的化合物
A、原子半径:X>Y>Z B、Y元素组成的最常见单质和M的单质,在加热条件下生成的化合物中只含离子键 C、Q的结构存在配位键,除M外的原子最外层均满足8电子稳定结构 D、含X、Y、Z等元素的化合物 具有较高的熔沸点
具有较高的熔沸点
-
8、我国第一部中药学典籍《神农本草经》中记载的一种中药“昆布”,具有利水消肿的功效,其主要成分是3,5-二碘酪氨酸,结构简式如下图。下列关于该有机物说法错误的是
 A、该分子中含有1个手性碳原子 B、理论上1mol该物质最多消耗3molH2 C、既能与盐酸反应,也能与NaOH溶液反应 D、等量该物质最多消耗NaHCO3与Na2CO3的物质的量之比为1:1
A、该分子中含有1个手性碳原子 B、理论上1mol该物质最多消耗3molH2 C、既能与盐酸反应,也能与NaOH溶液反应 D、等量该物质最多消耗NaHCO3与Na2CO3的物质的量之比为1:1 -
9、下列反应方程式书写正确的是A、用醋酸和淀粉-KI溶液检验加碘盐中的IO:IO+5I-+6H+=3I2+3H2O B、利用FeS处理废水中的Hg2+:FeS(s)+Hg2+(aq)HgS(s)+Fe2+(aq) C、用Pt作电极电解MgCl2溶液:2Cl-+2H2OCl2↑+H2↑+2OH- D、煅烧硫铁矿:4FeS2+15O28SO3+2Fe2O3
-
10、设NA为阿伏加德罗常数的值。下列说法一定正确的是A、136gKHSO4晶体与CaSO4晶体混合物中离子总数为2NA B、标准状况下,22.4LC4H8中σ键数目为11NA C、78gNa2O2与足量的CO2和H2O混合物反应转移电子数为2NA D、电解精炼铜时,阳极减少32g,转移电子数为NA
-
11、实验是化学的基础。下列基本实验描述正确的是

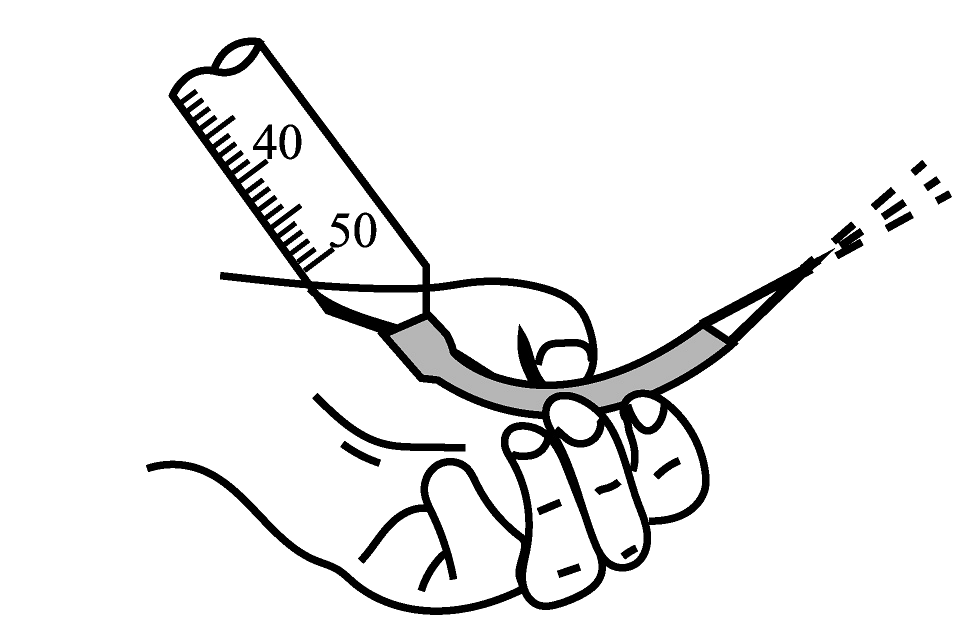
A.图中标识意为洗净手才可进行实验
B.排出盛有KMnO4溶液滴定管尖嘴内的气泡

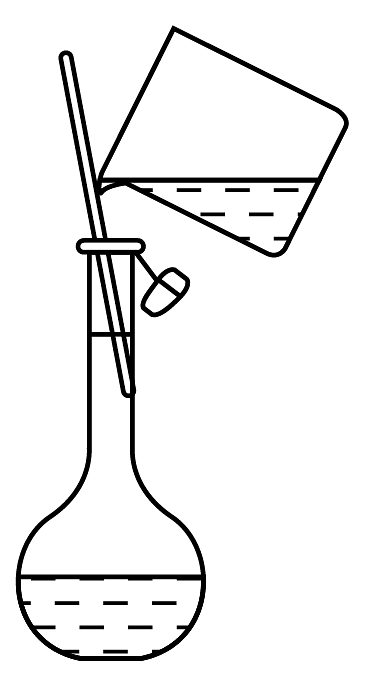
C.测新制氯水的pH
D.向容量瓶转移溶液
A、A B、B C、C D、D -
12、下列化学用语使用正确的是A、H2S、PCl3的VESPR模型一致 B、异戊烷的空间填充模型:
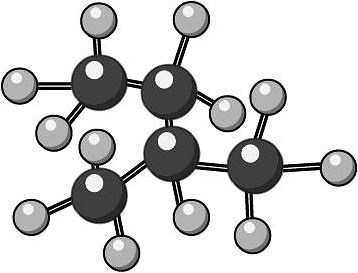 C、用系统命名法命名CH2ClCH2Cl:二氯乙烷
D、基态As原子简化电子排布式:[Ar]4s24p3
C、用系统命名法命名CH2ClCH2Cl:二氯乙烷
D、基态As原子简化电子排布式:[Ar]4s24p3
-
13、化学无处不在。下列说法错误的是A、微生物降解塑料的使用有利于消除“白色污染” B、汽车智能驾驶离不开强大汽车芯片,二氧化硅是该芯片的核心成分 C、《哪吒》电影中的结界兽原型是三星堆青铜器,青铜属于合金材料 D、加工馒头、面包和饼干时可加入适量碳酸氢铵、碳酸氢钠等,使其松软或酥脆
-
14、物质类别和元素价态是研究物质性质的两个重要角度。下图为含氮物质的“价—类”二维图的部分信息。下列说法不正确的是
 A、从的转化是人工固氮的重要方法 B、Y的化学式为 C、从 , 必需加入氧化剂 D、使用和X制备硝酸铵氮肥时,氮元素的化合价没有发生变化
A、从的转化是人工固氮的重要方法 B、Y的化学式为 C、从 , 必需加入氧化剂 D、使用和X制备硝酸铵氮肥时,氮元素的化合价没有发生变化 -
15、锡(Sn)是第IVA族元素,其常见的氯化物有SnCl4和SnCl2。SnCl4常温下为液体,遇水极易发生水解反应;SnCl2常温下为固体,具有还原性,可被空气中的氧气氧化。某化学实验小组制备SnCl4的装置如图(加热与夹持装置省略)。

回答下列问题:
(1)、仪器a的名称是;装置B中盛放的试剂是。(2)、制取SnCl4的操作步骤为:①连接好装置;②;③添加药品、滴加浓盐酸;④待装置D后,加热装置C;⑤收集SnCl4。请补充上述实验步骤。已知装置A中反应的还原产物为 , 写出该反应的离子方程式。(3)、装置E的作用是。(4)、经测定发现实验所得SnCl4 , 样品中含有少量的SnCl2 , 测定样品纯度的方案如下:取ag样品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用碘酸钾标准溶液滴定至终点,消耗标准液。滴定过程中先后发生的反应为:
i.
ii.(均未配平)
则SnCl4样品的纯度为%;若滴定时间过长,会使测量结果(填“偏大”、“偏小”或“无影响”)。
-
16、劳动创造美好生活!下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
口腔医生:在牙齿表面涂一层含氟釉质防龋齿
B
桥梁工程师:用牺牲阳极法对黄茅海大桥钢管桩进行防护
Fe作电解池阴极被保护
C
环境工程师:测定某地雨水pH值为5.1
大气中等溶于雨水使其显酸性
D
珠宝鉴定师:用X射线鉴定钻石的真伪
不同的晶体具有独特的明锐衍射峰
A、A B、B C、C D、D -
17、
CO2转化为具有高附加值的化学品对实现“碳中和”具有重要意义。
I.通过以下反应可获得新型能源二甲醚。
①
②
③
(1)反应②正反应在________(填“较低温度”或“较高温度”)条件下能自发进行。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
A. 增大CO2浓度,反应①、②的正反应速率都增加 B. 移去部分CH3OH(g),反应②、③的平衡均向右移动 C. 加入反应①的催化剂,可提高CO2的平衡转化率 D. 降低反应温度,反应③的正反应速率增加、逆反应速率减小 (3)在5.0MPa下,将5molCO2和10mol H2在催化剂作用下仅发生上述反应①和②,平衡时CH3OH和CO的选择性S及的CO2转化率a随温度的变化如图所示。已知,选择性S为:S(CH3OH或CO)= , 表示平衡时CO的选择性的曲线是________(填“x”“y”或“z”),CO的选择性随温度改变呈现该变化的原因是:________。

(4)250℃时,平衡体系共有0.5molCH3OH,则CO2的平衡转化率________。
Ⅱ.CH4和CO2反应制备“合成气”反应历程分两步:
步骤
反应
正反应速率方程
逆反应速率方程
反应ⅰ
反应ⅱ
上述反应中为吸附性活性炭,反应历程的能量图变化如下图所示:

(5)该反应中的决速步骤为________(填反应ⅰ或反应ⅱ)
(6)一定温度下,反应的平衡常数________(用、、、表示)。
-
18、奥司他韦被称为流感特效药,具有抗病毒的生物学活性,其主流合成路线如图所示:
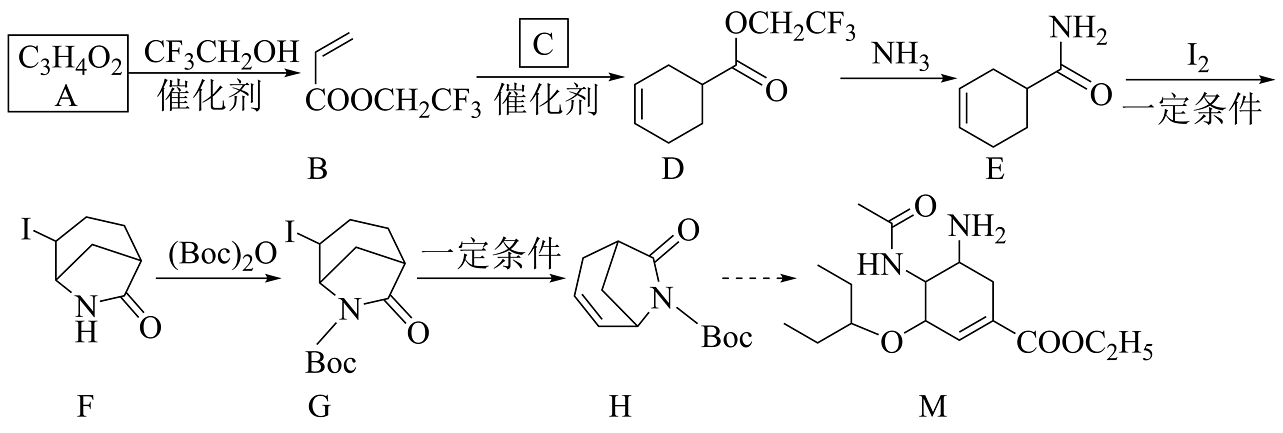
已知:的结构简式为
 。回答下列问题:(1)、写出A的结构简式;其中碳原子的杂化方式是。(2)、B中含氧官能团名称为。(3)、已知C的分子式为C4H6 , 写出B→D的化学方程式为。(4)、E→F的反应分两步进行,第一步反应是加成反应,第二步的反应类型是。(5)、有关奥司他韦(M),下列说法错误的是___________。A、其官能团种类为5种 B、其所有碳原子有可能共平面 C、1mol奥司他韦最多可与3mol H2发生加成 D、可与盐酸反应生成有机盐(6)、在B的同分异构体中,同时满足下列条件的共有种(不考虑立体异构)。
。回答下列问题:(1)、写出A的结构简式;其中碳原子的杂化方式是。(2)、B中含氧官能团名称为。(3)、已知C的分子式为C4H6 , 写出B→D的化学方程式为。(4)、E→F的反应分两步进行,第一步反应是加成反应,第二步的反应类型是。(5)、有关奥司他韦(M),下列说法错误的是___________。A、其官能团种类为5种 B、其所有碳原子有可能共平面 C、1mol奥司他韦最多可与3mol H2发生加成 D、可与盐酸反应生成有机盐(6)、在B的同分异构体中,同时满足下列条件的共有种(不考虑立体异构)。①链状结构;②能与饱和NaHCO3溶液反应产生气体;③含-CF3。
(7)、已知 (R1、R2、R3、R4为烃基或氢原子),请结合题中流程,写出利用CH3CH2CH2Br和
(R1、R2、R3、R4为烃基或氢原子),请结合题中流程,写出利用CH3CH2CH2Br和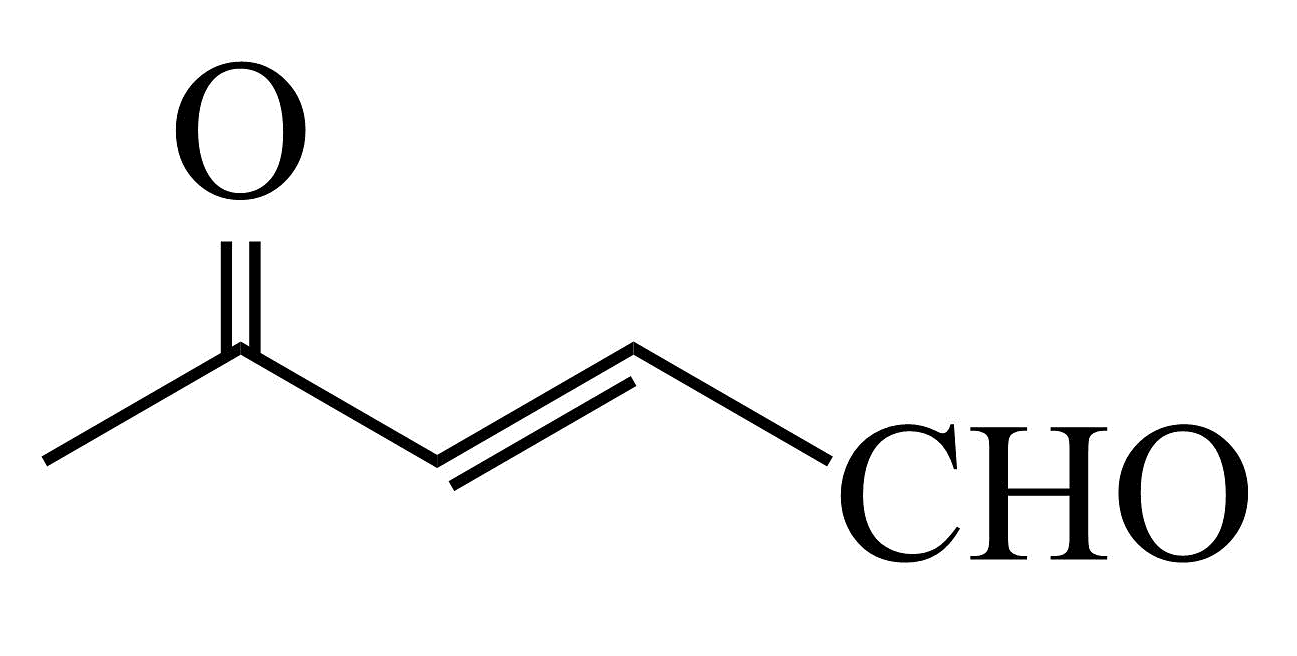 为主要原料制备的
为主要原料制备的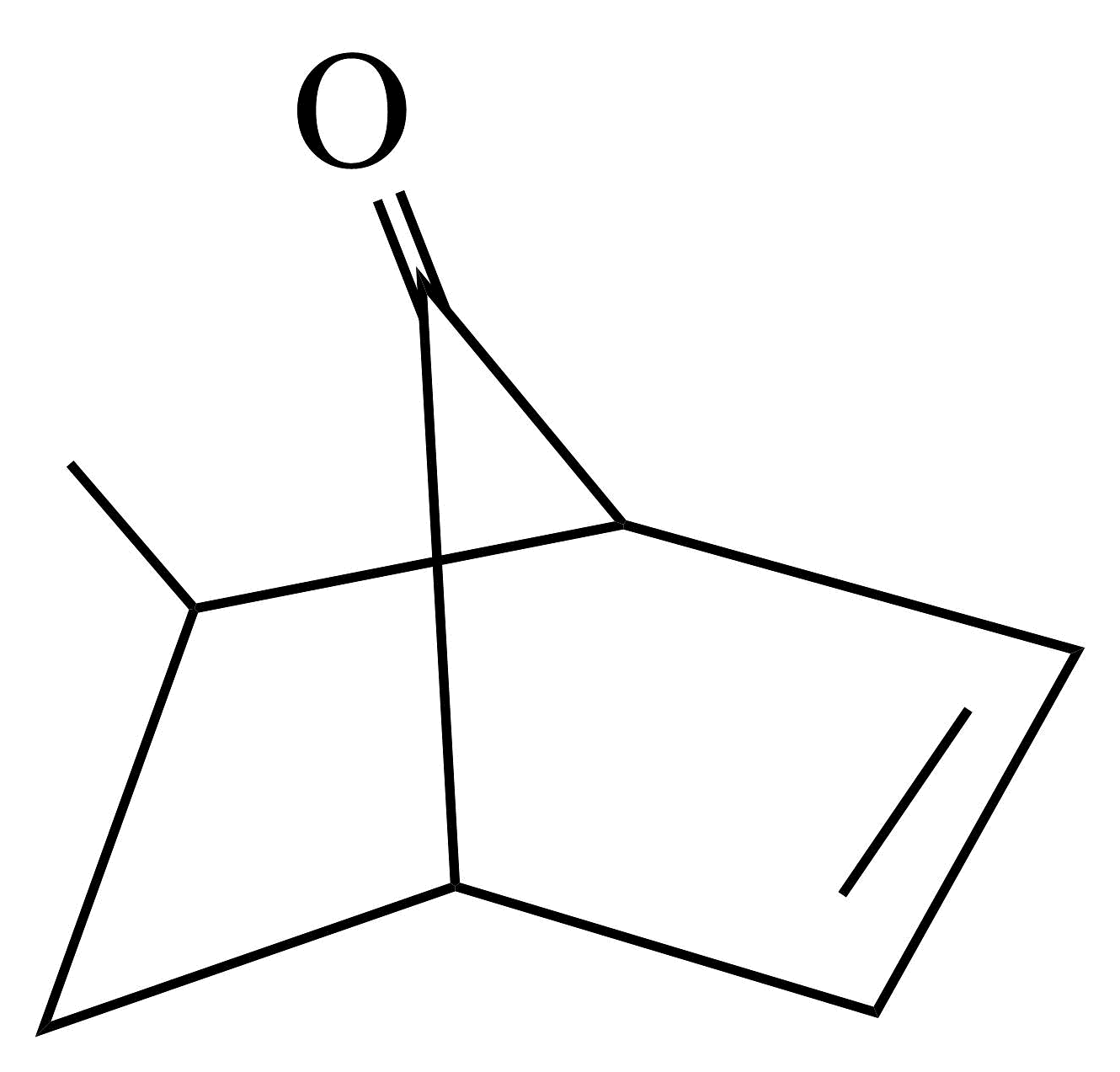 合成路线(无机试剂任选)。
合成路线(无机试剂任选)。 -
19、镍是重要的战略储备金属,广泛用于国防、航空航天、能源领域。从红土镍矿中冶炼镍成为了研究热点,红土镍矿主要含有NiO、SiO2、Fe2O3、Fe3O4等成分。一种碳还原-超声氨浸工艺流程如图所示:
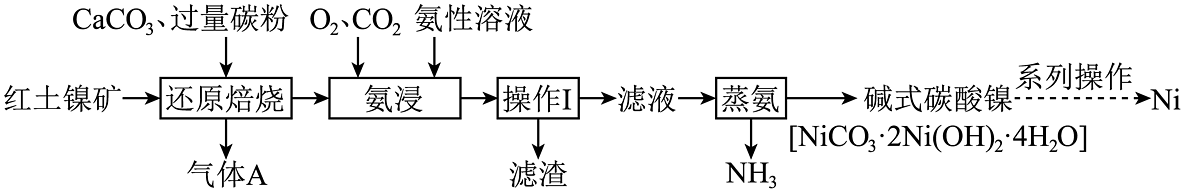
已知:氨性溶液由NH3•H2O、NH4HCO3配制;“还原焙烧”反应的产物为镍铁合金、硅酸钙。
回答下列问题:
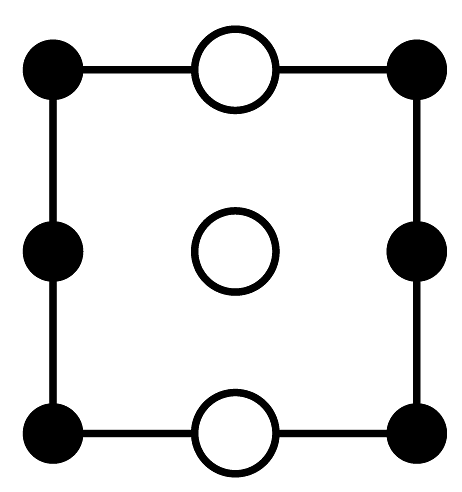
(1)、“气体A”为(填名称)。(2)、“氨浸”时的温度为20℃,在此条件下超声浸出一小时,浸出率可达60%以上,选择该温度的原因是。(3)、经过“氨浸”后转化为含[Ni(NH3)4]2+的某酸式盐,写出“氨浸”中Ni发生反应的离子方程式:。(4)、“操作Ⅰ”中需使用的玻璃仪器为。(5)、“系列操作”中包含高温热解碱式碳酸镍生成NiO,再通入H2制得Ni单质。请写出“高温热解”的化学方程式:;若生产59吨镍,理论上需要H2kg。(6)、碱式碳酸镍受热过程中可能生成其它镍的氧化物,其中一种晶胞结构如下图所示,该氧化物的化学式为 , 该晶胞的俯视图为(填字母代号)。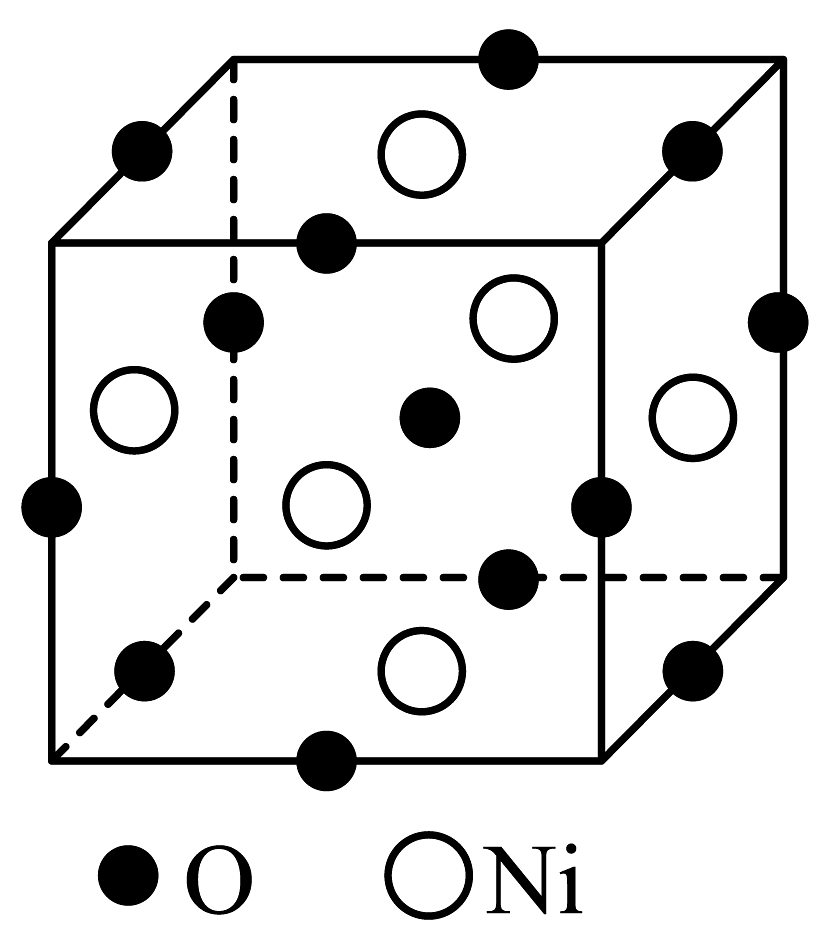
A.
 B.
B.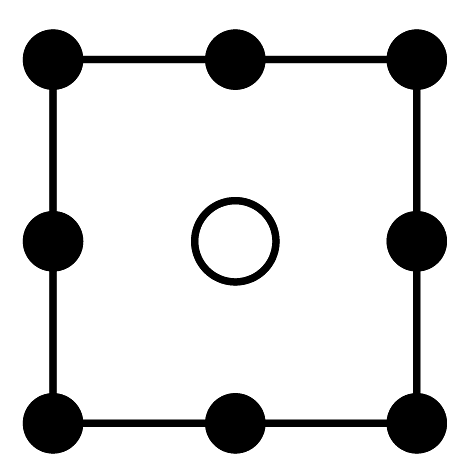 C.
C.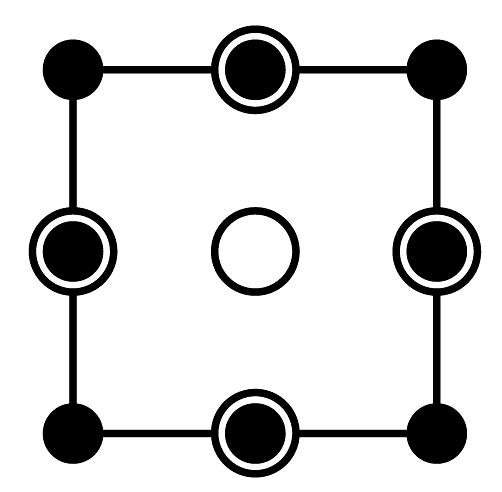
-
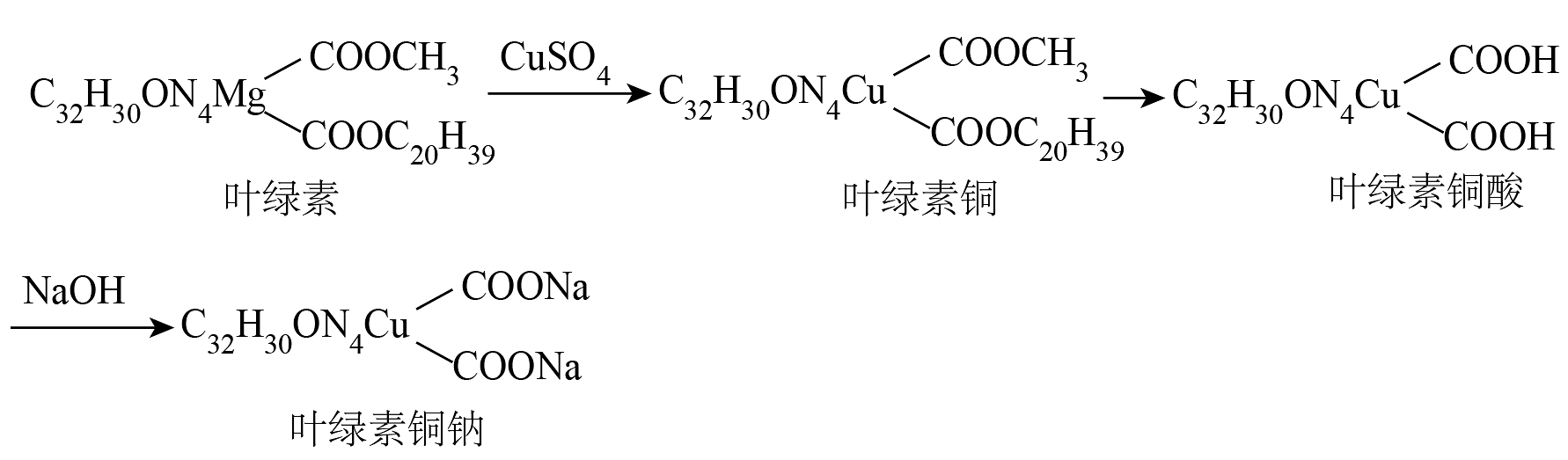
20、叶绿素铜钠是国家食品安全允许使用的食品添加剂,医疗领域叶绿素铜钠能止血抗炎、促进伤口愈合。某实验小组利用茭白叶,在实验室制备叶绿素铜钠,反应原理如下:
实验步骤:
Ⅰ.称取洗净剪碎的茭白叶10.0g(叶绿素含量为17.84%),加入少量石英砂、碳酸钙粉末,研磨。
Ⅱ.加入10mL96%乙醇继续研磨成均匀浆状,微波加热6min后抽滤。滤渣加入10mL96%乙醇,再次微波加热、浸提、抽滤,将两次滤液合并。
Ⅲ.滤液装入仪器C,加入硫酸酸化,加入硫酸铜晶体,搅拌至硫酸铜晶体溶解后,再加入盐酸调节溶液pH至2~3,搅拌加热半小时以上。
Ⅳ.……
Ⅴ.将叶绿素铜与50%乙醇混合,加入NaOH溶液,加热15min,再加入稀 溶液,加热至有墨绿色物质浮起,过滤、洗涤、干燥,得到叶绿素铜酸。
Ⅵ.将叶绿素铜酸放入烧杯中,保温80℃,逐滴加入2%氢氧化钠溶液至pH为10,过滤,滤液经蒸发结晶,烘干即得成品1.026g。
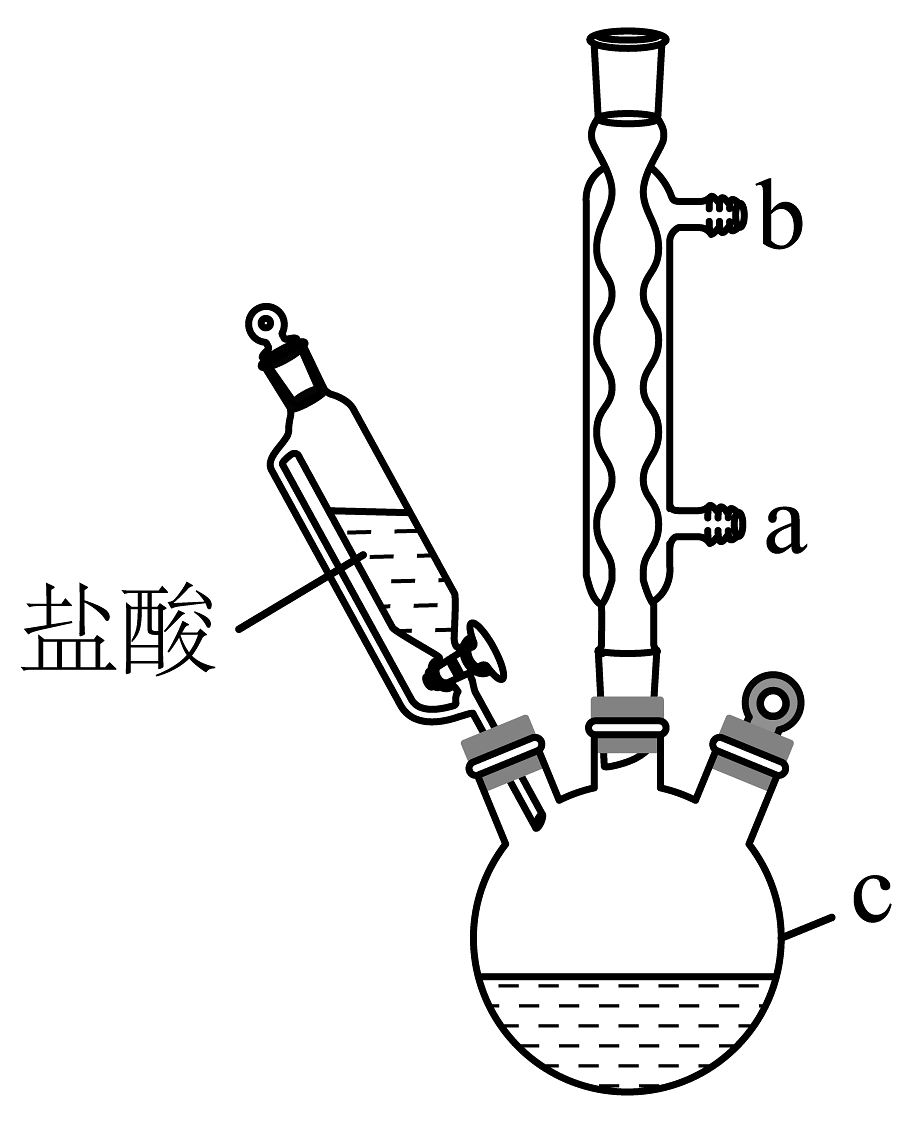
已知:
物质
相对分子质量
部分性质
叶绿素
892
蓝绿色固体,不溶于水,易溶于有机溶剂,对热不稳定,最佳提取温度约为80℃
叶绿素铜
932
绿色固体,不溶于水和50%乙醇
叶绿素铜酸
640
墨绿色固体,不溶于水
叶绿素铜钠
684
墨绿色固体,易溶于水,水溶液透明,受热较稳定
(1)、仪器C的名称是 , 冷却水应从(填“a”或“b”)口通入。(2)、96%的乙醇的主要作用是。(3)、步骤Ⅲ中加入硫酸酸化的目的是(结合离子方程式和化学平衡移动原理说明)。(4)、步骤IⅤ的操作为:冷却后向混合物中加入(填标号),静置后过滤、洗涤、干燥,得到叶绿素铜。A.蒸馏水 B.无水乙醇 C.NaOH
(5)、本实验采用微波加热,微波加热时,电炉内的微波场以极高的频率改变电场的方向,使水分子迅速摆动而产生热效应。在高频改变方向的电场中水分子会迅速摆动的原因是。A.水分子具有极性共价键B.水分子中有共用电子对
C.水由氢、氧两种元素组成D.水分子是极性分子
用甲烷高温分解制炭黑的工业生产中,是否适合使用该技术加热并请说明原因。
(6)、本实验的产率为%