2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
试卷更新日期:2018-02-08 类型:同步测试
一、选择题
-
1. 下列说法错误的是( )A、 、 、H+和H2是氢元素的四种不同粒子 B、 和 、石墨和金刚石均为同素异形体 C、1H 和 2H 是不同的核素 D、12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同2. 简单原子的原子结构可用下图形象地表示:
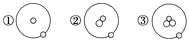
其中“
 ”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )A、①②③互为同素异形体 B、①②③互为同位素 C、①②③是三种化学性质不同的粒子 D、①②③具有相同的质量数3. 下列各组中属于同位素关系的是( )A、金刚石与石墨 B、T2O与H2O C、40K与39K D、16O与16O2-4. 已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )A、 B、 C、 D、5. 1H、2H、3H、H+、H2是( )
”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )A、①②③互为同素异形体 B、①②③互为同位素 C、①②③是三种化学性质不同的粒子 D、①②③具有相同的质量数3. 下列各组中属于同位素关系的是( )A、金刚石与石墨 B、T2O与H2O C、40K与39K D、16O与16O2-4. 已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )A、 B、 C、 D、5. 1H、2H、3H、H+、H2是( )
A、氢的五种同位素 B、五种氢元素 C、氢的五种原子 D、氢元素的五种不同粒子6. 已知R2+核内共有N个中子,R 质量数为A,确定m g R2+中含有电子的物质的量为( )
A、 mol B、 mol C、 mol D、 mol7. 核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是( )
A、 (A-N+8) mol B、 (A-N+10) mol C、(A-N+2) mol D、 (A-N+6) mol8. 某元素一种同位素原子的质子数为m,中子数为n,则下列叙述正确的是( )A、不能由此确定元素的相对原子质量 B、该元素的相对原子质量为m+n C、若12C原子的质量为W g,则该原子的质量为(m+n)W g D、核内中子的总质量小于质子的总质量9. 金属钛有“生物金属”之称。下列有关 和 的说法正确的是( )A、 和 原子中均含有22个中子 B、 和 在周期表中位置相同,都在第4纵行 C、 和 的物理性质相同 D、 和 为同一核素10. 14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+ →14C+ 。下列说法正确的是( )
A、14C和14N互为同位素 B、14C和C60互为同素异形体 C、人体内,由于新陈代谢作用也存在14C D、当14 g是核素14N完全被轰击时,吸收中子( )的质量约为6.02×1023g二、非选择题
-
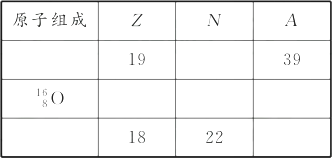
11.(1)、日本大地震和海啸造成核电站爆炸,发生核泄漏,使碘131、铯137等放射性核素扩散到空气和海洋中。碘131的原子核中,中子数与质子数之差为 , 铯元素位于元素周期表中第周期族。(2)、下列原子: 、 、 、 、 、 、 、 、 中共有种元素,种核素。(3)、在H3O+中,质子数、中子数、电子数之比为;在NH3D+中,质子数、中子数、电子数之比为。(4)、填写下列表格(Z——质子数,N——中子数,A——质量数):
 12. 用 表示原子:(1)、中性原子的中子数N=。(2)、AXn+共有x个电子,则该阳离子的中子数N=。(3)、AXn-共有x个电子,则该阴离子的中子数N=。(4)、12C16O2分子中的中子数N=。(5)、A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为。13.
12. 用 表示原子:(1)、中性原子的中子数N=。(2)、AXn+共有x个电子,则该阳离子的中子数N=。(3)、AXn-共有x个电子,则该阴离子的中子数N=。(4)、12C16O2分子中的中子数N=。(5)、A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为。13.
(1)、A元素原子的核电荷数为8,其原子核内的质子数为 , 该元素原子的二价阴离子中,核外电子数为 , 中子数是9的核素表示为。(2)、B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为。(3)、A、B形成1:1型化合物的相对分子质量是。14. 有A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,且A元素是卤族元素中非金属性最强的元素;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3 , 其中自然界中含量最多的是C1 , C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素为地壳中含量最多的元素。(1)、写出下列元素的元素符号:D , E。(2)、写出C1、C2、C3三种核素的符号:C1 , C2 , C3。(3)、E2-的离子结构示意图为。(4)、A与B形成的化合物的化学式是 ,最常见的E与C2形成的分子中含个中子。