2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
试卷更新日期:2018-02-08 类型:同步测试
一、选择题
-
1. 下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定;②HClO氧化性比H2SO4强;③HClO4酸性比H2SO4强;④Cl2能与H2S反应生成S;⑤氯原子最外层有7个电子,硫原子最外层有6个电子.
A、②⑤ B、①② C、①②④ D、①③⑤2. 短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( ) A、a是一种活泼的非金属元素 B、c的最高价氧化物的水化物是一种弱酸 C、b的氢化物很稳定 D、b元素的最高化合价为+7价3. 下列说法正确的是( )A、在元素周期表中金属与非金属分界线左边的元素均为金属元素 B、Na、Mg、Al的还原性依次减弱 C、F、Cl、Br的非金属性依次增强 D、NaOH、KOH、Mg(OH)2的碱性依次减弱4. 运用元素周期律分析下面的推断,其中推断错误的是( )A、氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱 B、砹(At)为有色固体,HAt不稳定 C、硫酸锶(SrSO4)是难溶于水的白色固体 D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体5. 锗(Ge)是第四周期第ⅣA族元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述正确的是( )A、锗是一种金属性很强的元素 B、锗的单质具有半导体的性能 C、锗化氢(GeH4)稳定性很强 D、锗酸(H4GeO4)是难溶于水的强酸6. 下表是元素周期表的一部分,有关说法正确的是( )
A、a是一种活泼的非金属元素 B、c的最高价氧化物的水化物是一种弱酸 C、b的氢化物很稳定 D、b元素的最高化合价为+7价3. 下列说法正确的是( )A、在元素周期表中金属与非金属分界线左边的元素均为金属元素 B、Na、Mg、Al的还原性依次减弱 C、F、Cl、Br的非金属性依次增强 D、NaOH、KOH、Mg(OH)2的碱性依次减弱4. 运用元素周期律分析下面的推断,其中推断错误的是( )A、氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱 B、砹(At)为有色固体,HAt不稳定 C、硫酸锶(SrSO4)是难溶于水的白色固体 D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体5. 锗(Ge)是第四周期第ⅣA族元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述正确的是( )A、锗是一种金属性很强的元素 B、锗的单质具有半导体的性能 C、锗化氢(GeH4)稳定性很强 D、锗酸(H4GeO4)是难溶于水的强酸6. 下表是元素周期表的一部分,有关说法正确的是( ) A、e的氢化物比d的氢化物稳定 B、a、b、e三种元素的原子半径:e>b>a C、六种元素中,c元素单质的化学性质最活泼 D、c、e、f的最高价氧化物对应的水化物的酸性依次增强7. X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
A、e的氢化物比d的氢化物稳定 B、a、b、e三种元素的原子半径:e>b>a C、六种元素中,c元素单质的化学性质最活泼 D、c、e、f的最高价氧化物对应的水化物的酸性依次增强7. X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( ) A、原子半径:W>Z>Y>X B、最高价氧化物对应水化物的酸性W比Z弱 C、Y的气态氢化物的稳定性较Z的弱 D、四种元素的单质中,Z的熔、沸点最高8. R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )A、若R(OH)n为强碱,则W(OH)n+1也为强碱 B、若HnXOm为强酸,则Y是活泼非金属元素 C、若Y的最低化合价为-2,则Z的最高正化合价为+7 D、若X的最高正化合价为+5,则五种元素都是非金属元素9. 镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为29.78℃,沸点高达2 403℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120℃。由此判断下列有关镓的性质及其用途的叙述不正确的是( )A、镓是制造高温温度计的上佳材料 B、镓能溶于强酸和强碱中 C、镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中 D、近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体家族的新成员”,这是利用了镓的导电性介于导体和绝缘体之间的性质10. 某同学设计如下元素周期表,以下说法正确的是( )
A、原子半径:W>Z>Y>X B、最高价氧化物对应水化物的酸性W比Z弱 C、Y的气态氢化物的稳定性较Z的弱 D、四种元素的单质中,Z的熔、沸点最高8. R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )A、若R(OH)n为强碱,则W(OH)n+1也为强碱 B、若HnXOm为强酸,则Y是活泼非金属元素 C、若Y的最低化合价为-2,则Z的最高正化合价为+7 D、若X的最高正化合价为+5,则五种元素都是非金属元素9. 镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为29.78℃,沸点高达2 403℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120℃。由此判断下列有关镓的性质及其用途的叙述不正确的是( )A、镓是制造高温温度计的上佳材料 B、镓能溶于强酸和强碱中 C、镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中 D、近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体家族的新成员”,这是利用了镓的导电性介于导体和绝缘体之间的性质10. 某同学设计如下元素周期表,以下说法正确的是( )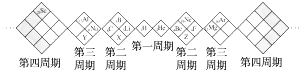 A、X、Y、Z元素分别为N、P、O B、白格中都是主族元素,灰格中都是副族元素 C、原子半径:Z>X>Y D、X、Y、Z的气态氢化物中最稳定的是Y的氢化物
A、X、Y、Z元素分别为N、P、O B、白格中都是主族元素,灰格中都是副族元素 C、原子半径:Z>X>Y D、X、Y、Z的气态氢化物中最稳定的是Y的氢化物二、非选择题
-
11. 下表是元素周期表的一部分,回答相关的问题。
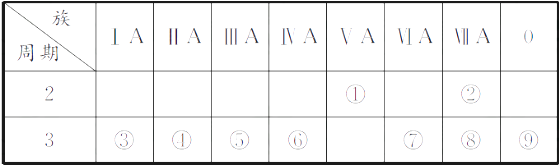 (1)、写出④的元素符号。(2)、在这些元素中,最活泼的金属元素与水反应的离子方程式:。(3)、在这些元素中,最高价氧化物的水化物酸性最强的是(填相应化学式,下同),碱性最强的是。(4)、这些元素中(除⑨外),原子半径最小的是(填元素符号,下同),原子半径最大的是。(5)、②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)。12. 短周期元素Q、R、T、W在元素周期表中的位置如图所示,
(1)、写出④的元素符号。(2)、在这些元素中,最活泼的金属元素与水反应的离子方程式:。(3)、在这些元素中,最高价氧化物的水化物酸性最强的是(填相应化学式,下同),碱性最强的是。(4)、这些元素中(除⑨外),原子半径最小的是(填元素符号,下同),原子半径最大的是。(5)、②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)。12. 短周期元素Q、R、T、W在元素周期表中的位置如图所示,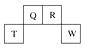
其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)、T的原子结构示意图为。(2)、元素的非金属性为(原子的得电子能力):QW(填“强于”或“弱于”)。(3)、W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种氧化物,其中一种是气体,反应的化学方程式为。(4)、原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。13. 原子序数由小到大排列的四种短周期元素X、Y、Z、W的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。(1)、M元素是(填元素符号)。(2)、Z、W形成的气态氢化物的稳定性为>。(填化学式)(3)、写出M2Z2的电子式: , 写出M2Z2与水反应的离子方程式:。(4)、由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。(5)、由X、Y、Z、W四种元素组成一种离子化合物A,已知:①1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是(填化学式)。写出气体B与氯水反应的离子方程式:。14. 元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。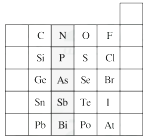 (1)、阴影部分元素在元素周期表中的位置为族。(2)、根据元素周期律预测:H3AsO4属于强酸还是弱酸?。(3)、C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,其原因是。试写出Si的氢化物完全燃烧的化学方程式:。(4)、O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式:。(5)、试比较S、O、F三种元素的原子半径大小:(填元素符号)。
(1)、阴影部分元素在元素周期表中的位置为族。(2)、根据元素周期律预测:H3AsO4属于强酸还是弱酸?。(3)、C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,其原因是。试写出Si的氢化物完全燃烧的化学方程式:。(4)、O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式:。(5)、试比较S、O、F三种元素的原子半径大小:(填元素符号)。