相关试卷
- 江苏省苏州市吴江区汾湖高级中学2025-2026学年高二上学期9月月考化学试题
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 江苏省泰州市靖江高级中学2025-2026学年高一上学期9月月考化学试题
- 四川省大数据智学领航联盟2026届高三上学期一模考试 化学试题
- 江苏省徐州市第七中学2025-2026学年高二上学期9月月考 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 江苏省无锡市2024-2025学年高三上学期期末化学试题
- 广东省清远市清新区第一中学2025-2026学年高三上学期9月月考 化学试题
- 广东实验中学越秀学校2025-2026学年高二上学期10月月考化学试卷
-
1、下列实验产生的废液中,可能大量存在的粒子组是( )
选项
实验
化学知识
A
稀硝酸与铜片制NO
H+、Cu2+、NO3-、NO
B
70%硫酸与Na2SOз制 SO3
H+、Na+、SO42-、HSO3-
C
浓盐酸与KMnO4制Cl2
H+、K+、Mn2+、Cl-
D
双氧水与FeCl3溶液制O2
H+、Fe2+、Cl-、H2O2
A、A B、B C、C D、D -
2、阅读下列材料,完成下列小题.
氨是其他含氮化合物的生产原料.氨可在氧气中燃烧生成N2。金属钠的液氨溶液放置时缓慢放出气体,同时生成NaNH2 , NaNH2遇水转化为NaOH。Cu(OH)2溶于氨水得到深蓝色溶液,加入稀硫酸又转化为蓝色溶液。氨可以发生类似于水解反应的氨解反应,浓氨水与溶液反应生成沉淀。
(1)、下列有关反应的化学方程式错误的是( )A、氨在氧气中燃烧: B、液氨与金属钠反应: C、氨水溶解: D、浓氨水与HgCl2反应:(2)、下列有关物质结构或性质的比较中,正确的是( )A、与 结合的能力: B、与氨形成配位键的能力: C、H2O和分子中的键长:O-H>N-H D、微粒所含电子数: -
3、氟气通过碎冰表面,发生反应① , 生成的HOF遇水发生反应②HOF+H2O=HF+H2O2.下列说法正确的是( )A、HOF的电子式为
 B、H2O2为非极性分子
B、H2O2为非极性分子
C、反应①中有非极性键的断裂和形成
D、反应②中HF为还原产物 -
4、一种天然保幼激素的结构简式如下:

下列有关该物质的说法,错误的是( )
A、分子式为 B、存在4个键 C、含有3个手性碳原子
D、水解时会生成甲醇 -
5、用下列化学知识解释对应劳动项目不合理的是( )
选项
劳动项目
化学知识
A
用大米制麦芽糖
淀粉水解生成麦芽糖
B
用次氯酸钠溶液消毒
次氯酸钠溶液呈碱性
C
给小麦施氮肥
氮是小麦合成蛋白质的必需元素
D
用肥皂洗涤油污
肥皂中的高级脂肪酸钠含有亲水基和疏水基
A、A B、B C、C D、D -
6、以下研究文物的方法达不到目的的是( )
A、用断代法测定竹简的年代 B、用X射线衍射法分析玉器的晶体结构
C、用原子光谱法鉴定漆器表层的元素种类
D、用红外光谱法测定古酒中有机分子的相对分子质量 -
7、下列有关物质用途的说法错误的是( )
A、生石灰可用作脱氧剂
B、硫酸铝可用作净水剂
C、碳酸氢铵可用作食品膨松剂
D、苯甲酸及其钠盐可用作食品防腐剂 -
8、 利用CaS循环再生可将燃煤尾气中的SO,转化生产单质硫,涉及的主要反应如下:
I . CaS(s) +2SO2(g) =CaSO4(s)+S2(g) ΔH1
II. CaSO4(s) +4H2(g)=CaS(s)+ 4H2O(g) ΔH2
III. SO2(g)+3H2(g)=H,S(g)+2H2O(g) ΔH3
恒容条件下,按1mol CaS,1mol SO2和0.1mol H2投料反应。平衡体系中,各气态物种的lg n随温度的变化关系如图所示,n为气态物种物质的量的值。
已知:图示温度范围内反应Ⅱ平衡常数K=108基本不变。

回答下列问题:
(1)、 反应的焓变ΔH =((用含ΔH1 , ΔH2的代数式表示)。(2)、乙线所示物种为(填化学式)。反应Ⅲ的焓变ΔH30 (填“>”“<”或“=”)。(3)、T温度下,体系达平衡时,乙线、丙线所示物种的物质的量相等,若丁线所示物种为a mol,则S2为mol(用含a的代数式表示);此时,CaS与CaSO4物质的量的差值n(CaS)-n(CaSO4)=mol(用含a的最简代数式表示)。(4)、T2温度下,体系达平衡后,压缩容器体积S2产率增大。与压缩前相比,重新达平衡时,H2S与H2物质的量之比(填“增大”“减小”或“不变”), H2O 物质的量n(H2O)(填“增大”“减小”或“不变”)。 -
9、麻醉药布比卡因(1)的两条合成路线如下:

已知:①
 ②
②
回答下列问题:
(1)、 A 结构简式为;B中含氧官能团名称为(2)、 C→D反应类型为;D+E→H化学方程式为(3)、G的同分异构体中,同时满足下列条件的结构简式为(写出一种即可)。①含-NH2含2个苯环③含4种不同化学环境的氢原子
(4)、H中存在酰胺基N原子(a)和杂环N原子(b),N原子电子云密度越大,碱性越强,则碱性较强的N原子是(填“a”或“b”)。(5)、结合路线信息,用H2/PtO2催化加氢时,下列有机物中最难反应的是____(填标号)。A、苯( )
B、吡啶(
)
B、吡啶( )
C、环已-1,3-二烯(
)
C、环已-1,3-二烯( )
D、环己-1,4二烯(
)
D、环己-1,4二烯( )
(6)、 以
)
(6)、 以 ,
,  为主要原料合成
为主要原料合成 利用上述信息补全合成路线。
利用上述信息补全合成路线。
-
10、如下不饱和聚酯可用于制备玻璃钢。

实验室制备该聚酯的相关信息和装置示意图如下(加热及夹持装置略):
原料
结构简式
熔点/℃
沸点/℃
顺丁烯二酸酐

52.6
202.2
邻苯二甲酸酐

130.8
295.0
丙-1,2-二醇

-60.0
187.6

实验过程:
①在装置A中加入上述三种原料,缓慢通入N2。搅拌下加热,两种酸酐分别与丙-1,2-二醇发生醇解反应,主要生成
 和
和 。然后逐步升温至190~200℃,醇解产物发生缩聚反应生成聚酯。
。然后逐步升温至190~200℃,醇解产物发生缩聚反应生成聚酯。②缩聚反应后期,每隔一段时间从装置A中取样并测量其酸值,直至酸值达到聚合度要求(酸值:中和1克样品所消耗KOH的毫克数)。
回答下列问题:
(1)、理论上,原料物质的量投料比n(顺丁烯二酸酐):n(邻苯二甲酸酐):n(丙-1,2-二醇)=(2)、装置B的作用是;仪器C的名称是;反应过程中,应保持温度计2示数处于一定范围,合理的是(填标号)。
A.55~60℃ B.100~105° C.190~195℃(3)、为测定酸值,取a g样品配制250.00mL溶液.移取25.00mL溶液,用c mol·L-1 KOH一乙醇标准溶液滴定至终点,重复实验,数据如下:序号
1
2
3
4
5
滴定前读数/mL
0.00
24.98
0.00
0.00
0.00
滴定后读数/mL
24.98
49.78
24.10
25.00
25.02
应舍弃的数据为(填序号);测得该样品的酸值为(用含a,c的代数式表示)。若测得酸值高于聚合度要求,可采取的措施为(填标号)。
A.立即停止加热 B.排出装置D内的液体 C.增大N2的流速(4)、实验中未另加催化剂的原因是 -
11、 采用两段焙烧—水浸法从铁锰氧化矿(要含Fe2O3MnO2及Co,Cu,Ca,Si等元素的氧化物)分离提取Cu,Co,Mn等元素,工艺流程如下:

已知:该工艺条件下,(NH4)2SO4低温分解生成NH4HSO4 , 高温则完全分解为气体;Fe2(SO4)3在650℃完全分解,其他金属硫酸盐分解温度均高于700℃。
回答下列问题:
(1)、“低温焙烧”时金属氧化物均转化为硫酸盐。MnO2与NH4HSO4反应转化为MnSO4时有N2生成,该反应的化学方程式为.。“高温焙烧”温度为650℃,“水浸”所得滤渣主要成分除SiO2外还含有(填化学式)。(2)、在(NH4)2SO4投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸”时金属元素的浸出率(填“增大”“减小”或“不变”)。(3)、HR萃取Cu2+反应为:。“反萃取”时加入的试剂为(填化学式)。(4)、“沉钴”中,pH=4时Co2+恰好沉淀完全[c(Co2+)=1×10-5mol·L'],则此时溶液中c(H2S)=mol-1L"。已知:Ka1(H2S)=1x10-7 , Ka2(H2S)=1x10-13 , Ksp(CoS) =4x10-21。
CoS“溶解”时发生反应的离子方程式为
(5)、“沉锰”所得滤液并入“吸收”液中,经处理后所得产品导入(填操作单元名称)循环利用。 -
12、Fe单质及其化合物应用广泛。回答下列问题:(1)、在元素周期表中,Fe位于第周期族。基态Fe原子与基态Fe3+离子未成对电子数之比为(2)、尿素分子(H2NCONH2)与Fe3+形成配离子的硝酸盐[Fe(H2NCONH2)6](NO3)3俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素C,N,O中,第一电离能最大的是 , 电负性最大的是
②尿素分子中,C原子采取的轨道杂化方式为
③八面体配离子[Fe(H2NCONH2)6]3+中Fe3+的配位数为6,碳氮键的键长均相等,则与Fe2+配位的原子是(填元素符号)。
(3)、α-Fe可用作合成氨催化剂、其体心立方晶胞如图所示(晶胞边长为apm)。①α-Fe晶胞中Fe原子的半径为pm。
②研究发现,α一Fe晶胞中阴影所示m,n两个截面的催化活性不同,截面单位面积含有Fe原子个数越多,催化活性越低。m,n截面中,催化活性较低的是 , 该截面单位面积含有的Fe原子为个·pm-2。

-
13、常温下,假设1L水溶液中Co2+和C2O42-初始物质的量浓度均为0.01mol·L-1。平衡条件下,体系中全部四种含碳物种的摩尔分数随pH的变化关系如图所示(忽略溶液体积变化)。
已知:体系中含钴物种的存在形式为Co2+ , CoC2O4(s)和Co(OH)2(s);Ksp (CoC2O4)= 6.0x10°,Ksp[Co(OH)2]=5.9x10-15。
下列说法正确的是( )
 A、甲线所示物种为HC2O4- B、H2C2O4的电离平衡常数Ka2=10-8 C、pH =a时,Co2+物质的量浓度为1.6x10-3mol·L' D、pH=b时,物质的量浓度: c(OH-)<c(C2O42-)
A、甲线所示物种为HC2O4- B、H2C2O4的电离平衡常数Ka2=10-8 C、pH =a时,Co2+物质的量浓度为1.6x10-3mol·L' D、pH=b时,物质的量浓度: c(OH-)<c(C2O42-) -
14、以异丁醛(M)为原料制备化合物Q的合成路线如下,下列说法错误的是( )
 A、M系统命名为2-甲基丙醛 B、若M+X→N原子利用率为100%,则X是甲醛 C、用酸性KMnO4溶液可鉴别N 和Q D、P→Q过程中有CH3COOH生成
A、M系统命名为2-甲基丙醛 B、若M+X→N原子利用率为100%,则X是甲醛 C、用酸性KMnO4溶液可鉴别N 和Q D、P→Q过程中有CH3COOH生成 -
15、 钢渣中富含CaO,SiO2 , FeO,Fe2O3等氧化物,实验室利用酸碱协同法分离钢渣中的Ca,Si,Fe元素,流程如下。已知:Fe2(C2O4),能溶于水; Ksp(CaC2O4)=2.3x10-9 , Kp(FeC2O4)=3.2x10-7。
下列说法错误的是( )
 A、试剂X可选用Fe粉 B、试剂Y可选用盐酸 C、“分离”后Fe元素主要存在于滤液Ⅱ中 D、“酸浸”后滤液Ⅰ的pH过小会导致滤渣Ⅱ质量减少
A、试剂X可选用Fe粉 B、试剂Y可选用盐酸 C、“分离”后Fe元素主要存在于滤液Ⅱ中 D、“酸浸”后滤液Ⅰ的pH过小会导致滤渣Ⅱ质量减少 -
16、全铁液流电池工作原理如图所示,两电极分别为石墨电极和负载铁的石墨电极。下列说法正确的是( )
 A、隔膜为阳离子交换膜 B、放电时,a极为负极 C、充电时,隔膜两侧溶液Fe2浓度均减小 D、理论上,Fe3+每减少1mol,Fe2+总量相应增加2mol
A、隔膜为阳离子交换膜 B、放电时,a极为负极 C、充电时,隔膜两侧溶液Fe2浓度均减小 D、理论上,Fe3+每减少1mol,Fe2+总量相应增加2mol -
17、完成下列实验所用部分仪器或材料选择正确的是( )
实验内容
仪器或材料
A
灼烧海带
坩埚、泥三角
B
加热浓缩NaCl溶液
表面皿、玻璃棒
C
称量5.0gNaOH 固体
电子天平、称量纸
D
量取25.00mL稀H2SO4
25mL移液管、锥形瓶
A、A B、B C、C D、D -
18、在恒容密闭容器中,Na2SiF6(s)热解反应所得固相产物和气相产物均为含氟化合物。平衡体系中各组分物质的量随温度的变化关系(实线部分)如图所示。已知:T2温度时,Na2SiF6(s)完全分解;体系中气相产物在T1T3温度时的分压分别为p1 , p3。下列说法错误的是( )
 A、a线所示物种为固相产物 B、T1温度时,向容器中通入N2 , 气相产物分压仍为p1 C、p3小于T3温度时热解反应的平衡常数Kp。 D、T1温度时、向容器中加入b线所示物种,重新达平衡时逆反应速率增大
A、a线所示物种为固相产物 B、T1温度时,向容器中通入N2 , 气相产物分压仍为p1 C、p3小于T3温度时热解反应的平衡常数Kp。 D、T1温度时、向容器中加入b线所示物种,重新达平衡时逆反应速率增大 -
19、用肼(N2H4)的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量CuSO4 , 反应原理如图所示。下列说法正确的是( )
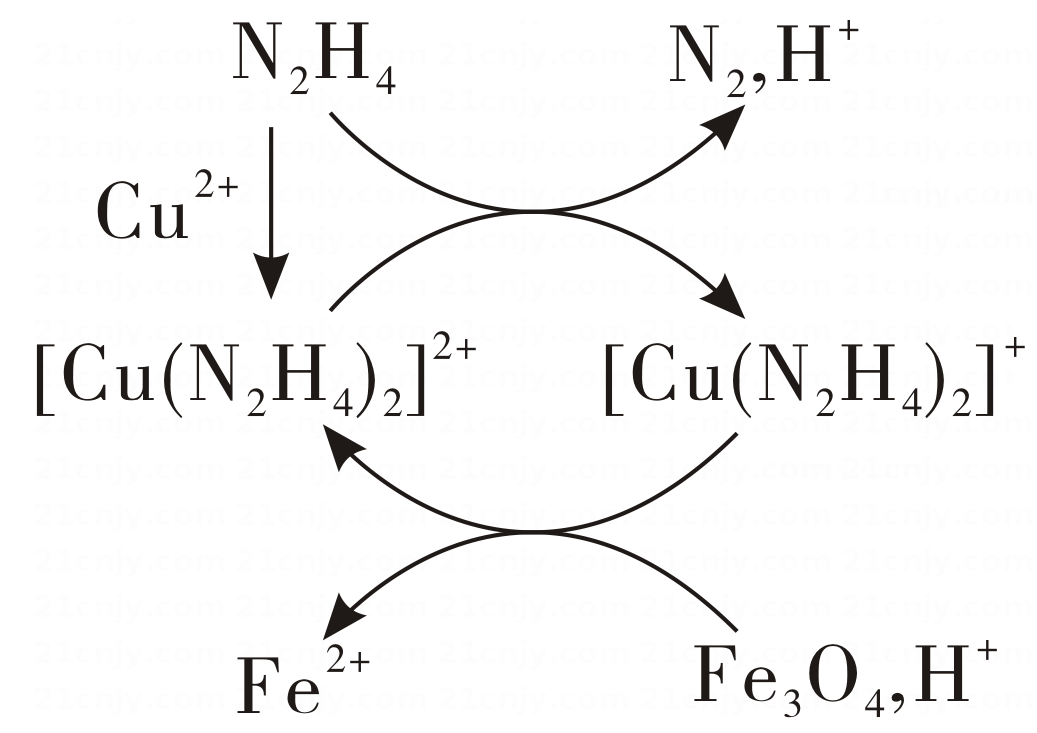 A、N2是还原反应的产物 B、还原性:N2H4<Fe2+ C、处理后溶液的pH增大 D、图示反应过程中起催化作用的是Cu2+
A、N2是还原反应的产物 B、还原性:N2H4<Fe2+ C、处理后溶液的pH增大 D、图示反应过程中起催化作用的是Cu2+ -
20、物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是( )
性质差异
主要原因
A
沸点:H2O>H2S
电离能:O>S
B
酸性:HClO>HBrO
电负性:Cl>Br
C
硬度:金刚石>晶体硅
原子半径:Si>C
D
熔点:MgO>NaF
离子电荷: Mg2+ >Na+ , O2- >F-
A、A B、B C、C D、D