相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、 家庭厨房就是一个化学小世界,“锅碗瓢盆”“柴米油盐”中蕴含着丰富的化学知识。请回答:(1)、下列厨具由不同的材料制成,其中属于金属材料的是____(填字母序号);A、竹制筷子 B、青花瓷碗 C、不锈钢锅 D、塑料洗菜盆(2)、制作蛋炒饭的食材有西红柿、鸡蛋、大米,大米中富含的营养素为;(3)、“加铁酱油”“高钙麦片”等营养强化食品可补充铁、钙等元素,其中属于微量元素的是(填元素符号)。
-
2、 请按要求写出化学符号:(1)、2个铝离子;(2)、3个过氧化氢分子;(3)、草木灰的主要成分为碳酸钾,碳酸钾的化学式为。
-
3、 将一定质量Zn(NO3)2和AgNO3的混合溶液,按如图所示进行实验,现象如图中所述:

分析图中信息进行判断,下列说法合理的是( )
A、滤渣中可能含有单质Zn B、滤渣中一定含有单质Ag、Fe C、滤渣的质量一定小于ag D、滤液中一定含有Mg2+ , Fe2+ , 可能含有Zn2+ -
4、 甲、乙、丙、丁是初中化学常见的不同类别的物质,甲为黑色固体,常温下乙为无色气体,下图中“—”表示相连的两种物质能发生反应。下列说法错误的是( )
 A、甲与CuO发生的反应属于置换反应 B、乙为氧化物 C、丙为碱,可能是Cu(OH)2 D、丙与丁发生的反应属于复分解反应
A、甲与CuO发生的反应属于置换反应 B、乙为氧化物 C、丙为碱,可能是Cu(OH)2 D、丙与丁发生的反应属于复分解反应 -
5、 下列实验设计能达到实验目的的是( )
选项
实验目的
实验设计
A
鉴别N2和CO2
将燃着的木条分别放入两种气体的集气瓶中,观察现象
B
除去Na2CO3固体中混有的少量NaHCO3
将固体充分加热
C
除去NaCl溶液中混有的少量MgCl2
加入过量的KOH溶液,过滤
D
检验溶液中是否含有Cl-
取少量溶液于试管中,滴加AgNO3溶液,观察现象
A、A B、B C、C D、D -
6、 KNO3和KCl在不同温度时的溶解度如表,某实验小组利用其中一种物质(M)进行了如图实验(水蒸发忽略不计):

温度/℃
20
40
60
溶解度/g
31.6
63.9
110
KCl溶解度/g
34
40
45.5
结合图表信息,下列有关分析正确的是( )
A、M物质为KCl B、②中溶液为饱和溶液 C、③中析出固体的质量为24.2g D、溶质的质量分数大小关系为②>③>① -
7、 下列相关图示实验,说法正确的是( )
 A、图1能证明CH4中含有碳元素 B、图2可正确测定白醋的pH C、图3能说明镁和稀盐酸反应放热 D、图4可比较Al、Fe、Cu的金属活动性
A、图1能证明CH4中含有碳元素 B、图2可正确测定白醋的pH C、图3能说明镁和稀盐酸反应放热 D、图4可比较Al、Fe、Cu的金属活动性 -
8、 “84”消毒液于1984年研制成功,其主要成分为次氯酸钠(NaClO),广泛用于杀菌消毒。制取NaClO的反应为 , 则关于物质X的说法错误的是( )A、化学式为NaOH B、俗名为火碱、烧碱 C、工业上可用于造纸、印染等 D、其水溶液能使紫色石蕊试液变红色
-
9、下列化学方程式的书写正确的是( )A、 B、 C、 D、
-
10、 下列实践活动与所对应的化学知识相符合的是( )
选项
实践活动
化学知识
A
向鱼缸中通入空气
O2易溶于水
B
用活性炭制作简易净水器
活性炭具有可燃性
C
用熟石灰改良酸性土壤
熟石灰具有碱性
D
给绿植施NH4NO3营养液
NH4NO3属于复合肥料
A、A B、B C、C D、D -
11、 下列物质的放置或药品的保存方法错误的是( )A、
 B、
B、 C、
C、 D、
D、
-
12、 下列过程涉及化学变化的是( )A、蒸馏淡化海水 B、黏土烧制陶瓷 C、蚕丝织成锦缎 D、液氮冷藏血液
-
13、某化学小组用如图所示装置,探究CO2与NaOH固体的反应。实验步骤如下:

Ⅰ.组装实验仪器,检查装置的气密性,添加药品;调节三通阀1,关闭三通阀2,将稀硫酸注入注射器2内,关闭三通阀1;
Ⅱ.……,将注射器2中气体推入注射器3,关闭三通阀2;
Ⅲ.调节三通阀2、3,将注射器3中气体推入注射器4,关闭三通阀3;一段时间后,观察到注射器4活塞上移,固体粉末成浆糊状,注射器4外壁有灼热感。
回答下列问题:
(1)、将步骤Ⅱ的操作补充完整。(2)、注射器3中棉花包裹的无水氯化钙的作用是。(3)、步骤Ⅲ中注射器4外壁有灼热感,说明反应过程中放出大量的热。小组同学对放出热量的可能原因进行探究(不考虑注射器活塞与内壁的摩擦和CO2溶于水的热量变化)。【作出猜想】
猜想1:CO2与NaOH反应放热;
猜想2:。
(4)、【实验过程】设计实验验证猜想1:是否成立:。
(5)、小组同学对步骤Ⅲ注射器4中得到的浆糊状物质除水外的成分进行探究。查阅资料知,Na2CO3可发生如下反应:Na2CO3+CO2+H2O=2NaHCO3 , 稀溶液中NaHCO3与CaCl2不反应。【作出猜想】
猜想1:①;
猜想2:只有Na2CO3;
猜想3:含有Na2CO3与NaHCO3;
猜想4:只有NaHCO3。
(6)、【实验过程】取浆糊状物质溶于水配成稀溶液,取一定量溶液于试管中,向试管中滴加CaCl2稀溶液,有白色沉淀生成;继续滴加CaCl2溶液至过量,静置,取上层清液于两支试管中,向试管1中加入盐酸,无气泡产生;向试管2中加入②(填试剂名称),观察到③现象,证明猜想1成立。
(7)、【评价反思】甲同学认为无须经实验即可判断猜想4不成立,理由是④。
-
14、某融雪剂的主要成分为NaCl,还含有少量的CaCl2。为测定该融雪剂中NaCl的质量分数,化学兴趣小组进行以下实验:取40.0g融雪剂样品于烧杯中,加入160.0g蒸馏水使固体完全溶解;取100.0g所得溶液,逐滴加入一定质量分数的Na2CO3溶液,生成沉淀的质量与滴加Na2CO3溶液的质量关系如图所示。
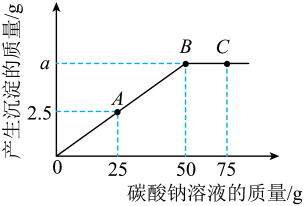
回答下列问题:
(1)、C点对应溶液的溶质是(填化学式)。(2)、a=。(3)、融雪剂样品中NaCl的质量分数(写出计算过程,结果精确到0.1%)。 -
15、硫酸锌在防腐、医疗等方面用途广泛。一种由菱锌矿(主要成分是ZnCO3 , 含有少量的Fe2O3和SiO2等)制备硫酸锌的工艺流程如图所示。

已知:SiO2不溶于水,与硫酸、盐酸等酸均不反应。
回答下列问题:
(1)、菱锌矿预先粉碎处理,主要目的是。(2)、实验室中进行“操作Ⅰ”用到的玻璃仪器有烧杯、漏斗和。(3)、溶液A中含有的金属阳离子是(用化学符号表示)。(4)、“转化”过程发生的主要反应如下,请将化学方程式补充完整。Zn+=ZnSO4+;
Zn+FeSO4=ZnSO4+Fe
(5)、其他条件相同时,不同温度下硫酸锌溶液结晶析出产物如图所示。溶液B经过蒸发浓缩、、过滤、洗涤得到ZnSO4·7H2O。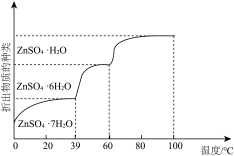 (6)、查阅资料知,ZnSO4·7H2O在加热条件下发生反应 , 温度不同,产物不同。取57.4gZnSO4·7H2O,加热至一定温度,充分反应后固体质量为35.8g,则最终所得含锌产物的化学式是。(已知ZnSO4·7H2O的相对分子质量为287)
(6)、查阅资料知,ZnSO4·7H2O在加热条件下发生反应 , 温度不同,产物不同。取57.4gZnSO4·7H2O,加热至一定温度,充分反应后固体质量为35.8g,则最终所得含锌产物的化学式是。(已知ZnSO4·7H2O的相对分子质量为287) -
16、金属铝在现代工业生产和生活中应用广泛。某兴趣小组从不同角度对铝的知识进行建构。
Ⅰ.铝的原子结构
(1)、图1为铝原子的结构示意图,能量最高的电子在第层,铝原子在化学反应中容易(填“得到”或“失去”)电子。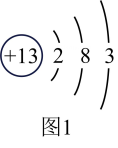 (2)、Ⅱ.铝的性质
(2)、Ⅱ.铝的性质将未经打磨的铝箔放入盛有足量稀硫酸的密闭容器中,用压强传感器测得容器内压强随反应时间变化曲线如图2。AB段发生反应的化学方程式是 , CD段容器内压强减小的原因是。
 (3)、将铝片插入CuSO4溶液中,一段时间后,观察到铝片表面析出一层红色物质,同时溶液颜色变浅,发生反应的化学方程式是。图3是该反应的微观示意图,请用文字描述该反应的微观实质。(4)、Ⅲ.铝的应用
(3)、将铝片插入CuSO4溶液中,一段时间后,观察到铝片表面析出一层红色物质,同时溶液颜色变浅,发生反应的化学方程式是。图3是该反应的微观示意图,请用文字描述该反应的微观实质。(4)、Ⅲ.铝的应用Al粉和Fe2O3高温下发生反应: , 可用于制备金属纳米复合材料,该反应属于(填基本反应类型)。
-
17、化学链气化、燃烧技术,在实现能源的绿色高效利用方面有着重要的作用(化学链指的是将复杂的总反应分解为多个子反应)。回答下列问题:
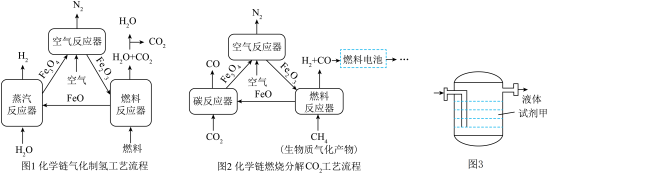
Ⅰ.化学链气化制氢
(1)、燃料反应器中,Fe2O3与燃料反应生成FeO,FeO中Fe的化合价是。(2)、蒸汽反应器排出的气体混合物,可利用不同直接分离,也可将混合气体通过图3所示洗气装置获得纯净的H2 , 则试剂甲是(填试剂名称)。(3)、Ⅱ.化学链燃烧分解CO2碳反应器中温度为800℃,发生反应的化学方程式是。与传统燃料燃烧方式相比,化学链燃烧反应的优点是(答一条即可)。
(4)、CO和H2可作为燃料电池的反应物。经生物质气化反应、化学链燃烧和燃料电池反应,将生物质能最终转化为。(5)、假设化学链燃烧反应中每步反应均完全,发生反应的CH4和CO2的分子个数比为3:2,则理论上最终得到H2和CO的质量比是。 -
18、实验是科学探究的重要形式。跨学科实践活动小组对氧气和二氧化碳的制取与性质进行如下实验。回答下列问题:
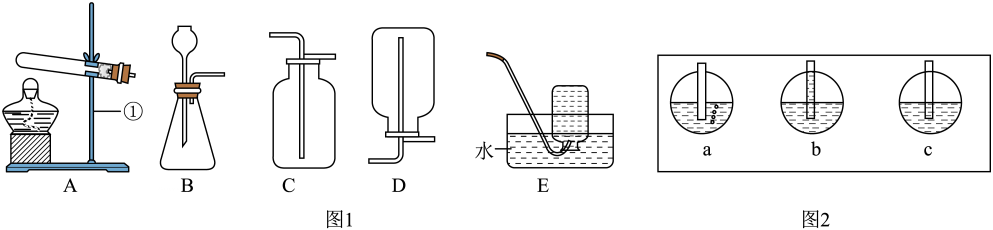
任务一:氧气的制取与性质探究
(1)、仪器①的名称是;在检查装置A的气密性时,若气密性良好,则导管末端先后出现的现象是(选填图2中序号)。(2)、实验室用过氧化氢制取氧气。①配制36.0g溶质质量分数为5%的过氧化氢溶液,需要量取30%的过氧化氢溶液(密度为1.1g/cm3)的体积是mL。
②用图1所示装置制取并收集一瓶纯净的氧气,应选择的实验装置组合为(填序号),发生装置内反应的化学方程式是。
(3)、图3为测定空气中氧气含量的改进装置。向生石灰中滴加水,一段时间后,试管内的白磷开始燃烧,待反应完全并冷却至室温后打开弹簧夹,观察到注射器的变化是。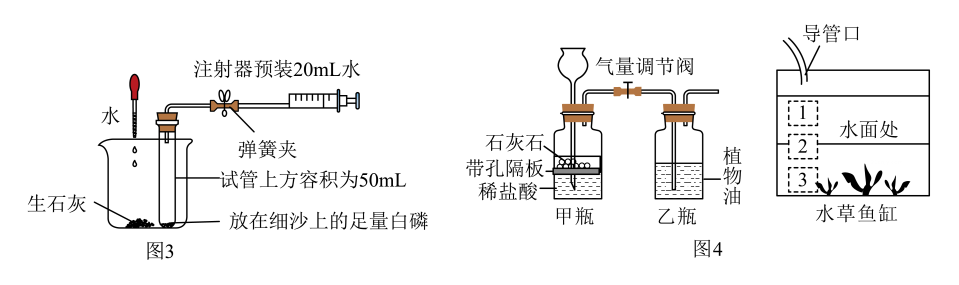
任务二:二氧化碳自动补给装置的制作
(4)、小组同学设计了水草鱼缸的二氧化碳自动补给装置如图4所示。下列说法错误的是____(填序号)。A、乙瓶中的水既可以净化二氧化碳,也可以观察二氧化碳的产生速率 B、乙瓶中溶液的pH逐渐增大 C、为使水草更好地生长,导管口应置于水草鱼缸内“2”处 D、在光照下,水草鱼缸内能实现动植物生存所需要的碳氧循环 -
19、近年来,我国航天工程取得许多重大成就。回答下列问题:
Ⅰ.航天材料
(1)、航天员舱外航天服使用了一种聚氨酯橡胶材料,聚氨酯橡胶属于(填“无机非金属”或“有机合成”)材料。(2)、钛合金常用作航天器的外壳材料。钛合金的下列性质与上述用途无关的是____(填序号)。A、密度小 B、熔点高 C、与人体具有很好的相容性 D、抗腐蚀性能好(3)、Ⅱ.航天能源高氯酸铵(NH4ClO4)是固体运载火箭的主要推进剂,其分解反应的化学方程式为 , 则X的化学式是。
(4)、长征二号F运载火箭的推进剂用到液氢、液氧。液氢作为能源具有的优势是(答一条即可)。(5)、Ⅲ.航天保障航天员在空间站需要食用不同形式的水果、蔬菜,以保证(填营养物质名称)的摄入。在种植绿叶蔬菜时,发现叶片发黄,需要施用富含(填一种营养元素符号)的化肥。
(6)、我国空间站运用自主研发的“再生生保系统”,有效保障航天员的太空生存,其中一个子系统反应的微观示意图如下,该反应的化学方程式是。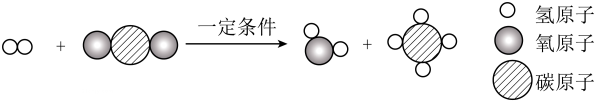
-
20、向一定质量的MgCl2、FeCl2和CuCl2混合溶液中加入Zn粉,过滤后,再向滤渣中加入稀硫酸,反应过程中部分生成物的质量与加入锌粉或稀硫酸的质量的关系如图所示。下列说法正确的是( )
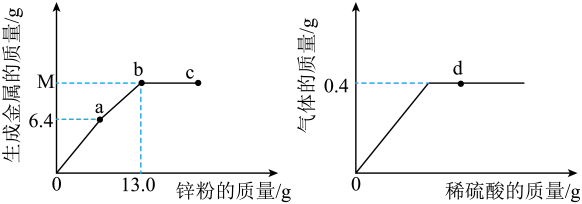 A、从0点到a点,溶液的质量不断增大 B、c点对应的溶液中只含一种溶质 C、与稀硫酸反应的锌粉的质量是5.6g D、b点固体与d点对应溶液中的固体组成不同
A、从0点到a点,溶液的质量不断增大 B、c点对应的溶液中只含一种溶质 C、与稀硫酸反应的锌粉的质量是5.6g D、b点固体与d点对应溶液中的固体组成不同