相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、下列实验不能达到实验目的是( )
选项
A
B
C
D
实验方案

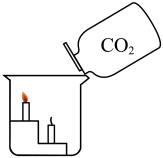
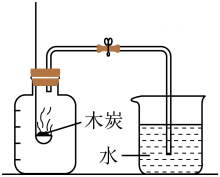
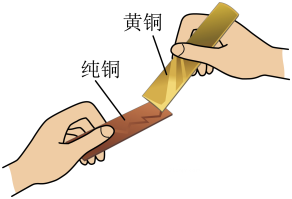
实验目的
探究铁钉生锈的条件
探究CO2的部分性质
测定空气中O2的体积分数
比较合金和纯金属的硬度
A、A B、B C、C D、D -
2、下列除杂和鉴别方案合理的是( )
选项
实验目的
方案
①
鉴别实验室的蔗糖和食盐
品尝味道
②
除去CO气体中少量 CO2
通过灼热的 CuO
③
除去NaOH溶液中少量Ca(OH)2
加入过量Na2CO3溶液,过滤
④
鉴别 NaCI和 NH4NO3
加水溶解,测量温度
A、A B、B C、C D、D -
3、人体摄入锌不足会引起多种疾病,缺锌者可在医生指导下通过服用葡萄糖酸锌口服液来补锌,已知葡糖糖酸锌的化学式为C12H22O14Zn,下列说法正确的是( )A、锌属于常量元素 B、葡萄糖酸锌中氢元素的质量分数最大 C、葡萄糖酸锌由碳、氢、氧、锌四种原子构成 D、葡萄糖酸锌中碳、氧元素质量比为9:14
-
4、铟在元素周期表中的信息及原子结构示意图如图所示,下列说法正确的是( )
 A、x 的数值为3 B、铟原子中子数为49 C、铟的相对原子质量为114.8g D、铟属于非金属元素
A、x 的数值为3 B、铟原子中子数为49 C、铟的相对原子质量为114.8g D、铟属于非金属元素 -
5、“宏微结合”是化学学科的重要思想之一。下列宏观事实的微观解释错误的是( )
选项
宏观事实
微观解释
A
水烧开把壶盖冲开
温度升高,分子变大
B
警犬搜救地震中被困人员
分子在不停运动
C
金刚石作钻头,石墨作润滑剂
碳原子排列方式不同
D
氧气和氢气的化学性质不同
分子种类不同
A、A B、B C、C D、D -
6、传统制作豆腐的主要流程如下:
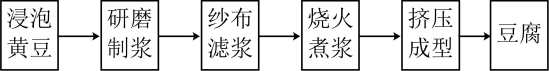
该流程中涉及化学变化的是( )
A、研磨制浆 B、纱布滤浆 C、烧火煮浆 D、挤压成型 -
7、测定土壤酸碱性实验中,下列操作正确的是( )A、取样
 B、取水
B、取水 C、溶解
C、溶解 D、测pH
D、测pH
-
8、下图为国家颁布的“城市生活垃圾分类标志”,废弃矿泉水塑料瓶应投人到贴有哪种标志的垃圾箱( )A、
 B、
B、 C、
C、 D、
D、
-
9、过氧化氢溶液在医疗上可用于消毒防腐。将某过氧化氢溶液样品100g
与2g二氧化锰在烧杯中混合,发生反应:。过氧化氢完全反应后,测得烧杯中物质的总质量为101.2g(不考虑水的蒸发)。请完成下列分析及计算:
(1)、该反应属于反应(填基本反应类型)。(2)、过氧化氢完全反应生成氧气的质量为g。(3)、求过氧化氢溶液样品中溶质的质量分数(写出计算过程)。 -
10、我们学习过稀盐酸的化学性质:能使紫色石蕊溶液变红,能与铝反应,能除去铁锈。那么,稀硫酸是否与稀盐酸具有相似的化学性质?实验小组就此开展了以下探究。
【提出猜想】
猜想一:稀硫酸也能使紫色石蕊溶液变红
猜想二:稀硫酸也能与铝反应
猜想三:稀硫酸也能除去铁锈
【实验准备】实验室现有溶质质量分数为98%的浓硫酸,要把100g上述浓硫酸稀释成溶质质量分数为9.8%的稀硫酸,需要水的质量是①g。
【实验验证】实验组别
实验1
实验2
实验3
实验操作



向稀硫酸中滴入紫色石蕊溶液
向装有打磨后的铝条
的试管中滴入稀硫酸
向装有生锈铁钉的试
管中滴入稀硫酸
实验现象
溶液变②色
有③产生
铁锈消失
实验结论
猜想一正确
猜想二正确
猜想三④
【拓展提升】
请将下面的化学反应方程式补充完整:
Fe2O3+⑤H2SO4=Fe2(SO4)3+3⑥
-
11、某兴趣小组用锌粒和稀硫酸制取干燥的氢气,实验装置如图4所示。
 (1)、锌和稀硫酸反应的化学方程式为。(2)、试剂Q的作用是干燥氢气,则试剂Q为。(3)、实验中以下操作正确的是____。A、用向上排空气法收集氢气 B、长颈漏斗下端伸入液面下 C、把鼻孔凑到试管口闻气体气味
(1)、锌和稀硫酸反应的化学方程式为。(2)、试剂Q的作用是干燥氢气,则试剂Q为。(3)、实验中以下操作正确的是____。A、用向上排空气法收集氢气 B、长颈漏斗下端伸入液面下 C、把鼻孔凑到试管口闻气体气味 -
12、合理开发、利用和回收资源,促进人与自然和谐共生。实验室对刻蚀电路板产生的废液进行回收再利用,流程如下。
 (1)、操作X的名称是。(2)、试剂M的名称是。(3)、流程中加入的铁粉是否过量?(填“是”或“否”)(4)、废液中除含氢、氧和铁元素外,一定还含和两种元素。
(1)、操作X的名称是。(2)、试剂M的名称是。(3)、流程中加入的铁粉是否过量?(填“是”或“否”)(4)、废液中除含氢、氧和铁元素外,一定还含和两种元素。 -
13、为了探究水的组成,某合作学习小组按如图装置进行电解水实验。通电后,管a、管b中均有气体产生。
 (1)、管a中的气体在氧气中燃烧只生成水,则该气体是。(2)、管b中的气体能使带火星的木条复燃,则该气体是。(3)、结合上述实验,你认为组成水的元素是(填元素符号)。(4)、水是宝贵的自然资源,而地球上可用的淡水资源是有限的,你认为可行的节约用水的做法有(写一条即可)。
(1)、管a中的气体在氧气中燃烧只生成水,则该气体是。(2)、管b中的气体能使带火星的木条复燃,则该气体是。(3)、结合上述实验,你认为组成水的元素是(填元素符号)。(4)、水是宝贵的自然资源,而地球上可用的淡水资源是有限的,你认为可行的节约用水的做法有(写一条即可)。 -
14、阅读科普材料,用所学化学知识回答下列问题。

车厘子,属于蔷薇科李属乔木。车厘子树是喜光、喜温、喜湿的果树品种,生长环境对它来说极为重要。它倾向于生长在土层深厚、土质疏松、透气性好的砂壤土或砾质壤土之中,且土壤pH值需控制在5.6~7之间。
车厘子的甜蜜口感源于多种糖类,涵盖果糖、葡萄糖和蔗糖。食用车厘子可补充一定量锌元素、钾元素和铁元素。车厘子中的碳水化合物,能为人体提供能量,是补充体力的优质来源。车厘子中还含有人体必需的多种氨基酸、膳食纤维和多种维生素……
(选自《化学通讯》2025第6期,有删改)
(1)、pH=5.6的土壤呈性(填“酸”或“碱”)。(2)、铁元素是血红蛋白的重要成分,人体缺铁会引起。(3)、葡萄糖(在人体内经酶催化,与氧气反应生成二氧化碳和水,该反应的化学方程式为。(4)、种植车厘子应考虑的条件有光照、、湿度等。 -
15、唐代白居易《卖炭翁》一诗中的“炭”指木炭,主要成分是碳单质。(1)、碳的元素符号为。(2)、诗中“心忧炭贱愿天寒”,侧面反映出木炭燃烧会热量(填“放出”或“吸收”)。(3)、木炭燃烧需要的条件:①氧气(或空气);②达到。(4)、碳单质完全燃烧生成的气体为 , 该气体与温室效应有关,利用和封存该气体对绿色低碳有重要意义。
-
16、某化学兴趣小组从表1中选择一种物质X,进行图2所示实验(温度保持40℃,不考虑水分蒸发)。下列说法正确的是( )
表1 KCl和KNO3在不同温度时的溶解度
温度/℃
0
10
20
30
40
50
60
70
80
溶解度/g
KCl
27.6
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
 A、物质X为KNO3 B、烧杯②中溶液为不饱和溶液 C、烧杯②和③的溶液中溶质的质量分数相同 D、20℃时,KCl的溶解度小于KNO3的溶解度
A、物质X为KNO3 B、烧杯②中溶液为不饱和溶液 C、烧杯②和③的溶液中溶质的质量分数相同 D、20℃时,KCl的溶解度小于KNO3的溶解度 -
17、我国传统工艺“湿法炼铜”涉及反应:由该反应可知,铁和铜的金属活动性强弱关系是( )A、Fe>Cu B、Fe<Cu C、Fe=Cu D、无法判断
-
18、化学符号是不断演化的,用字母表示的化学符号便于记忆和书写。下列选项中表示离子的是( )A、Fe B、O2 C、CuO D、Na+
-
19、化学与生产生活密切相关。下列表述不正确的是( )A、氢能属于可再生的新能源 B、人体健康与营养物质摄入量无关 C、鉴别棉花与羊毛可用灼烧的方法 D、环境问题的解决需要化学与其他学科共同参与
-
20、某玉石成分中含Al2O3 , 其中O的化合价为-2价,则Al的化合价是( )A、+2 B、-2 C、+3 D、-3