相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、怀化靖州杨梅远近闻名,富含维生素、糖类等营养物质,其中维生素C(C6H8O6)具有美白养颜等功效。下列关于维生素C说法正确的是( )A、维生素C是由6个碳原子、8个氢原子和6个氧原子构成 B、维生素C是氧化物 C、维生素C中碳元素质量分数为12% D、维生素C是由碳元素、氧元素和氢元素组成
-
2、下列实验现象中,描述正确的是A、木炭在空气中燃烧发出白光 B、硫在氧气中燃烧,发出蓝紫色火焰,生成刺激性气味的气体 C、镁在空气中燃烧,生成白色氧化镁固体 D、铁丝在空气中剧烈反应,火星四射,生成白色固体,放出大量热
-
3、下列实验基本操作正确的是A、
 B、
B、 C、
C、 D、
D、
-
4、中华人民共和国成立 70 周年,举国欢庆。下列活动主要发生化学变化的是( )A、
 升国旗
B、
升国旗
B、 燃放烟花
C、
燃放烟花
C、 同唱国歌
D、
同唱国歌
D、 放飞气球
放飞气球
-
5、窑番薯是一种利用泥土窑的余热焖烤番薯的传统做法,过程可简要概括为以下步骤:搭建土窑→烧制窑体→投放番薯→密封焖烤→取出食用→熄灭余火。在此过程中,下列说法错误的是
 A、搭窑时泥块间留空隙,确保空气流通 B、烧窑时将木柴架空,增大木柴与空气的接触面积 C、烧窑时窑顶会出现炭黑,这是因为泥土能燃烧,生成黑色物质 D、熄灭余火时用泥土覆盖在余火和灰烬上,隔绝氧气使火熄灭
A、搭窑时泥块间留空隙,确保空气流通 B、烧窑时将木柴架空,增大木柴与空气的接触面积 C、烧窑时窑顶会出现炭黑,这是因为泥土能燃烧,生成黑色物质 D、熄灭余火时用泥土覆盖在余火和灰烬上,隔绝氧气使火熄灭 -
6、下列物质能在空气中剧烈燃烧,发出耀眼白光的是A、铁丝 B、蜡烛 C、镁条 D、木炭
-
7、运动后,同学们喝电解质水可补充“钠”、“镁”等,其中的“钠”、“镁”指的是A、原子 B、分子 C、元素 D、单质
-
8、五颜六色的霓虹灯中填充的气体是A、稀有气体 B、氧气 C、二氧化碳 D、氮气
-
9、能源利用和环境保护是人类共同关注的问题。(1)、目前人们使用的化石燃料都是复杂的混合物,燃烧会产生多种产物,其中会造成酸雨的主要物质是_______(填序号)。A、甲烷和一氧化碳 B、二氧化硫和一氧化碳 C、一氧化碳和二氧化碳 D、二氧化硫和二氧化氮(2)、为控制二氧化碳对环境的影响,要力争实现二氧化碳的排放量等于二氧化碳的吸收量。二氧化碳的吸收方式有“自然吸收”和“人工转化”,“自然吸收”的途径之一是“海水吸收”,其涉及的原理包括水与二氧化碳的反应,其化学方程式为;“人工转化”的方法之一是在一定条件下将二氧化碳与氢气反应,产生甲醇(CH3OH)和水,写出该反应的化学方程式。
-
10、馒头作为我国传统主食之一,历史悠久,可追溯至西晋时期,《饼赋》中最早记载了“曼头”。
小明妈妈在做馒头时,将双效泡打粉加入水中,产生大量气泡。小明很好奇,与小组同学一起开展实验活动。
【查阅资料】双效泡打粉配料表中含有碳酸氢钠、焦磷酸二氢二钠、碳酸钙等物质。
活动一:探究气体成分
【猜想】该气体为二氧化碳。
【设计实验】如图1
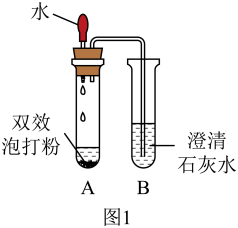
【实验现象】
(1)、B试管中观察到的现象为该反应的化学方程式为
【实验结论】双效泡打粉加入水中产生的气体是二氧化碳。
【反思交流】(2)、①和面时,为了防止较多二氧化碳逸出面团,应将双效泡打粉先与混合(选填“面粉”或“水”)。②双效泡打粉保存时应注意
③焦磷酸二氢二钠可能呈酸性。
活动二:验证焦磷酸二氢二钠溶液的酸性。【设计实验】如图2
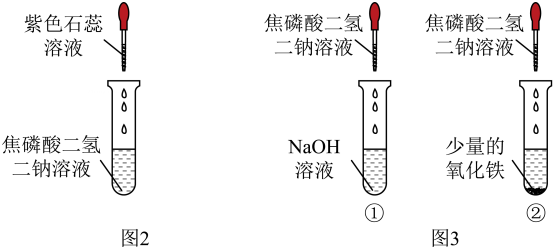
【实验现象】
(3)、图2试管中现象为。
【实验结论】焦磷酸二氢二钠溶液呈酸性。【继续实验】如图3
【实验现象】试管①和试管②都没有观察到明显现象。
【反思交流】
(4)、小明同学认为应该在氢氧化钠溶液中先加入试剂,通过观察溶液颜色变化也能证明焦磷酸二氢二钠溶液呈酸性。(5)、试管②中无明显现象的原因可能是(6)、除上述所用试剂外,还可以选择物质,也可证明焦磷酸二氢二钠溶液呈酸性。 -
11、某化工厂排出的废水中含有CuCl2和HCI。向IL废水中加入生石灰或石灰石调节废水的pH,利用传感器测得废水的pH随加入固体质量的变化如图所示:
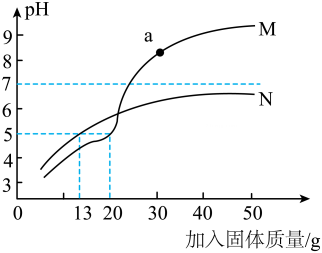
(查阅资料:CuCl2溶液呈酸性)
(1)、曲线M加入的固体是(填“生石灰”或“石灰石”)。(2)、曲线N加入13g固体与曲线M加入g固体效果相当。(3)、a点所示溶液中的溶质为。 -
12、请结合下列实验装置图回答问题:
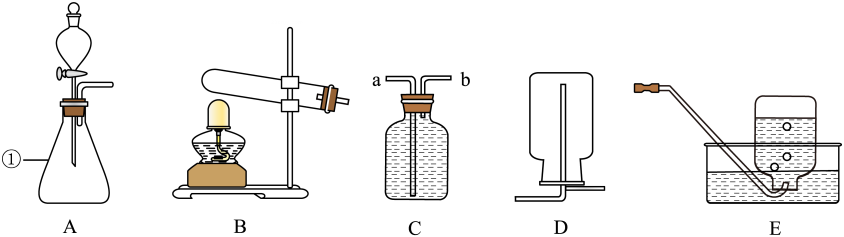 (1)、仪器①的名称(2)、连接装置B、E制取氧气,若水槽中出现紫红色,可能缺少的操作是(3)、用过氧化氢溶液与二氧化锰制取氧气应选用的发生装置是(填字母),该反应的化学方程式为。若用装置C收集氧气,气体应从端通入(填“a”或“b”)。
(1)、仪器①的名称(2)、连接装置B、E制取氧气,若水槽中出现紫红色,可能缺少的操作是(3)、用过氧化氢溶液与二氧化锰制取氧气应选用的发生装置是(填字母),该反应的化学方程式为。若用装置C收集氧气,气体应从端通入(填“a”或“b”)。 -
13、废旧手机中含有一定量的铝、铜、金等金属。从废旧手机中回收金和制取硫酸铜溶液流程如下:
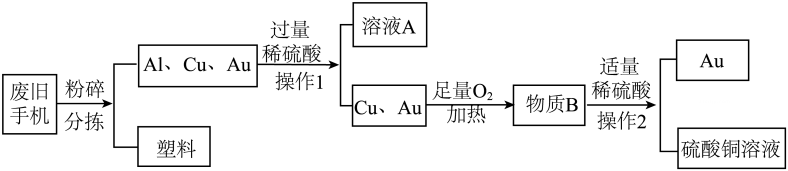 (1)、塑料属于(填序号)。
(1)、塑料属于(填序号)。①金属材料
②有机合成材料
③无机非金属材料
(2)、操作1中玻璃棒的作用是(3)、向物质B中加入稀硫酸,发生反应的化学方程式为 , 其基本反应类型为(4)、“曾青得铁化为铜”,铁和硫酸铜溶液反应可用于湿法炼铜。工业用100吨质量分数为16%的硫酸铜溶液最多可炼出多少吨铜?(利用化学方程式计算,写出计算过程)。 -
14、选用下图所示仪器配制50g溶质质量分数为6%的氯化钠溶液。
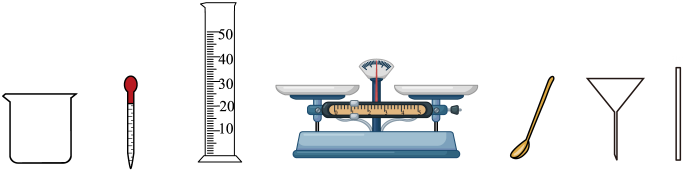 (1)、配制过程中上图不会用到的一种仪器是(填仪器名称)。(2)、下列会导致所配溶液溶质质量分数偏大的是(填序号)。
(1)、配制过程中上图不会用到的一种仪器是(填仪器名称)。(2)、下列会导致所配溶液溶质质量分数偏大的是(填序号)。①量水时仰视读数
②食盐中含杂质
③所用砝码生锈
(3)、将50g质量分数为6%的氧化钠溶液稀释成3%的氢化钠溶液,需加水g。 -
15、根据微观示意图回答下列问题:
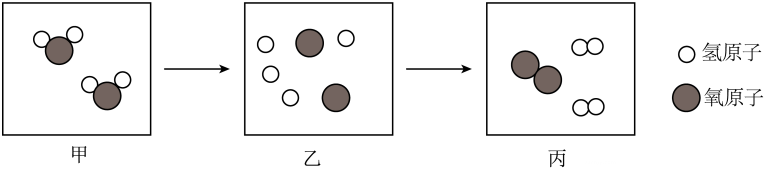 (1)、该反应前后发生变化的微粒是(2)、图丙中表示的物质属于(选填“纯净物”或“混合物”)。
(1)、该反应前后发生变化的微粒是(2)、图丙中表示的物质属于(选填“纯净物”或“混合物”)。 -
16、如图是几种营养强化食品,回答下列问题:
 (1)、图中“钙”和“铁”指(填序号)。
(1)、图中“钙”和“铁”指(填序号)。①元素
②离子
③原子
(2)、食盐中添加KIO3可预防甲状腺肿大,KIO3中碘元素的化合价为 -
17、一定温度下,向agMgCl2溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如右图所示。下列叙述错误的是( )
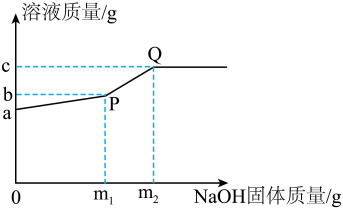 A、MgCl2反应完全时消耗NaOH固体质量为m1g B、m2=c-a C、Q点对应的溶液中NaOH达到饱和状态 D、MgCl2反应完全时生成Mg(OH)2的质量为(m1+a-b) g
A、MgCl2反应完全时消耗NaOH固体质量为m1g B、m2=c-a C、Q点对应的溶液中NaOH达到饱和状态 D、MgCl2反应完全时生成Mg(OH)2的质量为(m1+a-b) g -
18、Ca(OH)、KNO,的溶解度曲线如下图所示,下列说法正确的是( )
 A、Ca(OH)2溶解度比KNO,溶解度大 B、40℃C时,将0.14gCa(OH)2溶解在100g水中,溶质质量分数为0.14% C、40C时,将Ca(OH)2的饱和溶液升温至60C后仍为饱和溶液 D、60C时,将110gKNO3溶于100g水所形成的溶液无法再溶解Ca(OH)2
A、Ca(OH)2溶解度比KNO,溶解度大 B、40℃C时,将0.14gCa(OH)2溶解在100g水中,溶质质量分数为0.14% C、40C时,将Ca(OH)2的饱和溶液升温至60C后仍为饱和溶液 D、60C时,将110gKNO3溶于100g水所形成的溶液无法再溶解Ca(OH)2 -
19、用氧气传感器测量蜡烛在密闭容器内燃烧至熄灭过程中,容器内氧气含量的变化如图所示:
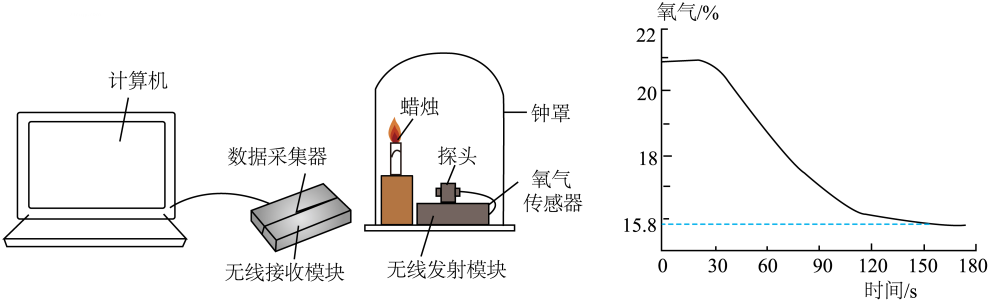
下列分析错误的是( )
A、蜡烛熄灭时钟罩内O2的体积分数为15.8% B、蜡烛在60s时比90s时燃烧更旺 C、用干粉灭火器灭火降低了可燃物周围O2的浓度 D、油锅着火用锅盖盖灭后,锅内氧气完全被消耗 -
20、归纳总结是化学学习的常用方法。下列归纳总结完全正确的是( )
A. 化学与健康
B.化学与生活
①运动员喝葡萄糖口服液可以补充能量
②青少年食用含铁元素丰富的食物,能有效预防坏血病
①用灼烧法可以鉴别羊毛和涤纶
②用熟石灰改良酸性土壤
C.化学与安全
D.化学与环境
①点燃可燃性气体前必须验纯,防止爆炸
②稀释浓硫酸,将水注人浓硫酸中并不断搅拌
①植树造林可以有效减缓温室效应
②为了防止水体污染,农业生产中禁止使用农药、化肥
A、A B、B C、C D、D