相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、图1是兴趣小组在测定空气中氧气含量实验时,用数字压强传感器来测定广口瓶中的压强变化,测定的压强随时间变化如图2所示。则下列分析正确的是
 A、a到b是因为反应产生气体导致压强增大 B、b到c是因为反应后气体被水吸收了导致压强减小 C、c点表示冷却至室温后打开止水夹 D、若装置漏气,则b、c两点的压强都会偏小
A、a到b是因为反应产生气体导致压强增大 B、b到c是因为反应后气体被水吸收了导致压强减小 C、c点表示冷却至室温后打开止水夹 D、若装置漏气,则b、c两点的压强都会偏小 -
2、化学用语是国际通用语言,是学习化学的重要工具。下列化学用语中,有关数字“2”的说法
正确的是
a.2H b.Mg2+ c.2OH- d.CO2 e.2NH3 f.
A、表示离子所带电荷数的是b和f B、表示离子个数的是b和c C、表示分子中原子个数的是d D、表示分子个数的是a和e -
3、化学学科核心素养的重要组成部分有“证据推理与模型认知”。下列推理合理的是A、化学反应一定有新物质生成,所以有新物质生成的反应一定是化学反应 B、化合反应生成物质只有一种,所以有一种物质生成的反应是化合反应 C、催化剂可以加快化学反应速率,所以任何化学反应都需要催化剂 D、稀有气体可以做保护气,所以做保护气的气体一定是稀有气体
-
4、括号内是鉴别下列各组物质的试剂或方法,不正确的是A、氧气与氮气(燃着的木条) B、木炭与四氧化三铁(观察颜色) C、空气与二氧化碳(澄清石灰水) D、水与过氧化氢溶液(少量二氧化锰粉末)
-
5、在下列变化中,既属于化合反应,又属于氧化反应的是A、 B、 C、 D、
-
6、如图A、B、C、D是四种粒子的结构示意图,下列说法错误的是
 A、A中x的值为2 B、B形成的离子符号为 C、C是非金属元素的原子 D、A、D为同种元素
A、A中x的值为2 B、B形成的离子符号为 C、C是非金属元素的原子 D、A、D为同种元素 -
7、下列实验操作正确的是A、检验氧气是否集满
 B、滴加液体
B、滴加液体 C、加热液体
C、加热液体 D、检查装置气密性
D、检查装置气密性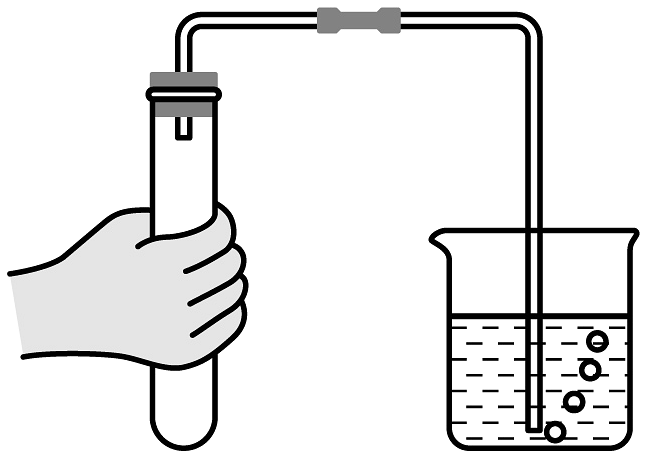
-
8、2024年10月30日4时27分,神舟十九号载人飞船搭载三名航天员,由长征二号十九火箭从我国酒泉卫星发射中心发射升空,发射取得圆满成功。火箭在升空过发生的下列变化属于化学变化的是A、点火起飞 B、冷水受热汽化 C、整流罩脱落 D、隔热材料熔化
-
9、实验是学习和研究化学的重要途径。
 (1)、甲实验为某同学探究氧气的化学性质,回答下列问题。
(1)、甲实验为某同学探究氧气的化学性质,回答下列问题。①图中夹持木炭的仪器叫。
②图中将烧红的木炭,由瓶口缓缓插入盛氧气的集气瓶中,这样做的目的是。
③图中倒入澄清石灰水后看到的实验现象是。
(2)、装置乙可进行电解水的实验。此实验可以得出水是由组成的;在使用a试管内气体前,从实验安全的角度考虑,应该首先进行的操作是;b试管内气体的化学性质是(写出一条即可)。(3)、利用装置丙,我们可以探究化学反应前后物质的质量关系。①该装置不能验证质量守恒定律,请说明理由。
②用微粒的观点解释质量守恒定律。
(4)、2015年中国科学家屠呦呦发现的青蒿素(C15H22O5)荣获了诺贝尔奖,回答下列问题:①求出青蒿素相对分子质量(写出计算步骤,并求出结果)。
②14.1g青蒿素中含O元素质量。
-
10、在实验室里可以采用多种方法制取氧气。
 (1)、A和B均可以制取氧气,与A相比较,B装置中活塞(开关)的主要作用是什么?(2)、实验室也可用C装置制取氧气,其反应的方程式是 , 用D装置来收集氧气,请将收集装置补画完整。
(1)、A和B均可以制取氧气,与A相比较,B装置中活塞(开关)的主要作用是什么?(2)、实验室也可用C装置制取氧气,其反应的方程式是 , 用D装置来收集氧气,请将收集装置补画完整。 -
11、某小组设计如图所示的两个实验来探究分子运动。
 (1)、实验一可以观察到的现象是 , 该实验的结论是。(2)、同学们通过实验发现,两个实验均有明显的现象,都能得出结论达到实验目的。但同学们一致认为实验二更好,请你写出实验二的优点(写出一点即可)。
(1)、实验一可以观察到的现象是 , 该实验的结论是。(2)、同学们通过实验发现,两个实验均有明显的现象,都能得出结论达到实验目的。但同学们一致认为实验二更好,请你写出实验二的优点(写出一点即可)。 -
12、某小组同学在实践活动中,制作了如图所示的简易净水器,并用其净化浑浊的河水。回答有关问题:
 (1)、图中小卵石和石英砂的作用。(2)、检验净化后的河水是否含有可溶性杂质的实验方案。
(1)、图中小卵石和石英砂的作用。(2)、检验净化后的河水是否含有可溶性杂质的实验方案。 -
13、化学与生产生活紧密相关,请写出下列反应方程式:(1)、有水生成的化合反应。(2)、水蒸气在高温条件下与铁反应生成四氧化三铁和氢气。
-
14、A、B、C是初中化学常见物质,A、B为纯净物,且两种物质由相同的元素组成,C为气体单质,能使带火星木条复燃,它们之间的关系如图所示。
 (1)、写出物质A的化学式:。(2)、写出由A生成B物质的方程式:。(3)、C物质的一种用途为。
(1)、写出物质A的化学式:。(2)、写出由A生成B物质的方程式:。(3)、C物质的一种用途为。 -
15、模型认知是化学学科重要核心素养之一,分析下列图示回答有关问题。
 (1)、图甲是铁元素在元素周期表中的信息,铁元素的相对原子质量是。(2)、图乙为氯元素的离子结构示意图,则x的数值为。(3)、图丙是氮元素的价类二维图,物质B的名称是。
(1)、图甲是铁元素在元素周期表中的信息,铁元素的相对原子质量是。(2)、图乙为氯元素的离子结构示意图,则x的数值为。(3)、图丙是氮元素的价类二维图,物质B的名称是。 -
16、物质的用途是由其决定,H2能做高能燃料是因为。
-
17、化学是研究物质的组成、结构、性质、转化及应用,指出下列研究涉及食盐的那个方面。(1)、食盐中含有哪些元素?(2)、食盐外形为何是立方体?(3)、向食盐水中通电能得到哪些新物质?
-
18、用正确的化学用语填空:(1)、地壳中含量最多的金属元素。(2)、硬水中含的钙离子。(3)、保持水化学性质的最小粒子。
-
19、推理和归纳是化学学习中常用的思维方法,下列推理正确的是A、催化剂能改变化学反应速率,所以能改变化学反应速率的物质都是催化剂 B、阳离子一定带正电荷,则带正电荷的粒子一定是阳离子 C、氮气的化学性质不活泼且不供给呼吸,故可用做粮食、瓜果的保护气 D、原子是化学变化中的最小粒子,所以原子不可再分
-
20、下列方程式书写正确的是A、红磷在O2中燃烧:4P+5O2=2P2O5 B、碳在O2中燃烧:C+O2CO2 C、铁在O2中燃烧:4Fe+3O22Fe2O3 D、电解水:2H2O2H2↑+O2↑