相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、我国科学家成功合成新型催化剂,能将高效转化为甲醇。这不仅可以缓解碳排放引起的温室效应,还将成为理想的能源补充形式。该化学反应的微观过程如图所示。
 (1)、据上图所示,说明在化学反应中,可分而不可分。(2)、甲、乙、丙、丁四种物质中,属于氧化物的有(填化学式)。(3)、写出该反应的化学方程式。(4)、火炬燃料火炬“祥云”的燃料是丙烷 , 火炬“飞扬”的燃料是氢气。写出丙烷充分燃烧生成二氧化碳和水的化学方程式。
(1)、据上图所示,说明在化学反应中,可分而不可分。(2)、甲、乙、丙、丁四种物质中,属于氧化物的有(填化学式)。(3)、写出该反应的化学方程式。(4)、火炬燃料火炬“祥云”的燃料是丙烷 , 火炬“飞扬”的燃料是氢气。写出丙烷充分燃烧生成二氧化碳和水的化学方程式。 -
2、如图是铈元素在元素周期表中的信息以及A、B、C、D四种粒子的结构示意图,请根据图示回答。
 (1)、铈元素的相对原子质量是。(2)、B、C属于不同种元素的原因是。(3)、A、B、C、D四种粒子中具有相对稳定结构的是(填字母),C在化学变化中形成的离子符号为。
(1)、铈元素的相对原子质量是。(2)、B、C属于不同种元素的原因是。(3)、A、B、C、D四种粒子中具有相对稳定结构的是(填字母),C在化学变化中形成的离子符号为。 -
3、化学与生活、生产、科技密切相关。请根据所学化学知识回答下列问题:(1)、劳动节期间,“筑梦”小组进行了“豆腐中的化学”主题研学活动。
制豆腐:小组同学经过“选豆→浸泡→磨浆→过筛→点浆→压制成型”,制得豆腐。“磨浆”属于(填“物理变化”或“化学变化”),“过筛”与实验室中操作的原理相似。
(2)、单晶硅为信息技术和新能源开发提供了基础材料,硅的元素符号为。(3)、是一种常用的复合肥 , 中氮元素的化合价为。(4)、“天宫”核心舱“天和”电推系统中的霍尔推力器腔体采用了氮化硼陶瓷基复合材料。制备氮化硼(BN)的反应如下:则X的化学式为。(5)、氯化钠是由和直接构成的化合物(填化学符号)。 -
4、下列所示的四个图像能够正确反映对应关系的是A、
 红磷燃烧测定氧气含量时的气压变化
B、
红磷燃烧测定氧气含量时的气压变化
B、 加热一定质量的高锰酸钾
C、
加热一定质量的高锰酸钾
C、 加热一定质量高锰酸钾
D、
加热一定质量高锰酸钾
D、 向一定质量双氧水的水溶液中加入二氧化锰
向一定质量双氧水的水溶液中加入二氧化锰
-
5、下列关于化合价的说法正确的是( )A、在Na2O中,钠原子显+1价,氧原子显-2价 B、在O2中,氧元素显-2价 C、非金属元素在化合物中总显负价 D、一种元素在同一种化合物中,可能有几种化合价
-
6、下面关于氢气在氯气中燃烧生成氯化氢反应说法正确的有
 A、在反应中,氢分子变成氢原子,氯分子变成氯原子,它们相互结合成新的分子是氯化氢分子 B、保持氢气化学性质的最小粒子是氢分子,氯气在化学变化中的最小粒子是氯分子 C、在这个反应中,发生变化的粒子是原子 D、该反应的类型属于分解反应
A、在反应中,氢分子变成氢原子,氯分子变成氯原子,它们相互结合成新的分子是氯化氢分子 B、保持氢气化学性质的最小粒子是氢分子,氯气在化学变化中的最小粒子是氯分子 C、在这个反应中,发生变化的粒子是原子 D、该反应的类型属于分解反应 -
7、类价图反映的是元素的化合价与物质类别之间的关系。如图是硫元素的类价图,下列说法不正确的是
 A、X表示单质 B、A物质的名称为三氧化硫 C、C物质的化学式可能是 D、B物质中硫元素的化合价为
A、X表示单质 B、A物质的名称为三氧化硫 C、C物质的化学式可能是 D、B物质中硫元素的化合价为 -
8、逻辑推理是化学学习中常用的思维方法。下列说法正确的是A、化学反应伴随着能量的变化,所以有能量变化的一定发生化学反应 B、阴离子带负电,所以带负电的粒子一定是阴离子 C、某物质在空气中燃烧生成二氧化碳和水,所以该物质中一定含有碳、氢两种元素 D、氧化物指的是一类含有氧元素的化合物,所以含有氧元素的化合物一定是氧化物
-
9、下列对实验现象的描述错误的是A、镁条在空气中燃烧,发出耀眼白光 B、硫在氧气中燃烧,发出蓝紫色火焰 C、蜡烛在空气中燃烧,生成二氧化碳和水 D、把铁钉放入蓝色硫酸铜溶液中,铁钉表面变红色
-
10、实验技能是学习化学的重要基础和保证,下列选项中的实验操作都正确的是
 A、①②③ B、①③ C、①④ D、②⑥
A、①②③ B、①③ C、①④ D、②⑥ -
11、某化学小组进行了“氧气的实验室制取与性质”的实验活动,下图为他们使用的部分装置和仪器,请回答下列问题:
 (1)、用装置制取氧气的符号表达式为。中的仪器名称是。(2)、要用过氧化氢溶液和二氧化锰制取并收集较纯净的氧气。
(1)、用装置制取氧气的符号表达式为。中的仪器名称是。(2)、要用过氧化氢溶液和二氧化锰制取并收集较纯净的氧气。①组装装置需用到上图中的(填序号)。
②若用下图所示操作回收实验后的二氧化锰,缺少的一种玻璃仪器是 , 它在实验中的作用是。滤液仍然浑浊,可能的原因是什么。(写出一条即可)
 (3)、小组中的同学用收集好的氧气进行如下图所示实验。
(3)、小组中的同学用收集好的氧气进行如下图所示实验。
①甲图中集气瓶底部加水的目的是什么?
②乙图所示实验现象是什么?
(4)、某同学想知道多少克过氧化氢与9克水中含有的氧元素一样多,请你帮他完成计算。 -
12、下图是某反应的微观示意图。
 (1)、请将反应后方框内缺少的微观粒子示意图补画完整。(2)、该反应前后碳元素的化合价如何变化?(3)、请从微观角度解释该反应遵循质量守恒定律的原因。
(1)、请将反应后方框内缺少的微观粒子示意图补画完整。(2)、该反应前后碳元素的化合价如何变化?(3)、请从微观角度解释该反应遵循质量守恒定律的原因。 -
13、请按要求写出反应的符号表达式。(1)、有水生成的化合反应。(2)、有水生成的分解反应。(3)、碱式碳酸铜【】在加热的条件下分解生成三种氧化物。(反应前后元素化合价均未改变)
-
14、为了验证质量守恒定律,某化学小组分别称量了下列三组试剂在敞口烧杯内混合前后的总质量:
①碳酸钠粉末和稀盐酸;②氢氧化钠溶液和硫酸铜溶液;③蔗糖和水。
上述三组试剂中不能验证质量守恒定律的组合及其不符合要求的原因是什么?
-
15、“见著知微、见微知著”是化学学科的特点之一。请从微观角度解释下列现象。(1)、品红在热水中扩散比在冷水中快。(2)、体温计受热,汞柱上升。
-
16、甲、乙、丙三种物质有如图所示的转化关系。
 (1)、若三种物质中都含有地壳中含量最多的元素,甲、乙的组成元素相同,丙是单质。则甲、乙化学性质不同的原因是;乙生成丙的符号表达式为。(2)、若甲和丙都是单质,紫红色金属丙能在加热的条件下与甲反应生成黑色固体乙,该反应的符号表达式为。
(1)、若三种物质中都含有地壳中含量最多的元素,甲、乙的组成元素相同,丙是单质。则甲、乙化学性质不同的原因是;乙生成丙的符号表达式为。(2)、若甲和丙都是单质,紫红色金属丙能在加热的条件下与甲反应生成黑色固体乙,该反应的符号表达式为。 -
17、某钙镁咀嚼片的部分说明书如下图所示。
××牌钙镁咀嚼片
主要成分:碳酸钙、碳酸镁
每片含量:钙;镁
……
(1)、其中“钙、镁”是指(填“元素”、“原子”或“单质”)。(2)、若每片咀嚼片中碳酸钙的质量分数为 , 则该咀嚼片中钙的质量分数为。 -
18、下图是五种粒子的结构示意图。
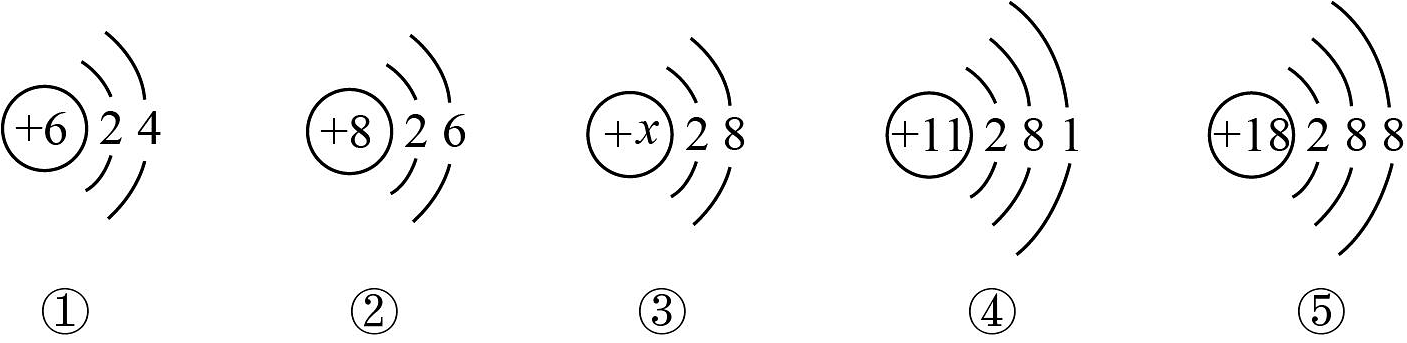 (1)、已知③带2个单位的正电荷,则;它所属元素位于元素周期表中的第周期。(2)、图中具有相对稳定结构的原子是(填化学用语)。
(1)、已知③带2个单位的正电荷,则;它所属元素位于元素周期表中的第周期。(2)、图中具有相对稳定结构的原子是(填化学用语)。 -
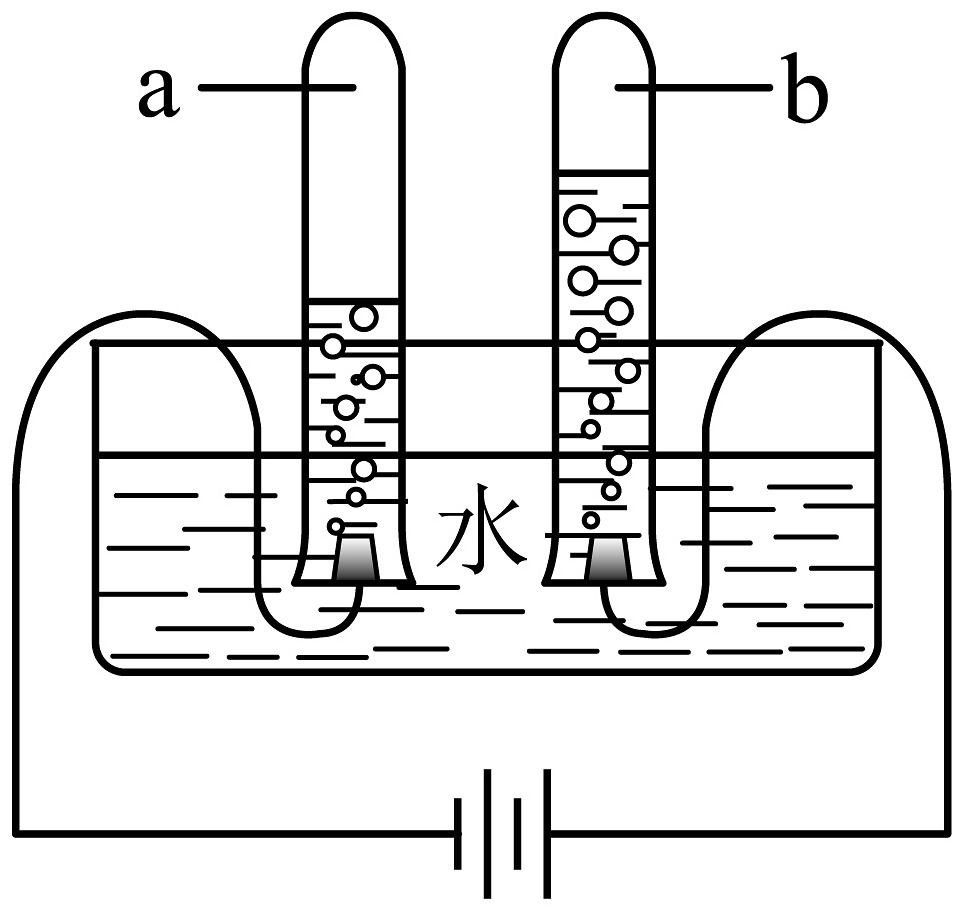
19、水与人类的生产生活密切相关。(1)、自来水生产过程为常用(填物质名称)除去水中的颜色、异味。(2)、电解水实验如下图所示。此实验可以得出水是由组成;试管内气体的化学性质是(写出一条即可)。
-
20、用正确的化学用语填空。(1)、亚铁离子可表示为;(2)、标出氧化铝中金属元素的化合价;(3)、河南博物院常用空气中含量最多的气体保护文物,该气体的2个分子表示为。