相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、某兴趣小组利用下列装置进行气体的实验室制取和收集实验,请回答:
 (1)、图中仪器名称①;②。(2)、若用高锰酸钾制取氧气选用的发生装置是(填字母),反应的文字表达式为 , 该反应所属的基本反应类型是反应。(3)、用D装置收集氧气时,当气泡再开始收集,收集满氧气后,应用玻璃片盖住集气瓶口,并且应(填“正放”或“倒立”)在桌上。(4)、若用F装置收集该气体,则气体从(填“a”或“b”)处导管进入。
(1)、图中仪器名称①;②。(2)、若用高锰酸钾制取氧气选用的发生装置是(填字母),反应的文字表达式为 , 该反应所属的基本反应类型是反应。(3)、用D装置收集氧气时,当气泡再开始收集,收集满氧气后,应用玻璃片盖住集气瓶口,并且应(填“正放”或“倒立”)在桌上。(4)、若用F装置收集该气体,则气体从(填“a”或“b”)处导管进入。 -
2、
(一)某工厂分离空气获得稀有气体、纯度较高的氮气和液氧,其分离空气的简易流程如图所示。

请根据流程图回答下列问题。
(1)步骤A所发生的变化属于(填“物理变化”或“化学变化”)。
(2)由步骤B可以看出,氮气的沸点比氧气的沸点(填“高”或“低”)。嫦娥五号取回的月壤保存在氮气中,这说明氮气化学性质(填“活泼”或“不活泼”)。
(二)氧气能与很多物质发生反应,小明同学进行了如图所示整理(部分反应条件已略去)。

(3)写出黑色固体Y的名称:。
(4)描述反应①的实验现象:。
(5)若反应②是化合反应,请写出其文字表达式:。
(6)在实验室进行反应③的实验时,需要注意。
-
3、为了揭示原子结构的奥秘,人类经历了漫长的探索。
材料一:1803年,道尔顿在原子论中提出:物质由微小的不可再分的原子构成。
材料二:1897年,汤姆孙发现原子内有带负电的微观粒子,否定了“原子不可再分”。
材料三:1911年,卢瑟福进行了著名的粒子(粒子由2个质子和2个中子构成)轰击金箔实验。结果发现:绝大多数粒子穿过金箔后仍沿原方向前进,但是有少数粒子却发生了较大角度的偏转,并且有极少数粒子的偏转角度超过90°,有的几乎达到180°,像是被金箔弹了回来。
请根据信息分析:
(1)、汤姆孙实验中,带负电的微观粒子是。(2)、卢瑟福实验中使用的金箔是由(填“分子”“原子”或“离子”)构成的;通过卢瑟福实验,可推出的原子结构模型为(填图1中字母)。 (3)、当粒子轰击金箔时,图2所示的运动轨迹不可能是(填图2中字母)。若原子质量、正电荷在原子内均匀分布,则极少数粒子就(填“会”或“不会”)发生大角度偏转。卢瑟福分析说“除非原子的大部分质量集中到了一个很小的结构”。你觉得这个“很小的结构”指的是。
(3)、当粒子轰击金箔时,图2所示的运动轨迹不可能是(填图2中字母)。若原子质量、正电荷在原子内均匀分布,则极少数粒子就(填“会”或“不会”)发生大角度偏转。卢瑟福分析说“除非原子的大部分质量集中到了一个很小的结构”。你觉得这个“很小的结构”指的是。 -
4、空气质量指数日报是通过新闻媒体向社会发布的环境信息,其主要内容包括“空气质量指数”“首要污染物”“空气质量指数类别”等。(1)、洁净的空气是(填“纯净物”或“混合物”)。(2)、下列物质中,不计入空气质量指数类别的主要污染物的是___________(填字母)。A、二氧化硫 B、二氧化氮 C、二氧化碳 D、可吸入颗粒物(3)、空气质量分级标准如下表:
空气质量指数
0~50
51~100
101~150
151~200
201~300
>300
空气质量指数级别
一级
二级
三级
四级
五级
六级
空气质量指数类别
优
良
轻度污染
中度污染
重度污染
严重污染
某地区2024年6月空气质量指数保持在20~48,那么该地区6月空气质量指数类别总体保持在(填“优”或“良”)。
(4)、为降低汽车尾气对空气的污染,目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的一氧化碳与二氧化氮在催化剂作用下转化成二氧化碳与空气中含量最多的气体,该气体是。 -
5、结合下列图示,回答有关问题:
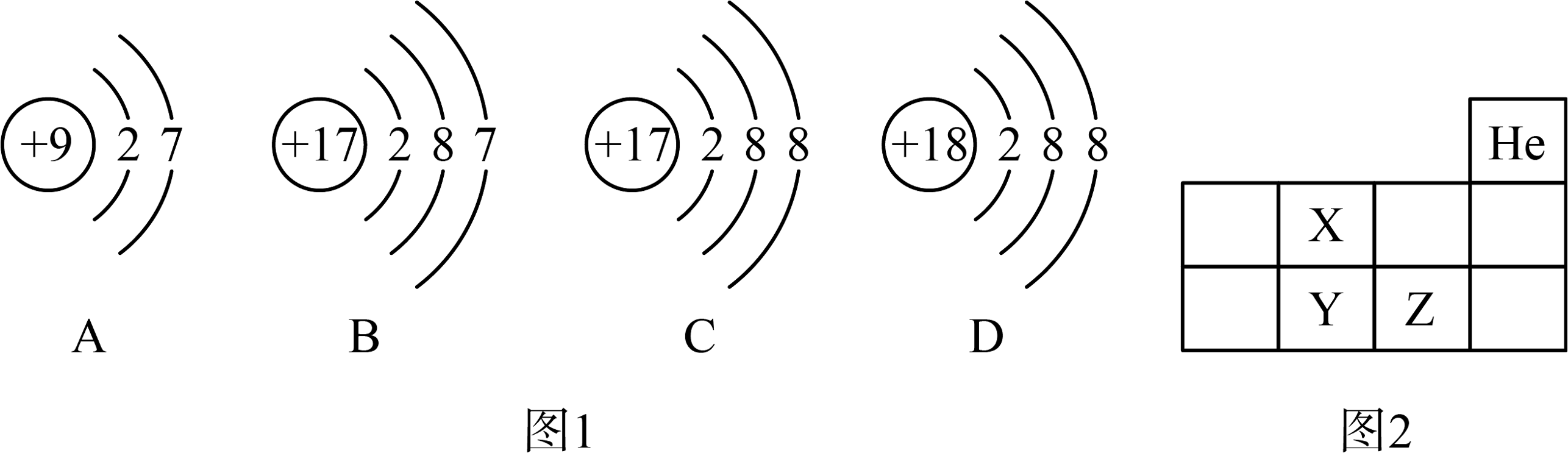 (1)、如图1,A微粒的化学性质与B、C、D中哪一种微粒的化学性质相似(填序号)。(2)、如图2为元素周期表中的一部分,X、Y、Z代表三种不同元素,以下判断正确的是___________A、原子序数:Z>Y B、核外电子数:X=Y C、Y和Z处于同一周期(3)、已知硅原子核外电子有三层,最外层有4个电子,其原子结构示意图为。
(1)、如图1,A微粒的化学性质与B、C、D中哪一种微粒的化学性质相似(填序号)。(2)、如图2为元素周期表中的一部分,X、Y、Z代表三种不同元素,以下判断正确的是___________A、原子序数:Z>Y B、核外电子数:X=Y C、Y和Z处于同一周期(3)、已知硅原子核外电子有三层,最外层有4个电子,其原子结构示意图为。 -
6、回答问题(1)、酒精灯的(填“外焰”“内焰”或“焰心”)温度最高。(2)、用如图装置测定空气中氧气的含量,物质R应该选用(填“木炭”或“红磷”)。
 (3)、该实验探究的是对分子运动速率的影响。
(3)、该实验探究的是对分子运动速率的影响。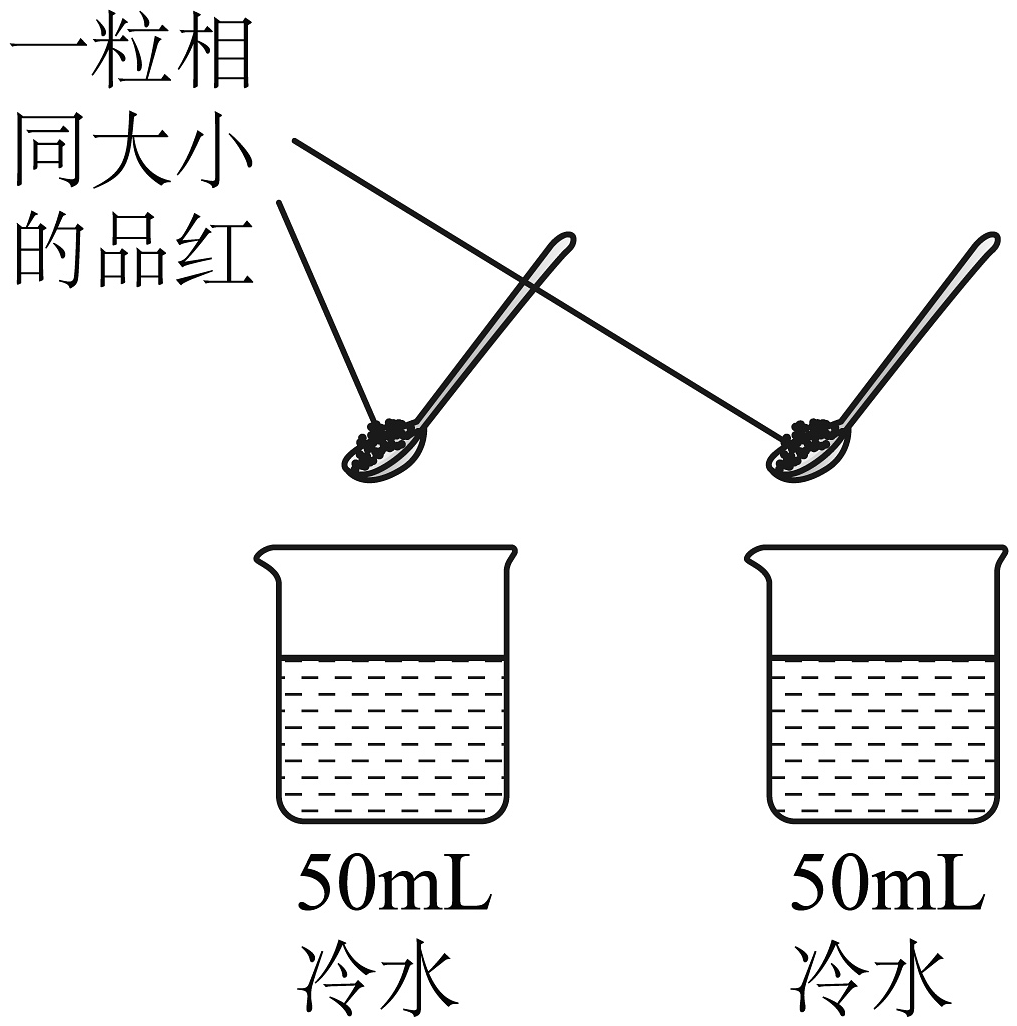
-
7、用适当的符号或符号与数字的组合填空:(1)、氖原子:;(2)、2个氮原子:;(3)、构成氯化钠的阳离子:。
-
8、下列关于“蜡烛燃烧”“水的沸腾”“石蜡熔化”实验叙述中,不正确的说法是A、
 观察到有水和二氧化碳生成
B、
观察到有水和二氧化碳生成
B、 蜡烛熄灭时,产生白烟是物理变化
C、
蜡烛熄灭时,产生白烟是物理变化
C、 说明液态水与气态水可以相互转化
D、
说明液态水与气态水可以相互转化
D、 石蜡熔化时,发生的变化是物理变化
石蜡熔化时,发生的变化是物理变化
-
9、下列实验方法不能达到实验目的的是
选项
实验目的
实验方法
A
鉴别氮气和二氧化碳
将燃着的木条分别伸入集气瓶中
B
区分氧气和氮气
将燃着的木条分别伸入集气瓶中
C
区分酒精和水
闻气味
D
区分铁制品和铜制品
看颜色
A、A B、B C、C D、D -
10、木炭在氧气中燃烧生成二氧化碳的示意图如下。下列有关叙述中,不正确的是
 A、该反应属于化合反应 B、反应前后原子个数不变 C、反应前后分子种类、个数不变 D、分子由原子构成
A、该反应属于化合反应 B、反应前后原子个数不变 C、反应前后分子种类、个数不变 D、分子由原子构成 -
11、下列有关分子、原子、离子说法不正确的是A、阳离子一定带正电荷 B、分子最大,原子次之,离子最小 C、原子得到或失去电子变成离子,离子也能变成原子 D、分子、原子、离子都能直接构成物质
-
12、下列叙述不符合化学实验规则的是A、上实验课前,明确实验步骤和注意事项 B、在设计实验方案时,要充分考虑实验安全 C、每次实验时,应该实事求是的做好记录 D、实验后,可以把剩余药品随意拿出实验室
-
13、屠呦呦因发现了青蒿素(化学式为)成为中国首位诺贝尔医学奖获得者,青蒿素的发现为人类抗疟药物开拓了新方向,以青蒿素为基础的联合疗法在全球得到广泛使用,挽救了数百万人生命。试计算:(1)、青蒿素的相对分子质量为。(2)、青蒿素中C、H、O三种元素的质量比为。(最简整数比)(3)、求青蒿素中所含碳元素的质量。(写出计算过程)
-
14、合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
 (1)、合成塔中的反应属于(填基本反应类型)反应。(2)、生产过程中从合成塔中输出的气体属于(填“纯净物”或“混合物”)。(3)、生产过程中将氨气()冷却成液态氨,此过程改变的是________。A、分子的大小 B、分子间的间隔 C、分子的组成(4)、根据表中的数据回答问题。
(1)、合成塔中的反应属于(填基本反应类型)反应。(2)、生产过程中从合成塔中输出的气体属于(填“纯净物”或“混合物”)。(3)、生产过程中将氨气()冷却成液态氨,此过程改变的是________。A、分子的大小 B、分子间的间隔 C、分子的组成(4)、根据表中的数据回答问题。物质
沸点/()
在时,欲将与、分离,应该将温度控制在之间。
-
15、下图是实验室制备气体的常用装置,请回答下列问题。
 (1)、写出仪器①的名称:。(2)、实验室用高锰酸钾制取并收集一瓶较纯净的氧气,应选用的装置组合为 , A装置有一处不足之处,需要改进的是;该反应的文字表达式为 , 该反应所属基本反应类型为。(3)、若用G装置收集氢气,则气体应从(填“a”或“b”)端管口进入。
(1)、写出仪器①的名称:。(2)、实验室用高锰酸钾制取并收集一瓶较纯净的氧气,应选用的装置组合为 , A装置有一处不足之处,需要改进的是;该反应的文字表达式为 , 该反应所属基本反应类型为。(3)、若用G装置收集氢气,则气体应从(填“a”或“b”)端管口进入。 -
16、如图所示为电解水的装置示意图,请按要求回答下列问题。
 (1)、图中产生气体b的一端电极与电源(填“正”或“负”)极相连。(2)、在该实验中,通常会加入少量的稀硫酸或氢氧化钠溶液的目的是。(3)、该反应的文字表达式为。(4)、通过电解水实验可知:水是由组成的。
(1)、图中产生气体b的一端电极与电源(填“正”或“负”)极相连。(2)、在该实验中,通常会加入少量的稀硫酸或氢氧化钠溶液的目的是。(3)、该反应的文字表达式为。(4)、通过电解水实验可知:水是由组成的。 -
17、用化学用语回答下列问题:(1)、氢氧根离子:。(2)、3个氮分子:。(3)、氩气:。(4)、地壳中含量最多的非金属元素和含量最多的金属元素形成的化合物的化学式是。
-
18、利用红磷测定空气中氧气含量的实验装置如图1,用气体压力传感器测出该集气瓶中的气压变化如图2。下列分析不正确的是
 A、图1实验开始时,先要检查装置的气密性 B、图1实验中,所用的红磷不足会造成集气瓶内进水量少于 C、图2中:C→D气压降低,是因为集气瓶内氧气的消耗造成的 D、图2中:D→E气压升高,是因为D点对应的时间打开了弹簧夹,水进入集气瓶内导致内部压强上升
A、图1实验开始时,先要检查装置的气密性 B、图1实验中,所用的红磷不足会造成集气瓶内进水量少于 C、图2中:C→D气压降低,是因为集气瓶内氧气的消耗造成的 D、图2中:D→E气压升高,是因为D点对应的时间打开了弹簧夹,水进入集气瓶内导致内部压强上升 -
19、推理是化学学习中常用的思维方式。下列推理正确的是A、点燃可燃性气体前需要验纯,所以点燃氢气之前需要验纯 B、单质由同种元素组成,由同种元素组成的物质一定是单质 C、原子是不显电性的粒子,不显电性的粒子一定是原子 D、催化剂可以加快化学反应速率,所以任何化学反应都需要催化剂
-
20、某同学描述了某化学符号的含义:①表示一种物质;②表示一个分子;③表示该物质由两种元素组成;④表示一个分子由三个原子构成。该化学符号可能是A、 B、 C、 D、