相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、逻辑推理是一种重要的化学思维方法。下列推理正确的是A、溶液具有均一性、稳定性,但均一、稳定的液体不一定是溶液 B、原子和分子都是构成物质的微观粒子,原子在化学变化中不能再分,所以分子在化学变化中也不能再分 C、离子是带电荷的微粒,所以带电荷的微粒一定是离子 D、化学变化通常伴随热量变化,则有热量变化的过程都是化学变化
-
2、图像能直观表达各种变化关系,加深对知识的理解,下列图像与其对应表述正确的是
 A、在某温度下,往接近饱和溶液中加入固体 B、电解水生成氢气和氧气的质量与反应时间的关系 C、在某温度下,向一定量饱和溶液中不断加入固体 D、在密闭容器中用足量铜粉测定空气中氧气的含量
A、在某温度下,往接近饱和溶液中加入固体 B、电解水生成氢气和氧气的质量与反应时间的关系 C、在某温度下,向一定量饱和溶液中不断加入固体 D、在密闭容器中用足量铜粉测定空气中氧气的含量 -
3、的转化利用是实现碳中和的重要途径。如图是与某种单质反应的微观示意图。下列说法正确的是
 A、乙的化学式为 B、整个反应过程中涉及到3种氧化物 C、反应前后各元素的化合价都未发生改变 D、反应前后分子数目没有改变
A、乙的化学式为 B、整个反应过程中涉及到3种氧化物 C、反应前后各元素的化合价都未发生改变 D、反应前后分子数目没有改变 -
4、“手持技术”又称为掌上实验室,是由计算机和微电子技术相结合的新型数字化实验手段,主要包括:数据采集器、传感器、计算机及配套软件组成。某实验小组想利用温度传感器,通过测量等质量的(10g)NaOH、NaCl、NH4NO3溶解于水时溶液温度的变化,探求其变化的规律。
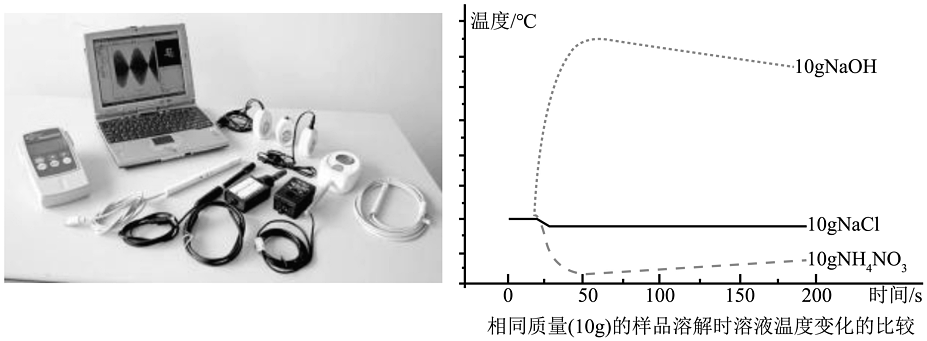
通过溶液相关知识和观察图像,下列说法错误的是
A、等质量的三种物质溶于水中NH4NO3使溶液温度降低 B、同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化 C、加入NaOH使溶液温度升高的原因是,溶质中离子扩散吸热 D、等质量的三种物质溶于水中NaCl溶液温度变化不大,但是略有降低 -
5、下列排列顺序正确的是A、净水的相对净化程度由低到高:蒸馏→吸附→过滤 B、硫元素化合价由低到高: C、地壳中元素含量由高到低: D、碳元素的质量分数由大到小:
-
6、化学用语是国际通用的化学语言,下列有关说法不正确的是A、:“”表示一个镁离子带2个单位正电荷 B、:“4”表示四个钠元素 C、“”表示氧化铜中铜元素的化合价为价 D、:“3”表示3个水分子
-
7、人体吸入的空气中有转化为活性氧,它会加速人体衰老。科学家尝试用亚硒酸钠()清除人体内的活性氧,下列有关亚硒酸钠的说法正确的是A、亚硒酸钠属于氧化物 B、亚硒酸钠由2个钠原子、1个硒原子和3个氧原子构成 C、亚硒酸钠由三种元素组成 D、亚硒酸钠中含有臭氧分子
-
8、我国研究人员将应用到光电催化分解水实验。铋元素在元素周期表中的信息如图所示。下列关于铋元素的说法正确的是
 A、属于非金属元素 B、铋的相对原子质量为 C、中子数为83 D、铋原子的核外电子数为83
A、属于非金属元素 B、铋的相对原子质量为 C、中子数为83 D、铋原子的核外电子数为83 -
9、人类的生存离不开空气,下列关于空气及其成分说法正确的是A、氮气化学性质不活泼,可用于食品防腐 B、新鲜空气中不含二氧化碳 C、氧气的化学性质很活泼,常温下能与所有物质发生化学反应 D、空气中既含有单质也含有化合物,其组成是固定不变的
-
10、2024年世界环境日的中国主题是“全面推进美丽中国建设”。下列做法符合此主题的是A、就地丢弃废旧塑料 B、分类回收生活垃圾 C、生活污水排入河道 D、乱采矿产资源
-
11、物质的性质决定物质的用途。下列物质的用途主要应用其化学性质的是A、活性炭作冰箱除味剂 B、稀有气体用于制作霓虹灯 C、铜丝作导线 D、双氧水用于消毒
-
12、备基本的实验技能是进行科学探究的保证,下列实验操作正确的是A、过滤黄河水
 B、点燃酒精灯
B、点燃酒精灯 C、氧气的验满
C、氧气的验满 D、倾倒液体
D、倾倒液体
-
13、化学课上,同学们看老师做镁条与稀盐酸反应的实验,观察到反应非常剧烈,产生大量气泡。于是就提出“铜片能不能与稀盐酸反应呢”,这一过程属于科学探究中的A、提出问题 B、设计实验 C、进行观察 D、得出结论
-
14、成语是中华民族文明与智慧的结晶,是中华文化的瑰宝。下列成语所描述的情境主要包含化学变化的是A、风吹草动 B、立竿见影 C、火上浇油 D、滴水成冰
-
15、构建知识网络是一种重要的学习方法。如图为兴趣小组绘制的铁的化学性质知识网络图。
 (1)、反应①中另一反应物可以是(填化学式)。(2)、早在西汉时期,我国劳动人民就利用反应②制取铜,称为“湿法炼铜”,该反应的现象是。(3)、为了测定某生铁中铁的含量,该小组利用反应③的原理进行如下实验:将一定质量的生铁样品(杂质不溶于水,也不与稀硫酸反应)放入足量的稀硫酸中,充分反应后,生成0.2g气体;过滤,将所得固体洗涤、干燥后称得其质量为0.2g。计算该生铁中铁的质量分数。(结果精确到0.1%)
(1)、反应①中另一反应物可以是(填化学式)。(2)、早在西汉时期,我国劳动人民就利用反应②制取铜,称为“湿法炼铜”,该反应的现象是。(3)、为了测定某生铁中铁的含量,该小组利用反应③的原理进行如下实验:将一定质量的生铁样品(杂质不溶于水,也不与稀硫酸反应)放入足量的稀硫酸中,充分反应后,生成0.2g气体;过滤,将所得固体洗涤、干燥后称得其质量为0.2g。计算该生铁中铁的质量分数。(结果精确到0.1%) -
16、我国是世界上锌冶炼最早的国家。明代宋应星所著的《天工开物》中有关“火法”炼锌的工艺记载是:“每炉甘石(主要成分是碳酸锌)十斤装载入一泥罐内……然后逐层用煤炭饼(反应后生成一氧化碳)垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅(锌)也。”此工艺过程分解模拟如图。(已知:Zn的熔点420℃,沸点为907℃。)请结合图文信息,分析思考,解决问题:
 (1)、炉甘石主要成分属于(多选,填字母)。
(1)、炉甘石主要成分属于(多选,填字母)。a.纯净物 b.化合物 c.混合物 d.氧化物
(2)、装入原料器之前,将炉甘石敲碎的目的是。(3)、煤属于(填“可再生”或“不可再生”)能源。“其底铺薪”中的“薪”的作用是。(4)、高温炉内,碳酸锌(ZnCO3)在高温条件下与煤的主要成分发生反应生成Zn和CO,反应的化学方程式为。ZnCO3中碳元素的化合价为价。(5)、冷凝器通过控制温度除去CO的同时液态锌流出,故温度应控制在。(6)、我国古代冶锌晚于铁和铜,结合已知信息,分析说明其中的原因是。 -
17、
在日常生活中能看到很多精美的金属蚀刻画。兴趣小组利用废弃的金属片进行制作金属蚀刻画的项目活动,请你一起参与下列任务。
任务一:到垃圾回收站筛选金属底板
(1)区分铝片和铁片的物理方法是(写一种)。
任务二:预处理金属底板
用砂纸打磨掉铝片表面的氧化膜,用化学方法除去铁片表面的铁锈。
任务三:选择蚀刻液进行蚀刻
(2)首先将有镂空图案的不干胶保护膜(能隔绝蚀刻液与金属底板接触)分别贴到处理好的铝片和铁片上,然后将铝片浸入足量的甲蚀刻液中,将铁片浸入足量的乙蚀刻液中,一段时间后取出。小组同学看到铝片上有凹陷图案,没有附着物;铁片上出现红色附着物图案。则甲蚀刻液、乙蚀刻液分别是下列中的、(填序号)。
①硫酸铜溶液 ②硝酸银溶液 ③稀盐酸 ④氯化亚铁溶液 ⑤氯化钠溶液
任务四:金属蚀刻画的后处理
(3)将蚀刻好的金属片清洗掉废液,去掉不干胶保护膜,进行装饰。为防止铁片蚀刻画生锈,可采取的措施是(写一种)。
任务五:废液回收利用
(4)铝片蚀刻废液处理,可加入足量铝片,得到溶液,回收保存。
(5)铁片蚀刻废液处理,如图所示:
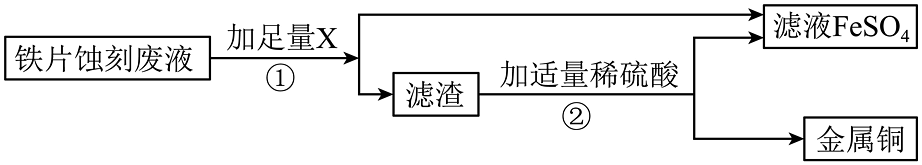
过程①和②都涉及的实验操作是 , 过程①加入的物质X是 , 过程②加入稀硫酸反应的化学方程式是;其基本反应类型是。
-
18、回答下列问题。(1)、实验室制取气体。

①仪器甲的名称是。
②若实验室用高锰酸钾制氧气,应在装置A的试管口 , 以防固体粉末进入导管。
③若实验室用装置BD制取氧气,其反应的化学方程式为。
④装置B、C均可用于实验室制取二氧化碳,两者相比,装置C的优点是 , 不能用装置D收集可推其具有的物理性质是。在装置E中加入用于检验CO2。
(2)、基于特定需求设计和制作简易供氧器。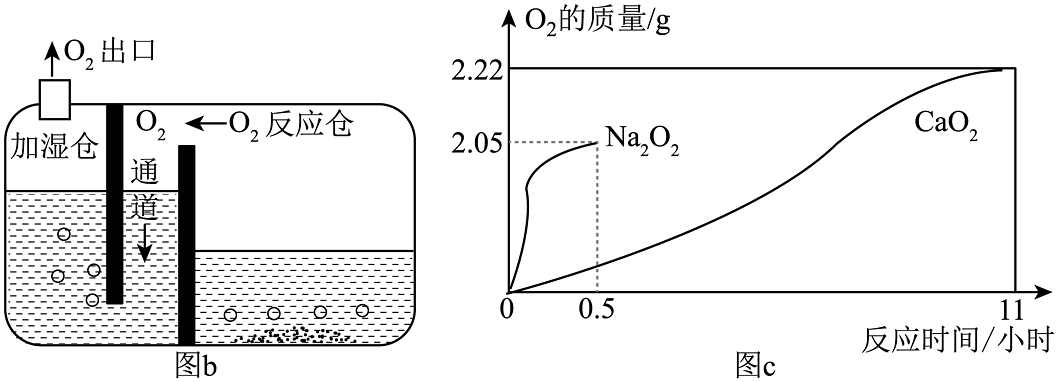
①加湿仓内水的作用是(写一点),图b中“O2通道”相当于图a中E装置的(填“a”或“b”)端导管。
②10gNa2O2和10gCaO2固体与水作用生成氧气的质量与时间的关系如图c所示,若给鱼池增氧,应选的药品为(填化学式)。
-
19、氢能有望在未来能源体系中占据更加重要的位置。制氢(图1)、储氢和用氢(图1)是目前重点关注的问题。
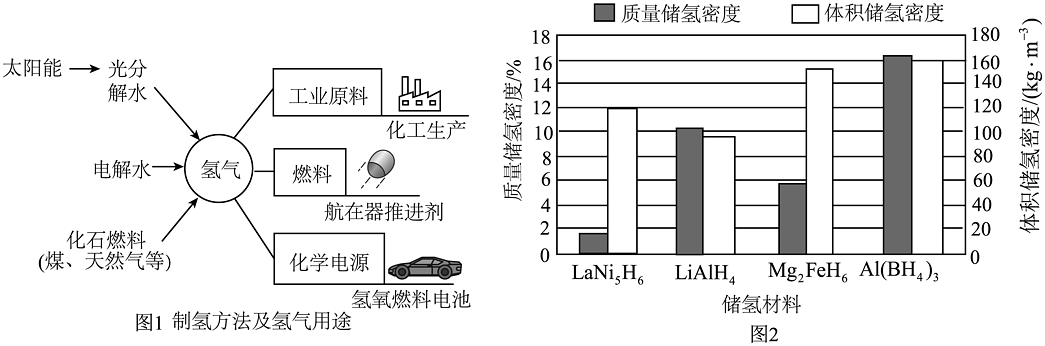
氢气的储存方式主要有金属氢化物储氢、低温液化储氢、高压压缩储氢、碳基材料储氢等。图2为一些储氢材料(以储氢后的化学式表示)的质量储氢密度和体积储氢密度。(已知:质量储氢密度=储氢后氢元素在储氢材料中的质量分数;体积储氢密度=储氢后单位体积的储氢材料中储存氢元素的质量)。
依据上文,回答问题。
(1)、氢能具有的优点是(写一点)。(2)、从节能的角度分析,最理想的制氢的方式是。a.光分解水 b.电解水 c.化石燃料制氢
(3)、从分子的角度解释低温或高压储氢的原理:。(4)、用作碳基储基储氢材料的“碳纳米管”与金刚石都是碳的单质,但物理性质不同原因是。(5)、分析图2,下列储氢材料中最理想的是(填字母)。a.LaNi5H6 b.LiAlH4 c.Mg2FeH6 d.Al(BH4)3
(6)、氢氧燃料电池是将能直接转化为电能的装置。一定条件下,氢氧燃料电池内发生反应的化学方程式为。 -
20、化学源于生活,生活中蕴含着许多化学知识。(1)、某保健食品中含有的“钙、铁、锌”等指的是(填“原子”“分子”或“元素”)。(2)、自来水厂净化过程中利用除去水中色素和异味;长期饮用硬水对人体有害,日常生活中常用的方法降低水的硬度。(3)、古代用墨书写或绘制的字画能够保存至今的原因:。(4)、生石灰(CaO)除湿防潮的原理是(用化学方程式表示),该反应(选填“放出”或“吸收”)热量。