相关试卷
- 广东省清远市2016-2017学年九年级化学一模考试试卷
- 广西钦州港经济开发区2015-2016学年九年级上学期化学期末考试试卷
- 广西北海市合浦县教育局教研室2013-2014学年九年级上学期化学期末考试试卷
- 广西北海市合浦县2012-2013学年九年级上学期化学期末考试试卷
- 广东省肇庆市鼎湖中学2017-2018学年九年级上学期化学期中考试试卷
- 2016年广西钦州市中考化学试题
- 2015年广西钦州市中考化学试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西桂林市灌阳县2015-2016学年九年级上学期化学期中考试试卷
- 广西钦州地区2016-2017学年九年级化学中考模拟考试试卷
-
1、如图是某品牌矿泉水标签的部分内容。
XX矿泉水
净含量:500mL
配料表:纯净水 硫酸镁 氯化钾
主要成分:钾1.0~27.3mg/L
镁0.1~4.8mg/L
(1)、2个氯原子的化学符号为。(2)、中“2+”的含义是。(3)、中“2”的含义是。 -
2、某兴趣小组探究物质燃烧的条件,装置如图所示(已知:白磷的着火点为40℃,红磷的着火点为240℃)。

步骤①:先将一定量的白磷、红磷分别浸入80℃热水中;
步骤②:升高右侧漏斗至红磷露出水面;
步骤③:升高左侧漏斗至白磷露出水面。
下列说法正确的是
A、白磷燃烧时产生大量白雾,放出热量 B、步骤②中可观察到红磷燃烧 C、步骤①中白磷不燃烧,③中白磷燃烧,对比①③可得物质燃烧的条件之一是与氧气接触 D、80℃热水的作用只是隔绝氧气 -
3、下列实验方案不能达到相应实验目的的是
实验方案
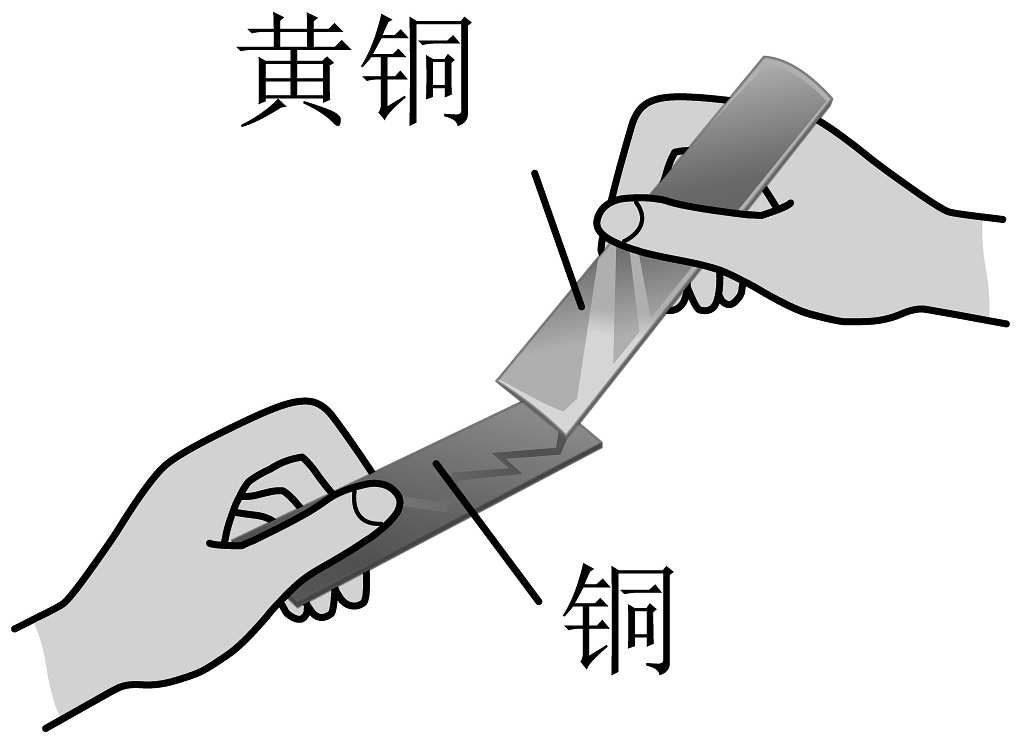

实验目的
A.比较合金的硬度
B.证明石墨具有导电性
实验方案


实验目的
C.探究二氧化锰的催化作用
D.除去中的CO气体
A、A B、B C、C D、D -
4、火箭发射过程中,某反应的微观示意图如下,下列说法正确的是
 A、物质甲中N、O元素的质量比为1∶2 B、该反应为分解反应 C、反应过程中分子和原子种类都发生改变 D、参加反应的甲和乙的分子个数比为1∶2
A、物质甲中N、O元素的质量比为1∶2 B、该反应为分解反应 C、反应过程中分子和原子种类都发生改变 D、参加反应的甲和乙的分子个数比为1∶2 -
5、为了保障野外工作人员的用水安全,便携净水器的设计有重要意义。小组同学自制如图所示便携式净水器。下列说法正确的是
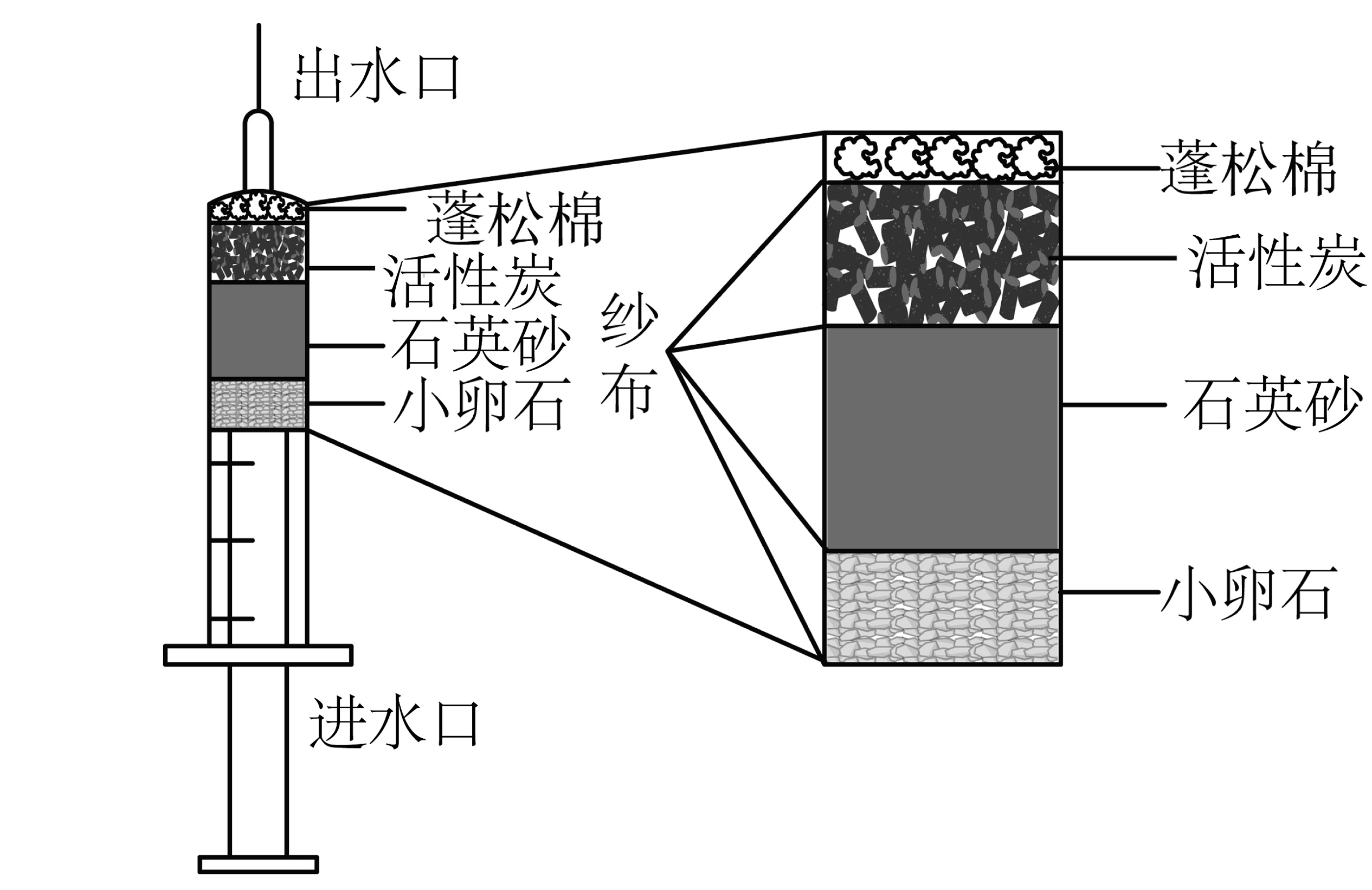 A、该装置能除去河水中的所有杂质 B、活性炭能吸附水中的色素和异味 C、该装置净化后的水为纯净物 D、石英砂和活性炭互换位置,净水效果相同
A、该装置能除去河水中的所有杂质 B、活性炭能吸附水中的色素和异味 C、该装置净化后的水为纯净物 D、石英砂和活性炭互换位置,净水效果相同 -
6、下列物质的化学式书写正确的是A、碳酸钠: B、黄铜:Cu C、氧化铝:AlO D、一氧化碳:Co
-
7、下图是实验室制取气体的部分装置。

已知:浓硫酸具有吸水性,能吸收气体中的水蒸气。
(1)、装置A中试管口塞棉花的原因 , 若选择装置A制取氧气,该反应的符号表达式为。(2)、用过氧化氢溶液制取氧气的发生装置可选择B装置或C装置。①若用B装置制氧气,长颈漏斗的末端要伸入液面以下的目的是。
②与B装置相比较,C装置的主要优点是。
(3)、氧气可采用D装置收集并用带火星的木条验满,这是利用了氧气的哪些性质?。(4)、若用过氧化氢和二氧化锰混合制取一瓶干燥的氧气,以上装置导管接口连接顺序为b接 , 接d。(5)、若选用如图所示的装置收集氢气,气体从m进n出,请将玻璃导管补画完整。 (6)、某化学小组用68g过氧化氢溶液和1.74g二氧化锰混合制取氧气,请计算:
(6)、某化学小组用68g过氧化氢溶液和1.74g二氧化锰混合制取氧气,请计算:①过氧化氢中氢元素和氧元素质量比为。
②1.74g二氧化锰中锰元素的质量为。
-
8、类比归纳是学好化学的一种有效手段,它可以引导我们总结规律,发现区别。(1)、在做一些燃烧的实验时,要在集气瓶中预先加少量的水,但作用各不相同。请根据你所学过的化学课本知识回答下列问题:
①做硫在氧气里燃烧的实验时,在集气瓶中预先加少量水的作用是什么?
②做用红磷燃烧测定空气里氧气含量实验时,在集气瓶中预先加少量水的作用是什么?
(2)、经过学习我们还可以认识到:化学反应的快慢、反应时的现象与反应物的浓度等之间有着密切的联系。请你列举一个你所熟悉的例子说明:反应物的浓度不同,反应现象不同。 -
9、下图是同学们完成的几个与氧气有关的实验,请结合相关实验,回答下列问题。
 (1)、图1是木炭在氧气中燃烧的实验,若该实验只观察到木炭出现红热现象,可能的原因是。(2)、图3所示实验,实验现象。
(1)、图1是木炭在氧气中燃烧的实验,若该实验只观察到木炭出现红热现象,可能的原因是。(2)、图3所示实验,实验现象。 -
10、阅读下列短文,回答问题。
材料1:早在宋代,轻粉已是我国的一种重要药物,其制作方法之一是将古方药小还丹和食盐等物质在固体状态下共热,收集升华出的白色粉末,即为轻粉,其中有一个反应是在加热条件下,硫酸亚汞和氯化钠反应生成硫酸钠和轻粉。
材料2:轻粉微溶于水,可制成治疗疥疮的药物、在光照射下容易分解成汞和氯化汞。
(1)、请写出轻粉的一条物理性质:。(2)、轻粉的保存方法是。 -
11、人类生活和工农业生产都离不开水。下图是自来水厂净水过程示意图:
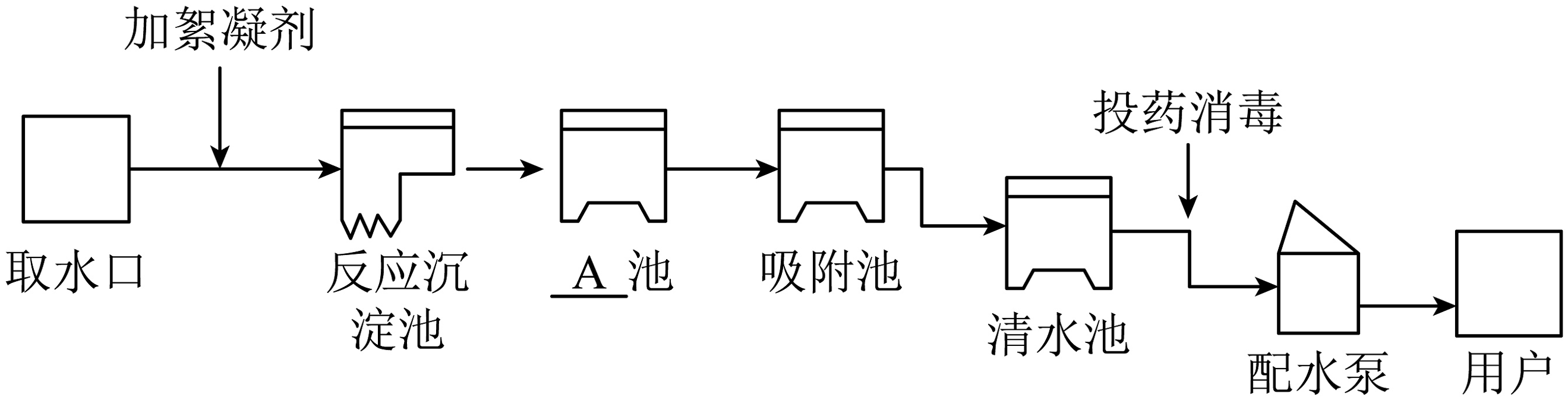
图中A池是池,在吸附池中一般使用的物质名称是。生活中可使用的方法来降低水的硬度。水是一切生命体生存所必需的物质,为了人类的生存和发展,人类必须爱护水资源,一方面要节约用水,另一方面要防治水体污染。
-
12、根据如图实验装置回答问题。
 (1)、进行该实验的目的是什么?(2)、该实验中能看到什么现象?
(1)、进行该实验的目的是什么?(2)、该实验中能看到什么现象? -
13、
分析下面的信息,可以知道分子有什么性质?
1滴水中约有1670000000000000000000个水分子
1个水分子的质量约为0.00000000000000000000000003千克
【知识小结】
(1)微粒(分子)的性质1:分子的和都很小。【交流讨论】分析以下生活与实验现象,可以知道分子还有什么性质?
①花香在空气中扩散②湿衣服中的水在晾晒下的挥发③蔗糖在水中的溶解④品红在水中的扩散。
【知识小结】
(2)微粒(分子)的性质2: -
14、实验室可用加热高锰酸钾制氧气,一段时间后停止加热,则试管内剩余固体物质最多有种,其中为黑色粉末的物质是。
-
15、如图是自然界中氧的部分循环示意图,分析并回答下列问题。
 (1)、从如图所示的①~⑥中选择合适的序号填空,产生氧气的有 , 消耗氧气的有①⑤和。(2)、下列关于氧气的有关说法正确的是_____(填字母序号)。A、氧气有百利而无一害 B、空气中氧气的浓度越高越好 C、空气中氧气的含量永远不变 D、空气中的氧处于动态平衡
(1)、从如图所示的①~⑥中选择合适的序号填空,产生氧气的有 , 消耗氧气的有①⑤和。(2)、下列关于氧气的有关说法正确的是_____(填字母序号)。A、氧气有百利而无一害 B、空气中氧气的浓度越高越好 C、空气中氧气的含量永远不变 D、空气中的氧处于动态平衡 -
16、为了更全面地认识氧气,兴趣小组同学以氧气为核心,开展以下主题式学习。
 (1)、唐代化学家马和最先发现氧气,他认为空气中存在“阴阳二气”,阳气比阴气多得多。则氧气属于马和认为的(填“阳气”或“阴气”)。(2)、现代科学认为空气中的氧气主要来源于。(3)、二百多年前,法国化学家拉瓦锡采用图1装置,用定量的方法研究了空气的成分,得出了空气由氧气和组成的结论。(4)、仿照该实验的原理,同学们采用图2装置测定空气中氧气的含量。该实验证明空气中氧气含量的现象是待红磷熄灭并冷却至室温后,打开弹簧夹,该实验还说明集气瓶中剩余气体具有的性质是(合理即可)(写1条)。
(1)、唐代化学家马和最先发现氧气,他认为空气中存在“阴阳二气”,阳气比阴气多得多。则氧气属于马和认为的(填“阳气”或“阴气”)。(2)、现代科学认为空气中的氧气主要来源于。(3)、二百多年前,法国化学家拉瓦锡采用图1装置,用定量的方法研究了空气的成分,得出了空气由氧气和组成的结论。(4)、仿照该实验的原理,同学们采用图2装置测定空气中氧气的含量。该实验证明空气中氧气含量的现象是待红磷熄灭并冷却至室温后,打开弹簧夹,该实验还说明集气瓶中剩余气体具有的性质是(合理即可)(写1条)。 -
17、如图所示,关于电解水实验叙述错误的是
 A、试管A中的气体能燃烧 B、试管B中的气体是氧气 C、电池的C端是负极 D、该实验证明水是由氢气和氧气组成的
A、试管A中的气体能燃烧 B、试管B中的气体是氧气 C、电池的C端是负极 D、该实验证明水是由氢气和氧气组成的 -
18、下列净化水的过程中,说法不正确的是A、活性炭可吸附水中的色素和有异味的物质 B、净水方法中,净化程度最高的是蒸馏 C、自来水厂净化水的方法主要有沉淀、过滤、吸附、消毒杀菌 D、明矾可以将硬水变成软水
-
19、下列物质中,含有氧分子的是A、液态氧 B、二氧化碳 C、过氧化氢 D、高锰酸钾
-
20、下列说法正确的是
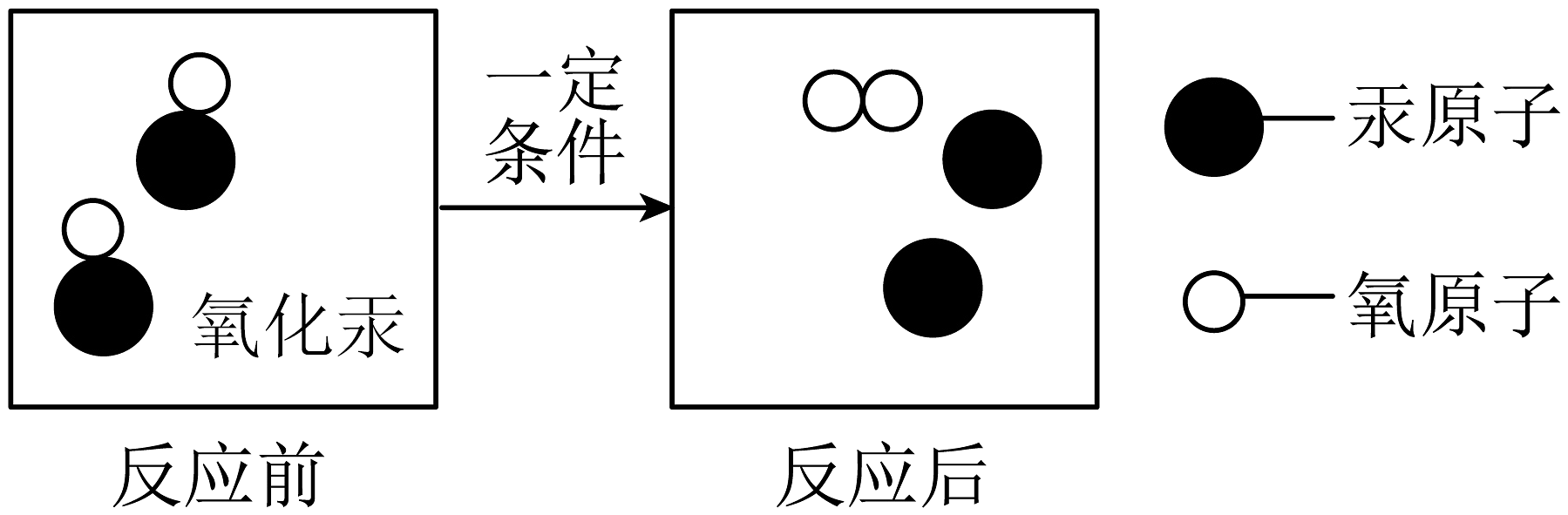 A、氧气由氧原子构成 B、反应后方框内包含的物质是混合物 C、该化学变化中的最小微粒是分子 D、反应前后分子的种类不变
A、氧气由氧原子构成 B、反应后方框内包含的物质是混合物 C、该化学变化中的最小微粒是分子 D、反应前后分子的种类不变