相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、下列按电解质、非电解质、酸性氧化物、碱的组合,正确的是
选项
电解质
非电解质
酸性氧化物
碱
A
盐酸
蔗糖
CO
KOH
B
CaSO4
乙醇
CO2
NH3·H2O
C
氯化钠
石墨
SiO2
Mg(OH)2
D
固体CaCl2
醋酸
Fe2O3
纯碱
A、A B、B C、C D、D -
2、美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成,直径约6到9纳米。“纳米车”可以用来运输单个的有机分子。下列说法正确的是
 A、人们用肉眼可以清晰看到“纳米车”的运动 B、C60是一种新型的化合物 C、C60与石墨都是碳元素的同素异形体 D、“纳米车”是一种比较稳定的胶体
A、人们用肉眼可以清晰看到“纳米车”的运动 B、C60是一种新型的化合物 C、C60与石墨都是碳元素的同素异形体 D、“纳米车”是一种比较稳定的胶体 -
3、
I.A是一种重要的化工原料NaCl,可以制备多种物质。下图所列物质中,C、D、E均为单原,其中D是一种黄绿色气体,C在D中燃烧时发出苍白色火焰,B是一种强碱,焰色试验火焰呈黄色,H是一种混合物,其水溶液具有漂白性。

(1)B是、F是(以上均写化学式)。
(2)写出图中D生成H的化学方程式 , 当反应中消耗21.3gD时,转移的电子数是。
(3)高温时,将金红石(主要成分是TiO2)、焦炭和D混合反应,得到一种可燃性气体和另一种化合物(由Ti元素和D所含元素组成,其中Ti为+4价,相对分子质量为190)。写出上述反应的化学方程式。
Ⅱ.栲胶法脱除煤气中硫化氢的工艺流程示意如下:

“吸收”步骤除了生成NaHCO3外,还生成了NaHS,“脱硫”步骤的中间产物可与“吸收”步骤中生成的NaHCO3反应,实现Na2CO3的再生。
“氧化I”发生反应的化学方程式为:Na2V4O9+2NaOH+ H2O+TE(醌态)=TE(酚态)+4NaVO3
(4)NaVO3中V的化合价是。
(5)“氧化I”步骤的作用是。
(6)该流程总反应的化学方程式为。
-
4、为探究过氧化钠与H2O和CO2的反应,设计了如下图实验。已知Na2O2与HCl气体能发生反应,请回答下列问题。
 (1)、连接好装置,加药品前需要进行的操作是。(2)、装置A中发生的化学反应方程式是。(3)、装置B的作用是。(4)、检验装置E中收集的气体方法是。(5)、为探究反应后固体组成,待装置中固体由淡黄色完全变为白色,将该固体溶于水并进行如下操作:
(1)、连接好装置,加药品前需要进行的操作是。(2)、装置A中发生的化学反应方程式是。(3)、装置B的作用是。(4)、检验装置E中收集的气体方法是。(5)、为探究反应后固体组成,待装置中固体由淡黄色完全变为白色,将该固体溶于水并进行如下操作:实验步骤
实验现象
实验结论
I.取少量溶液于试管中,加入足量氯化钡溶液,静置
产生白色沉淀
①固体中含有
Ⅱ.取适量I的上层清液于试管中,向其中滴加少量氯化铜溶液
产生蓝色沉淀
②固体中含有
③写出装置C中发生反应的化学方程式。(写其中一个)
(6)、某小组同学采用如下实验探究碳酸钠和碳酸氢钠的性质。①取两支试管分别加入1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是(填化学式,下同);继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是。
②按如下图所示方式进行实验,观察到的现象有开始无气泡,溶液颜色由红色变为浅红色,最后出现大量气泡。

请用离子方程式解释,“开始无气泡”的原因: , 最后出现大量气泡。
-
5、
I.根据物质的组成、结构、性质等进行分类,可预测物质的性质及变化:
(1)SiO2是普通玻璃的主要成分,与CO2一样是酸性氧化物,写出SiO2溶于NaOH溶液的化学方程式:________。(2)现有:①固体KOH②稀硫酸③氨气④熔融NaCl⑤蔗糖⑥铜;其中能导电的是________(填序号,下同);属于电解质的是________。(3)铜绿Cu2(OH)2CO3溶于硫酸溶液的离子方程式:________。Ⅱ.物质的量是联系宏观和微观的桥梁:
(4)28.5g某金属氯化物MCl2中含0.6molCl- , 则该氯化物的摩尔质量为________。(5)标准状况下,与17g的H2S气体含相同H原子数的CH4的体积为________。(6)下列叙述错误的是_______。(单选题)A. 雾属于胶体,能产生丁达尔效应 B. 可以用过滤方法提纯NaCl的淀粉溶液 C. 明矾、硫酸铁可以净水,净水原理和胶体有关 D. 胶体在一定条件下能稳定存在,属于介稳体系 -
6、“价—类二维图”是学习元素及其化合物知识的高效模型,有关氯的“价—类二维图”说法错误的是
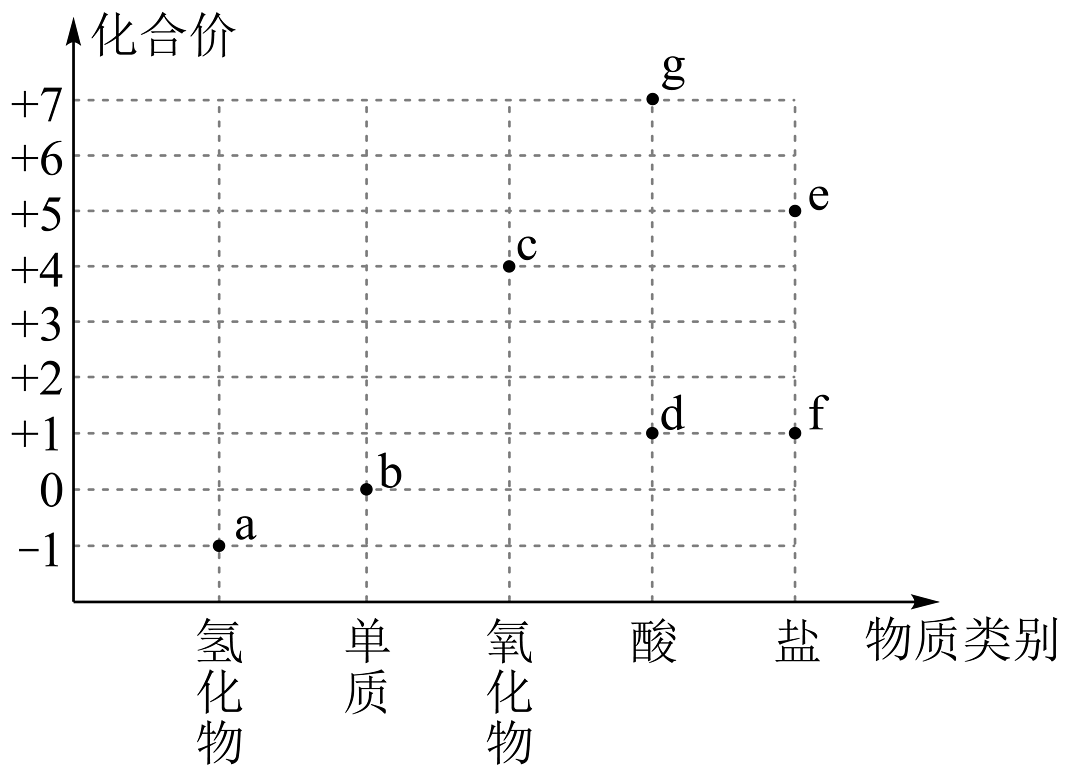 A、e的某种常见化合物可以用于实验室制备O2 B、将b通入盛有鲜花的试剂瓶,鲜花褪色,说明b具有漂白性 C、类比d的分子式,g的分子式为HClO4 , 是氯元素的最高价态 D、b、c、f都能作为消毒剂,84消毒液的有效成分是f的钠盐,作用原理是与空气中的水和二氧化碳反应生成d
A、e的某种常见化合物可以用于实验室制备O2 B、将b通入盛有鲜花的试剂瓶,鲜花褪色,说明b具有漂白性 C、类比d的分子式,g的分子式为HClO4 , 是氯元素的最高价态 D、b、c、f都能作为消毒剂,84消毒液的有效成分是f的钠盐,作用原理是与空气中的水和二氧化碳反应生成d -
7、下列选项中除杂试剂(括号内)选用正确的是( )A、除去碳酸钠溶液中的碳酸氢钠(盐酸) B、除去二氧化碳中的水蒸气(生石灰) C、除去氢氧化钠溶液中的碳酸钠(氯化钙) D、除去二氧化碳中的少量一氧化碳(灼热的氧化铜)
-
8、下列实验操作、现象及结论都正确的是
实验操作
现象
实验结论
A
用玻璃棒蘸取某溶液置于酒精灯外焰上灼烧
火焰呈黄色
该溶液不一定含有NaCl
B
将Na2O2与水混合,滴加几滴酚酞溶液
酚酞变红后不褪色
生成了碱性物质
C
先加稀盐酸除去OH- , 再加AgNO3
有白色沉淀产生
验证碱溶液中是否含有Cl-
D
将金属钠投入CuSO4溶液中
溶液有红色固体析出
证明金属活动性:Na>Cu
A、A B、B C、C D、D -
9、用表示阿伏加德罗常数的值,下列叙述正确的是A、中含有的阴离子数为 B、个水分子的质量为 C、含有分子,体积为 D、标准状况下,中含有的氢原子数为
-
10、在给定的条件下,下列选项所示物质间的转化均能实现的是A、 B、 C、 D、
-
11、下列单、双线桥的表示方法正确的是A、
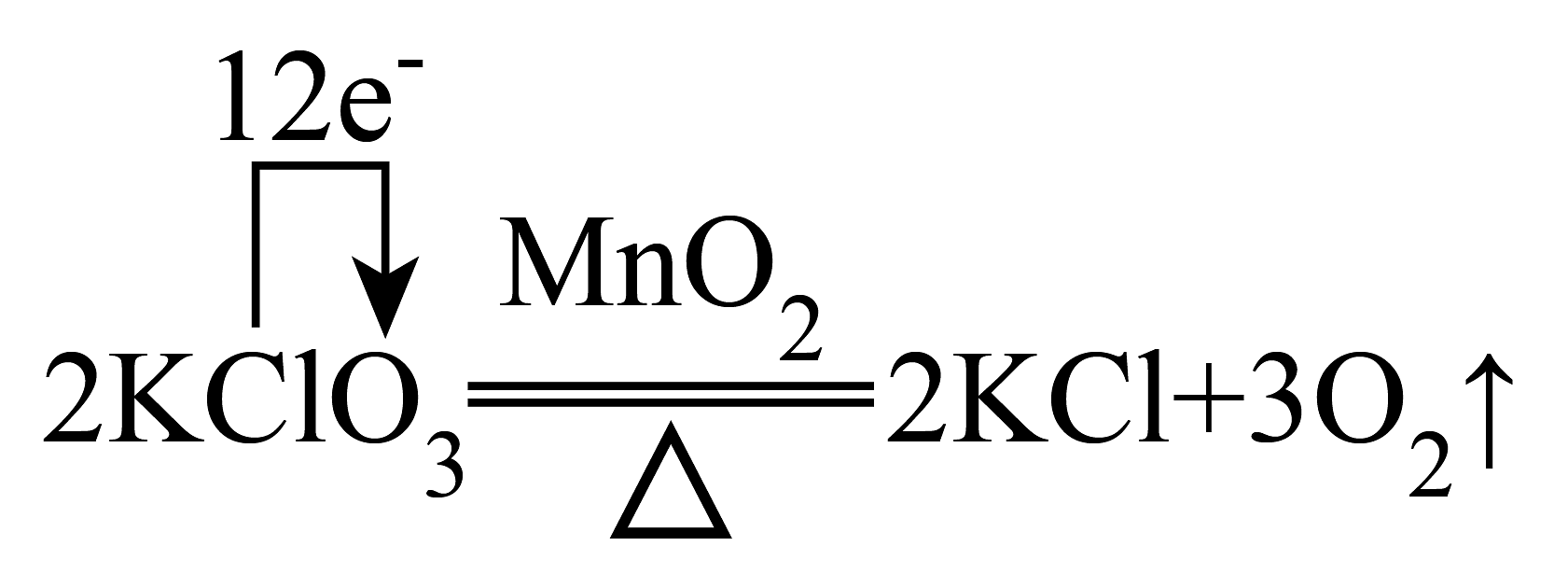 B、
B、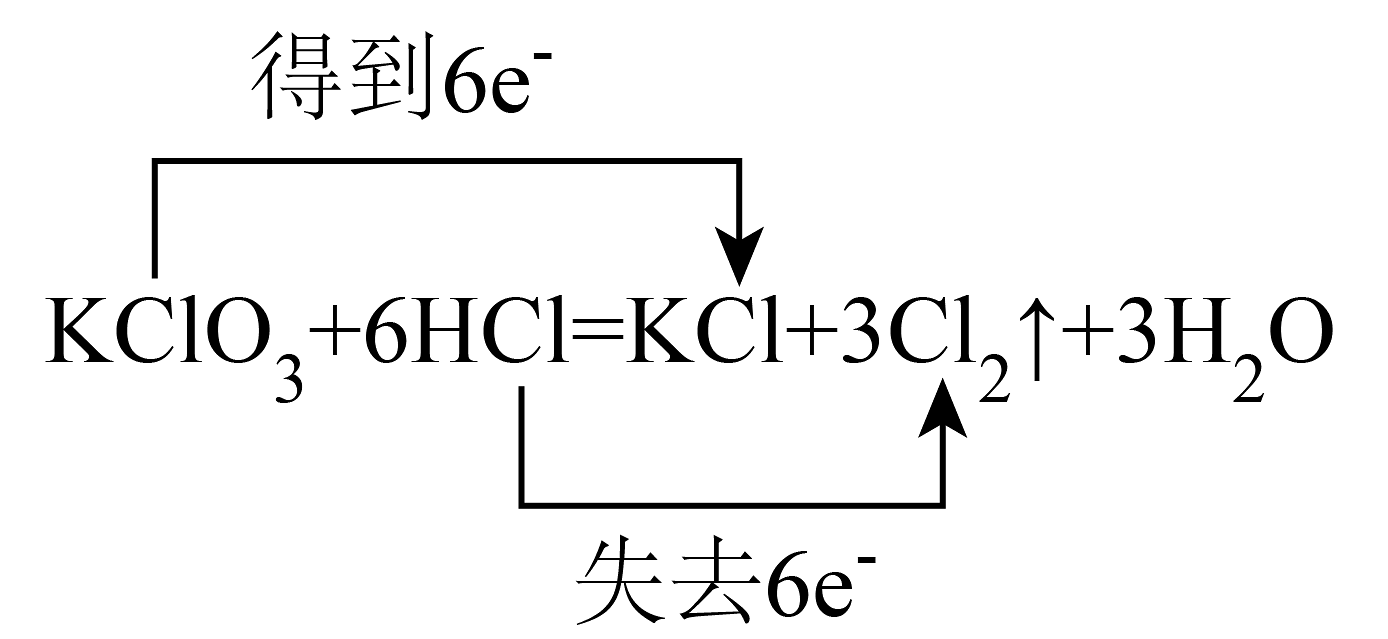 C、
C、 D、
D、
-
12、下列有关氧化还原反应的叙述正确的是A、在氧化还原反应中,被氧化与被还原的硫原子数之比为1∶2 B、含有最高价元素的化合物一定具有强氧化性 C、某元素由化合态变为游离态,一定被还原 D、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
-
13、下列离子方程式书写正确的是A、氯气跟水反应: B、稀硫酸与氢氧化钡溶液反应: C、碳酸氢钠溶液与氢氧化钠溶液反应: D、少量澄清石灰水中加入过量:
-
14、化学与生活息息相关,下列有关物质的性质、用途的叙述,正确的是A、洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的易分解 B、纯碱和小苏打的溶液均显碱性,可用作食用碱或工业用碱 C、用于呼吸面具,活性炭用于防毒面具,两者原理相同 D、用稀硫酸清洗做焰色试验的铁丝
-
15、下列说法正确的是A、H2O和H2O2组成元素相同,所以二者为同素异形体 B、金属氧化物一定是碱性氧化物 C、O2转化为O3的过程为物理变化 D、FeSO4·7H2O属于纯净物、化合物、盐、电解质
-
16、高铁酸钾是一种新型、高效、多功能净水剂。它能溶于水,微溶于KOH浓溶液,具有强氧化性,其氧化性强于。在酸性或中性溶液中快速分解,在碱性溶液中较稳定。工业上湿法制备的流程如下:
 (1)、的电离方程式为。(2)、“反应”中氧化剂和还原剂的物质的量之比:。(3)、“转化”步骤得到固体,分析该转化能发生的原因是。(4)、相比于 , 若以作为铁源,高铁酸钾产率较低的原因是。(5)、对比、、三种物质对废水中有机污染物去除效果如下图所示(三种试剂的初始浓度均为)。
(1)、的电离方程式为。(2)、“反应”中氧化剂和还原剂的物质的量之比:。(3)、“转化”步骤得到固体,分析该转化能发生的原因是。(4)、相比于 , 若以作为铁源,高铁酸钾产率较低的原因是。(5)、对比、、三种物质对废水中有机污染物去除效果如下图所示(三种试剂的初始浓度均为)。
已知:①在水中会发生:。
②COD(化学需氧量)是一个重要的有机物污染参数。COD值越高,表示水中有机污染物越重。由上图分析,高铁酸钾作为净水剂的优点是。
-
17、氯的很多化合物既是重要的化工原料,又是高效、广谱的灭菌消毒剂。
已知:也是一种优良的消毒剂,常温下为黄绿色气体,易溶于水而不与水反应。常将其制成固体,以便运输和贮存,但高于60℃时会分解。
过氧化氢法制备固体的流程如下图所示:
 (1)、的氯元素化合价为。(2)、“废液”中回收得到的主要物质是(填化学式)。(3)、在“制备”流程中,也可改用其他物质代替,最宜选用______。A、 B、酸性高锰酸钾 C、金属锌(4)、流程中所需的可由、与酸反应制得。实验室通过上述某种过氧化物与适量稀硫酸反应,过滤后即可制得较纯净的溶液,则最好选择的过氧化物是。(5)、关于上述流程出现物质和操作,下列说法正确的是______。A、与氯气从颜色上难以区分 B、可以用向下排空气法收集 C、在“吸收”流程中,作还原剂 D、“结晶”可采用蒸发结晶法(6)、也可制得一种有效成分为、、的“二氧化氯泡腾片”,能快速溶于水,得到溶液,并溢出大量气泡。
(1)、的氯元素化合价为。(2)、“废液”中回收得到的主要物质是(填化学式)。(3)、在“制备”流程中,也可改用其他物质代替,最宜选用______。A、 B、酸性高锰酸钾 C、金属锌(4)、流程中所需的可由、与酸反应制得。实验室通过上述某种过氧化物与适量稀硫酸反应,过滤后即可制得较纯净的溶液,则最好选择的过氧化物是。(5)、关于上述流程出现物质和操作,下列说法正确的是______。A、与氯气从颜色上难以区分 B、可以用向下排空气法收集 C、在“吸收”流程中,作还原剂 D、“结晶”可采用蒸发结晶法(6)、也可制得一种有效成分为、、的“二氧化氯泡腾片”,能快速溶于水,得到溶液,并溢出大量气泡。①上述过程中,溢出大量气泡的离子方程式是。
②生成的离子方程式为: , 每生成转移电子的物质的量为mol。
③在杀菌消毒过程中会产生副产物NaClO,实验室可用与NaClO反应将其转化为NaCl而除去,其反应的化学方程式为。
(7)、国家对饮用水中的含量有具体要求,实验室通过滴定法测定含氯消毒剂消毒后的饮用水中含量,具体操作如下:准确移取25.00mL饮用水样品溶液于锥形瓶中,加入5%的溶液作指示剂,用的标准溶液滴定至终点,共消耗标准溶液12.50mL。该饮用水样品中为。(写出计算过程) -
18、
碳酸钠可作为基准物质用于定量分析,也可作制备过碳酸钠的原料。
Ⅰ.实验室某瓶碳酸钠溶液瓶体部分标签如图所示。
试剂名称:Na2CO3溶液
【溶质】Na2CO3
【Na2CO3摩尔质量】106g/mol
【质量分数】10.6%
【密度】1g/mL
(1)某实验需用500 mL0.1 mol/L的Na2CO3溶液,现用该“Na2CO3溶液”配制,需要用量筒量取该“Na2CO3溶液”的体积为 mL。在配制过程中,除需要量筒、烧杯、玻璃棒外还必需的玻璃仪器有 。
Ⅱ.数字实验能更清晰地的呈现实验现象。为认识碳酸钠和碳酸氢钠性质做如下实验:

(2)分别取20 mL0.1 mol/L的Na2CO3和NaHCO3溶液,用分液漏斗缓慢滴加0.1 mol/L的稀盐酸,用压强传感器测定容器中的压强变化如图-1所示。图中曲线 (填“A”或“B”)代表碳酸钠。
(3)现取样品的质量为5 mg,做NaHCO3热分解实验,其热重曲线(TG)和失重速率曲线(DTG)如图-2所示(图a为热重曲线,图b为失重速率曲线)。由图像可知,NaHCO3受热易分解,在 ℃分解速率最大。
Ⅲ.过碳酸钠(3Na2CO3·2H2O2)具有Na2CO3和H2O2的双重性质,受热易分解,遇潮易产生氧气。可由Na2CO3饱和溶液与30%的H2O2制备过碳酸钠,装置如图-3所示,回答下列问题:
(4)装置X的名称为 。
(5)反应需在10~15℃进行,温度不能过高的理由是 。控制温度的措施有冷水浴、 。
-
19、
Ⅰ.每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数相似。试用物质的量的相关知识回答以下问题:
(1)3.01×1023个OH-的质量为________g,1 mol O2中含有的质子个数约为________。
(2)标准状况下,6.4 g某气体的体积是8.96 L,则此气体的相对分子质量为________。
Ⅱ.现有以下物质:
①NaOH溶液;②液氨;③CaCO3固体;④熔融NaHSO4;⑤铜;
(3)其中属于属于电解质的________(填序号);能导电的是________(填序号)。
Ⅲ.已知:。
(4)用“单线桥”在化学方程式中标出电子转移的方向和数目。
(5)若参加反应的K2Cr2O7的物质的量为0.1 mol,则产生标准状况下氯气的体积为________L,被氧化的HCl质量为________g。
-
20、将加氢制甲醇 , 可实现资源化利用和“零碳”排放,其转化流程如图所示。下列说法不正确的是
 A、反应①中,电解水生成的和的物质的量之比为2:1 B、反应②中,生产理论上要消耗标准状况下 C、转化过程中,和循环转化,无需额外补充 D、制取等质量的甲醇时消耗的与燃烧时生成的相等,实现“零碳”排放
A、反应①中,电解水生成的和的物质的量之比为2:1 B、反应②中,生产理论上要消耗标准状况下 C、转化过程中,和循环转化,无需额外补充 D、制取等质量的甲醇时消耗的与燃烧时生成的相等,实现“零碳”排放