相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、 , 该反应可除去脉石(主要成分为SiO2)的反应属于A、化合反应 B、分解反应 C、置换反应 D、复分解反应
-
2、下图仪器中名称为分液漏斗的是A、
 B、
B、 C、
C、 D、
D、
-
3、无水硫酸铜可检验水的存在,其摩尔质量为A、160 g B、160 g/ mol C、250 g D、250 g/mol
-
4、地球被空气包围,空气中含量最高的元素是A、O B、H C、N D、C
-
5、俗名往往能体现物质的组成和性质,下列对俗名解释不正确的是A、食盐:可作食物的食品调味剂 B、铁红:可作红色颜料 C、苛性钠:可作胃酸中和剂 D、水银:常温下银白色的汞为液体
-
6、NaClO是消毒剂。它属于A、酸 B、碱 C、盐 D、单质
-
7、如下图所示的循环,下列说法正确的是
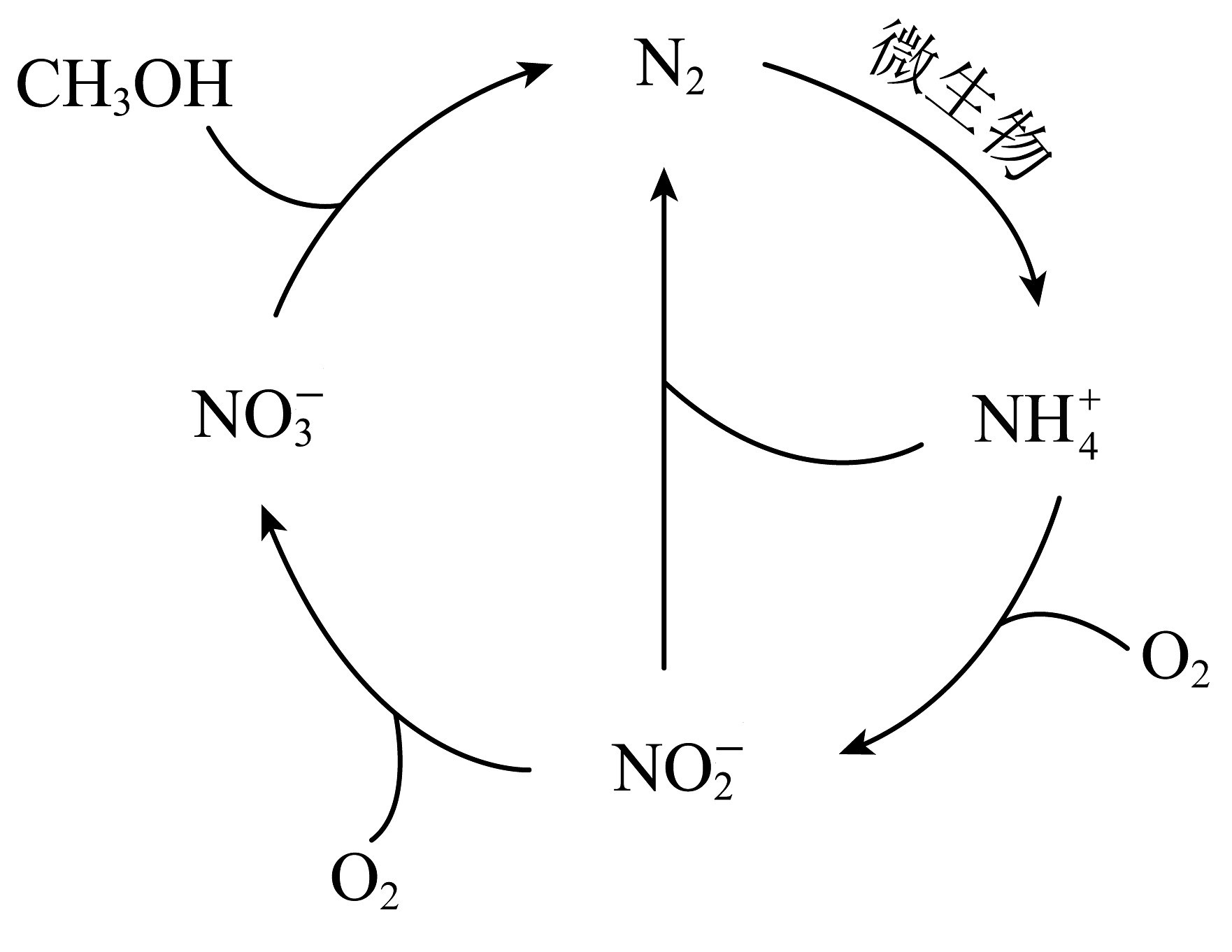 A、该循环为碳循环 B、该循环为氮循环 C、转化成属于氮的固定 D、图中氮的化合价仅有0、+3、+5
A、该循环为碳循环 B、该循环为氮循环 C、转化成属于氮的固定 D、图中氮的化合价仅有0、+3、+5 -
8、Deacon催化氧化法处理HCl废气,可实现氯资源的再利用。(1)、Deacon氧化反应为 , CuO是该方法中常用的催化剂,其催化机理如图所示。

①图中转化涉及的反应中,发生化合价变化的元素有(填元素符号)。
②根据上述机理,反应制得1mol , 须投入(填序号)CuO。
A.少量 B.2mol C.4mol D.足量
(2)、负载在上的也可用作Deacon催化氧化的催化剂。和的晶胞结构均如图所示,且二者晶胞体积近似相等,与的密度比为1.66。
①当晶体中有O原子脱出时,出现O空位,此时Ru的化合价(填“升高”“降低”或“不变”)。
②Ru的相对原子质量为(精确至1)。
(3)、将HCl和分别以不同起始流速通入装有催化剂的反应器,在360℃、400℃和440℃下分别发生Deacon氧化反应,通过检测不同温度下反应器出口处气体成分绘制HCl的转化率(α)曲线如图所示(较低流速下转化率可近似为平衡转化率)。
①图中℃。
②下列措施可提高M点HCl的转化率的是(填序号)。
A.增大HCl的流速 B.将温度升高40℃ C.增大 D.使用更高效的催化剂
③图中较高流速时,小于和 , 原因是。
④设N点的转化率为平衡转化率,则该温度下反应的平衡常数K=(用平衡时气体物质的量分数代替气体平衡浓度计算)。
-
9、从铅精矿(主要含PbS、等)中提取金属Pb和Ag的工艺流程如下:
 (1)、“热浸”时,难溶的PbS和转化为和及单质硫。
(1)、“热浸”时,难溶的PbS和转化为和及单质硫。①写出转化为的离子方程式:。
②浸取液中盐酸的浓度不宜过大,除防止“热浸”时HCl挥发外,另一目的是防止产生(填化学式)。
(2)、“过滤Ⅰ”得到的滤液经“稀释、冷却”得到沉淀,再经“过滤Ⅱ”将沉淀分离。沉淀反复用饱和食盐水“热溶”,所得溶液经“电解Ⅰ”可获得金属Pb。①“过滤Ⅰ”得到的滤液经“稀释”可得到沉淀,其原因是。
②“电解Ⅰ”的阳极产物用“尾液”吸收所得的吸收液,可直接用于此工艺中的(填题干工艺流程方框中的操作名称),从而实现循环利用。
(3)、“还原”中加入铅精矿的目的是。(4)、经“置换”得到的富银铅泥主要为金属Pb和Ag的混合物。①“置换”中可选用的试剂X为(填序号)。
A.Al B.Zn C.Pb D.Ag
②补充完整运用电解原理分离金属Pb和Ag的实验方案:将富银铅泥压实制成块状,。
-
10、F是合成心血管药物缬沙坦的重要中间体,其合成路线如下:

已知:。
(1)、A分子中的官能团名称为氰基(—CN,其中C原子和N原子以三键相连接)和。(2)、B→C的反应类型为。(3)、D的分子式为 , 其分子中最多有个原子在同一个平面内。(4)、C还可直接与E在乙醇作溶剂条件下合成F。①E的结构简式为。
②C和E直接转化为F时,还生成(填化学式)。
(5)、亮氨酸为E的一种同分异构体,属于α-氨基酸,其分子结构中含有异丙基。则亮氨酸的结构简式为。(6)、C→D的合成路线可设计为CG()D①试剂X为。
②试剂Y不能选用 , 原因是。
-
11、探索固氮机理,实现温和条件下固定空气中的具有重要意义。(1)、自然界中的一些微生物能将转化为含氮化合物,约占自然固氮的90%。
①豆科植物根瘤中的固氮酶能将直接转化为化合态的(填化学式)作为自身的养分。
②固氮酶中的过渡金属原子能与形成分子氮配合物,从而活化。在分子氮配合物中,可作为配位体的原因是。
③1965年,人类合成了第一个分子氮配合物 , 该配合物的配位数为。
(2)、在如图所示装置中,用石墨作电极,含的酸性溶液作电解质,和的混合物作阴极原料气,在常温下电解即可获得 , 电解时在阴极区检测到、·OH、等。
①转化为与阴极区产物有关,电解生成的电极反应式为。
②若将直接通过溶液,一段时间后,溶液中仅检测到微量的。
研究表明,是该固氮过程的催化剂,其反应机理可表述为:(填离子方程式)、、。
③被·OH氧化为的过程中经历了中间体。该物质的红外光谱中有N=N吸收峰,核磁共振氢谱中仅有一个特征峰,写出两种可能的结构式:。
④控制电解电压、电解质溶液pH、阴极原料气和的比例和流速保持不变,增大溶液的浓度,反应相同时间测得的产率先增大后减小,溶液浓度过大,产率下降的原因是。
-
12、常温下,向20mL 0.1的NaOH溶液中缓慢滴入0.1的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示。已知:常温下HCOOH的电离常数。下列说法不正确的是
 A、水的电离程度:M<N B、M点: C、N点: D、当V(HCOOH)=10mL时,
A、水的电离程度:M<N B、M点: C、N点: D、当V(HCOOH)=10mL时, -
13、室温下,下列实验过程和现象能验证相应实验结论的是
选项
实验方案过程和现象
实验结论
A
用玻璃棒分别蘸取0.1 HCl和溶液滴到pH试纸上,溶液pH(HCl)<pH()
酸性:HCl>
B
向2mL 溶液中加入Mg条,产生无色气体,并有红褐色沉淀生成
金属活动性:Mg>Fe
C
向2mL饱和溶液中通入 , 出现白色沉淀
电离平衡常数:
D
向2mL浓度均为0.1的和混合溶液中滴加少量0.1溶液,振荡,产生白色沉淀
溶度积常数:
A、A B、B C、C D、D -
14、天然单糖D-乙酰氨基葡萄糖的结构简式如图。下列有关该物质的说法正确的是
 A、分子式为 B、与葡萄糖互为同系物 C、能发生缩聚反应 D、分子中含3个手性碳原子
A、分子式为 B、与葡萄糖互为同系物 C、能发生缩聚反应 D、分子中含3个手性碳原子 -
15、阅读下列材料,完成下面小题:
人类对酸碱的认识经历了漫长的时间。最早的酸碱概念由Robert Boyle于1663年提出,1887年Arrhenius提出了酸碱电离理论,1923年J.N.Bronsted和Lowry提出了酸碱质子理论。酸碱质子理论认为:凡是能够给出质子的物质都是酸;凡是能够接受质子的物质都是碱。酸碱的概念不断更新,逐渐完善,其他重要的酸碱理论还有酸碱溶剂理论和酸碱电子理论等。
(1)、下列物质的性质与用途具有对应关系的是A、硫酸可电离出和 , 可用作铅蓄电池的电解质 B、盐酸易挥发,可用作金属表面除锈剂 C、微溶于水,可用于改良酸性土壤 D、为两性氢氧化物,其胶体可用于净水(2)、下列涉及酸或碱的化学反应表示正确的是A、Al粉和NaOH溶液反应制取少量: B、室温下用稀溶解Cu: C、室温下用NaOH溶液吸收: D、向溶液中加入稀:(3)、向盛有足量液氨的容器中投入23g钠,钠沉入容器底部,迅速发生溶剂化,生成蓝色的溶剂合电子(过程示意如图),随后缓慢产生 , 待停止产生气泡,经分离获得纯净的氨基钠()。下列说法不正确的是 A、液氨属于纯净物 B、导电性:蓝色溶液>液氨 C、当溶液中放出0.2mol时,Na共失去0.4mol电子 D、按酸碱质子理论,既可作为酸,又可作为碱(4)、破损的镀锌铁皮在氨水中发生腐蚀生成和。下列说法不正确的是A、该腐蚀过程属于电化学腐蚀 B、生成的反应为 C、氨水浓度越大,腐蚀趋势越大 D、随着腐蚀的进行,溶液pH变大
A、液氨属于纯净物 B、导电性:蓝色溶液>液氨 C、当溶液中放出0.2mol时,Na共失去0.4mol电子 D、按酸碱质子理论,既可作为酸,又可作为碱(4)、破损的镀锌铁皮在氨水中发生腐蚀生成和。下列说法不正确的是A、该腐蚀过程属于电化学腐蚀 B、生成的反应为 C、氨水浓度越大,腐蚀趋势越大 D、随着腐蚀的进行,溶液pH变大 -
16、下列工业生产或处理过程涉及的物质转化关系不正确的是A、消除污染物: B、去除难溶物: C、合成聚合物:
 D、制备配合物:
D、制备配合物:
-
17、汽车尾气净化装置中发生反应。下列说法正确的是A、电离能: B、电负性: C、中C原子轨道杂化方式为 D、中键和键数目之比为1:2
-
18、实验室中利用下图装置验证铁与水蒸气的反应。

下列说法不正确的是
A、反应为 B、使用硬质玻璃试管盛装还原铁粉 C、用火柴点燃肥皂泡检验生成的氢气 D、酒精灯移至湿棉花下方实验效果更好 -
19、主要用作玻璃和搪瓷乳白剂。下列说法正确的是A、中仅含离子键 B、灼烧时火焰呈黄色 C、原子半径: D、热稳定性:
-
20、我国科学家在月壤中发现一种新矿物——嫦娥石[],探月工程取得重大进展。下列元素属于非金属元素的是A、磷(P) B、钙(Ca) C、铁(Fe) D、钇(Y)