相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、下列反应离子方程式不正确的是A、过量CO2通入NaOH 溶液:CO2+OH−=HCO B、向血红色Fe(SCN)3溶液加入过量铁粉:2Fe3++Fe=3Fe2+ C、苯酚的悬浊液中滴加氢氧化钠溶液:C6H5OH+OH-→C6H5O-+H2O D、Na2SO3溶液中滴入足量氯水:SO+H2O+Cl2=SO+2H++2Cl-
-
2、关于反应2NO+2+2H2O=N2+4HSO , 下列说法不正确的是A、生成0.5mol N2 , 转移4mol电子 B、N2是还原产物 C、S2O发生氧化反应 D、还原剂和氧化剂之比为1:1
-
3、下列关于元素及其化合物的性质说法不正确的是A、工业上焦炭与石英砂制得含少量杂质的粗硅 B、Al和NaOH溶液反应可生成H2 C、高温下Fe与水蒸气反应生成Fe2O3 D、NaHCO3溶于水,伴随吸热现象
-
4、下列说法正确的是A、Cr3+的最外层电子排布式:3s23p63d3 B、乙醇的分子式:C2H5OH C、OF2分子的空间结构为直线形 D、NCl3的电子式:

-
5、硫酸钙应用广泛,下列说法不正确的是A、生石膏的化学式为CaSO4·2H2O B、含有硫酸钙的盐卤能使蛋白质变性,可制作豆腐 C、Ca元素位于周期表的s区 D、往煤中添加一些石灰石,燃煤过程中产生的SO2能转化为硫酸钙
-
6、下列物质中属于碱性氧化物的是A、SO2 B、Al2O3 C、CaO D、Na2O2
-
7、实验室通过下列过程制取草酸亚铁晶体。

已知:
下列说法不正确的是
A、的溶液中: B、“酸化”后的溶液中: C、不可以用酸性溶液检验“沉淀”后的上层清液中是否含有 D、水洗后,再用乙醇洗涤有利于晶体快速干燥 -
8、一种点击化学方法合成聚硫酸酯(W)的路线如下所示:

下列说法正确的是
A、双酚A是苯酚的同系物,可与甲醛发生聚合反应 B、 催化聚合也可生成W
C、生成W的反应③为缩聚反应,同时生成
催化聚合也可生成W
C、生成W的反应③为缩聚反应,同时生成 D、在碱性条件下,W比聚苯乙烯更难降解
D、在碱性条件下,W比聚苯乙烯更难降解
-
9、温室气体在催化剂作用下可分解为和 , 也可作为氧化剂氧化苯制苯酚。下列说法错误的是A、原子半径: B、第一电离能: C、在水中的溶解度:苯<苯酚 D、苯和苯酚中C的杂化方式相同
-
10、研究脱除烟气中的是环境保护、促进社会可持续发展的重要课题。(1)、烟气中的可在催化剂作用下用还原。
已知:
①有氧条件下,与反应生成 , 相关热化学方程式为。
将模拟烟气(一定比例和)以一定流速通过装有催化剂的反应管,测得相同时间内转化率随温度变化的曲线如图所示。

②温度低于时,转化率随温度升高而增大,其可能原因是。
③温度高于时,转化率已降低为负值,其可能原因是。
(2)、臭氧是一种理想的烟气脱硝剂。脱硝发生反应。时,向恒容密闭容器中充入和 , 反应过程中测定的部分数据见下表:0
3
6
12
24
0
0.36
0.60
0.80
0.80
①反应在内的平均速率。
②下列描述中能说明上述反应已达平衡的是。(填字母)
a.混合气体密度不再变化
b.单位时间内消耗的同时生成
c.
d.混合气体压强不再变化
③时,上述脱硝反应的化学平衡常数等于。
(3)、尿素溶液可吸收含烟气中的 , 其反应为。若吸收烟气时同时通入少量 , 可同时实现脱硫、脱硝。①脱硝的反应分为两步。
第一步:。
第二步:和反应生成和。第二步的化学反应方程式为。
②将含烟气以一定的流速通过10%的溶液,其他条件相同,不通和通少量时的去除率如图所示。通少量时的去除率较低的原因是。
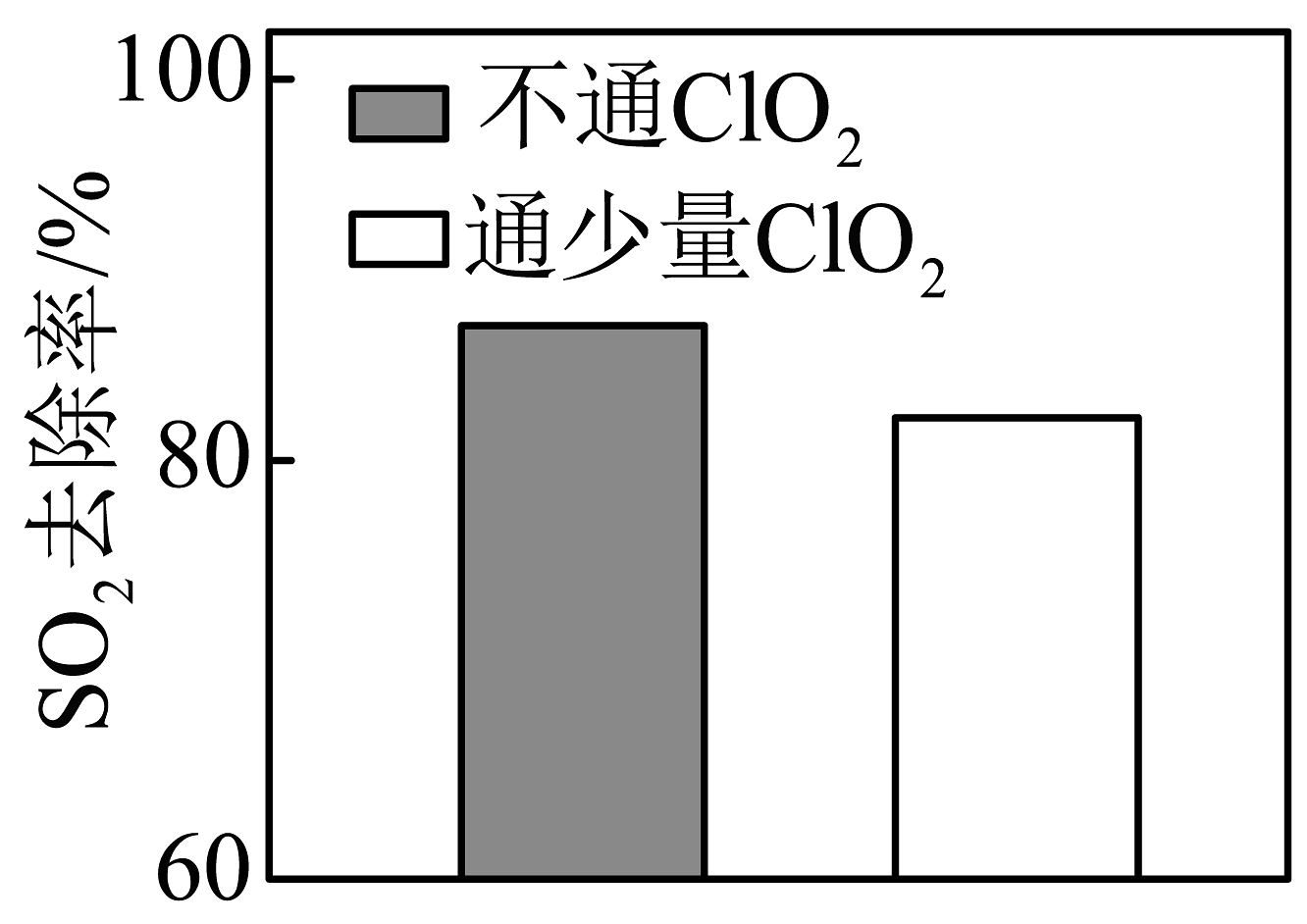
-
11、高氯酸铜易溶于水,开始分解,常用于生产电极和作催化剂等,可由氯化铜等试剂制备。是易挥发的发烟液体,温度高于易爆炸。下表列出相应金属离子生成氢氧化物沉淀的(开始沉淀的按金属离子浓度为):
金属离子
开始沉淀
沉淀完全
1.1
3.2
5.8
8.8
4.7
6.7
(1)、将和用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色沉淀。①写出生成沉淀的化学方程式。
②检验沉淀是否洗涤干净的操作。
(2)、向沉淀中滴加稍过量的小心搅拌,适度加热后得到蓝色溶液同时会产生大量的白雾。①大量的白雾的成分是(填化学式)。
②适度加热但温度不能过高的原因是。
(3)、时,若调节溶液 , 则溶液中的的物质的量浓度为。(4)、某研究小组欲用粗固体(含)制备纯净的无水氯化铜固体。请补充完整由粗固体制备纯净的无水氯化铜固体的实验步骤:①将粗固体溶于适量;②边搅拌边缓慢加入适量并充分混合,直至取少量溶液于试管中加入 , 停止滴加;③边搅拌边分批加入 , 停止加入,过滤;④往滤液中加入盐酸,将滤液蒸发浓缩至表面出现晶膜, , 过滤、冰水洗涤、低温干燥,得到晶体;⑤将晶体在加热至质量恒重为止,得到无水氯化铜固体。(可选用的试剂:蒸馏水、稀盐酸、溶液和气体、铁氰化钾溶液)
-
12、草酸是一种二元酸。已知在常温下,草酸的电离常数。草酸钙。请回答下列问题:(1)、常温下,在足量溶液中加入少量固体,发生反应:。该反应的化学平衡常数:K=。[用表示](2)、一水草酸钙制备方法如下:
步骤I:用精制氯化钙溶液与草酸溶液共热,过滤,洗涤,将固体溶于热盐酸中;
步骤II:加氨水反应得一水草酸钙,过滤,热水洗涤,在干燥得产品。
写出步骤II反应的化学方程式。
(3)、通过下列方法测定的纯度:取样品于锥形瓶中,加入的溶液溶解,再稀释至。从锥形瓶中取溶液,用的标准溶液滴定,消耗标准溶液。①滴定终点的现象:。
②计算的纯度(写出计算过程)。
(4)、为研究一水草酸钙的热分解性质,进行如下实验:准确称取样品加热,样品的固体残留率)随温度的变化如下图所示。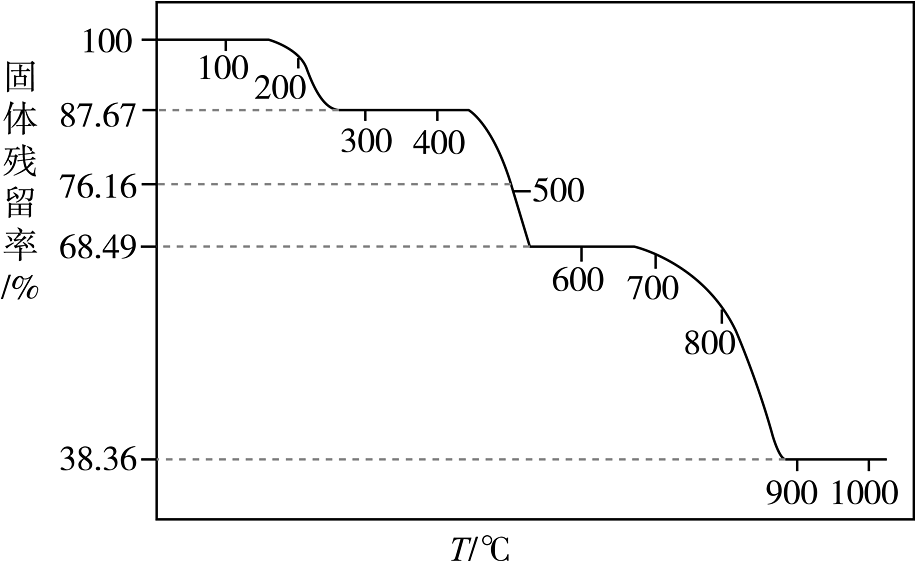
①时化学方程式为。
②时残留固体的成分为。
-
13、化学创造美好生活。磷酸锌是一种绿色环保涂料,实验室用锌灰(含等)为原料制备(难溶于水)的流程如下,回答下列问题:

已知:①。
②本实验条件下高锰酸钾的还原产物为。
(1)、提高浸取率的措施为(答2条),滤渣Ⅰ的主要成分为。(2)、步骤I中,需先将溶液的调至5.0,再滴加溶液时的离子方程式为。(3)、试剂a为。(4)、步骤Ⅲ在加热条件下生成一种温室气体和 , 其化学方程式为。(5)、步骤Ⅳ反应结束后,得到的操作包括和干燥。 -
14、二氧化碳加氢制甲醇涉及的反应可表示为:
反应I:
反应II:
一体积固定的密闭容器中,在5MPa下,按照投料,平衡时,CO和在含碳产物中物质的量分数及的转化率随温度的变化如图所示,下列说法正确的是
 A、n曲线代表的物质为 B、150~250℃时,平衡移动的程度:反应I<反应II C、加入选择性高的催化剂,可提高的平衡转化率 D、270℃,若起始投料CO2物质的量为1mol,则达平衡时物质的量为0.12mol
A、n曲线代表的物质为 B、150~250℃时,平衡移动的程度:反应I<反应II C、加入选择性高的催化剂,可提高的平衡转化率 D、270℃,若起始投料CO2物质的量为1mol,则达平衡时物质的量为0.12mol -
15、常温下,下列溶液中各粒子的物质的量浓度关系正确的是A、溶液中: B、将等物质的量浓度的和溶液混合: C、等物质的量浓度的溶液与溶液等体积混合溶液显碱性,则溶液中: D、将和的稀溶液混合恰好至溶液中
-
16、根据下列图示所得出的结论不正确的是
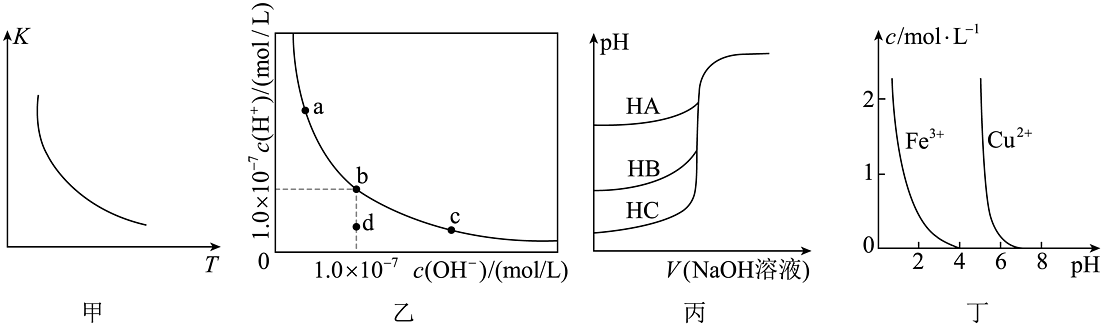 A、图甲是一定条件下的平衡常数K随温度变化的曲线,可推知该反应的 B、图乙是一定温度下水溶液中、的变化曲线。该温度下,加水稀释NaOH溶液可能引起沿曲线由c向b的变化 C、图丙是室温下用0.01mol/L NaOH溶液分别滴定同浓度同体积的HA、HB、HC三种酸的滴定曲线,可推知HA的酸性最强 D、图丁是在溶液中、的浓度与pH的关系曲线。可推知用氢氧化物沉淀除去溶液混有的 , 所调pH的范围大致应为4~5
A、图甲是一定条件下的平衡常数K随温度变化的曲线,可推知该反应的 B、图乙是一定温度下水溶液中、的变化曲线。该温度下,加水稀释NaOH溶液可能引起沿曲线由c向b的变化 C、图丙是室温下用0.01mol/L NaOH溶液分别滴定同浓度同体积的HA、HB、HC三种酸的滴定曲线,可推知HA的酸性最强 D、图丁是在溶液中、的浓度与pH的关系曲线。可推知用氢氧化物沉淀除去溶液混有的 , 所调pH的范围大致应为4~5 -
17、下列说法正确的是A、常温下,向稀醋酸溶液中缓慢通入NH3 , 溶液中的值增大 B、298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0 C、标准状况下,将22.4 L Cl2通入足量NaOH溶液中,反应转移的电子数为2×6.02×1023 D、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
-
18、在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Ca(OH)2Ca(ClO)2(aq)HClO(aq) B、Fe(s)Fe2O3(s)FeCl3(aq) C、S(s)SO2(g)BaSO3(s) D、NH3(g)NO(g)HNO3(aq)
-
19、阅读下列材料,完成有关问题:
族元素及其化合物应用广泛。催化氧化生成继续被氧化为 , 将通入水中可制得;肼常温下为液态,燃烧热为(642kJ•mol-1),产物无污染,常用作火箭燃料:白磷为正四面体结构,常用来制烟雾弹、燃烧弹;雄黄具有解毒、杀虫功效,燃烧后生成砒霜和一种具有刺激性气味的气体;锑是一种银白色金属,其氧化物可用于制造颜料,铅锑合金可用作铅蓄电池的电极材料。
(1)、下列说法正确的是A、分子中既有极性键,又有非极性键 B、相同条件下,在水中的溶解度小于 C、白磷和红磷互为同位素 D、非金属性强于P(2)、下列化学反应表示正确的是A、雄黄燃烧: B、制的离子方程式: C、肼的燃烧: D、铅蓄电池放电时的负极反应:(3)、下列有关物质的性质与用途具有对应关系的是A、氨气易液化,可用于工业制硝酸 B、肼具有碱性,可用作火箭燃料 C、三氧化二锑呈白色,可用于制造颜料 D、铅锑合金熔点低,可用作铅蓄电池电极材料 -
20、同一周期的X、Y、Z三种主族元素,已知其最高价氧化物对应水化物的化学式分别为、、 , 下列说法正确的是A、气态氢化物的稳定性: B、原子半径:X>Y>Z C、最高价氧化物对应水化物酸性: D、元素非金属性强弱关系:X>Y>Z