相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、MnO2催化降解甲醛的机理如图所示,其中MnO2起着吸附活化的作用。下列说法错误的是
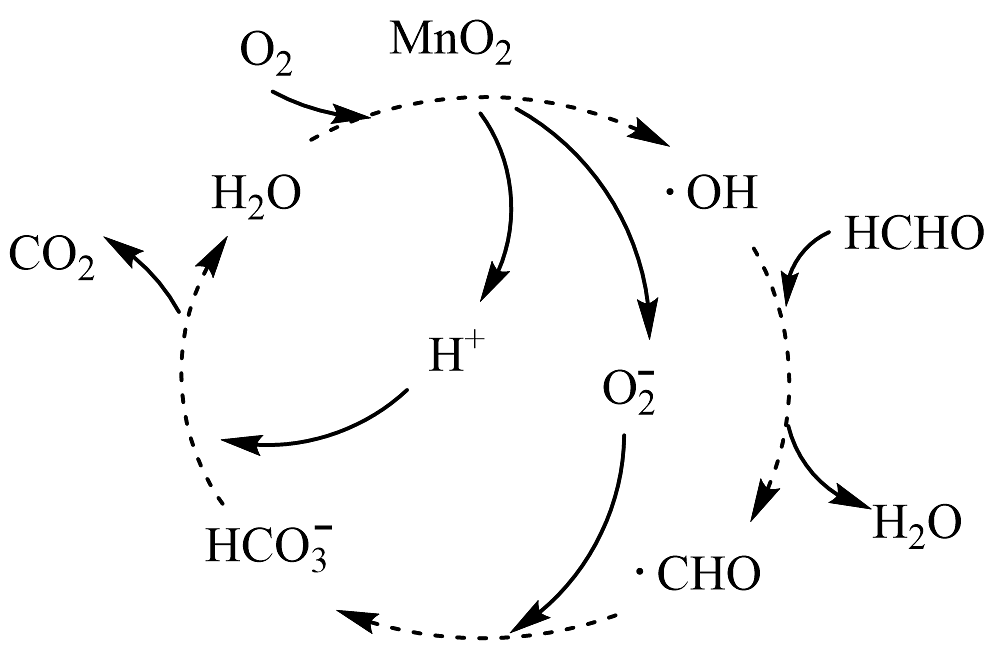 A、基态Mn原子的未成对电子数为5个 B、•CHO中碳原子采取sp2杂化 C、CO2的空间结构为V形 D、HCHO在降解过程中碳氧双键未发生断裂
A、基态Mn原子的未成对电子数为5个 B、•CHO中碳原子采取sp2杂化 C、CO2的空间结构为V形 D、HCHO在降解过程中碳氧双键未发生断裂 -
2、下列离子方程式正确的是A、向CuSO4溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH B、甲醛发生银镜反应:HCHO+4[Ag(NH3)2]OH2NH+CO+4Ag↓+6NH3+2H2O C、向草酸溶液中加入少量酸性高锰酸钾溶液:5H2C2O4+6H++2MnO=10CO2↑+2Mn2++8H2O D、向NaHCO3溶液中加入少量Ba(OH)2溶液:HCO+Ba2++OH-=BaCO3↓+H2O
-
3、下列有关化合物结构和性质的论述正确的是A、无机苯(
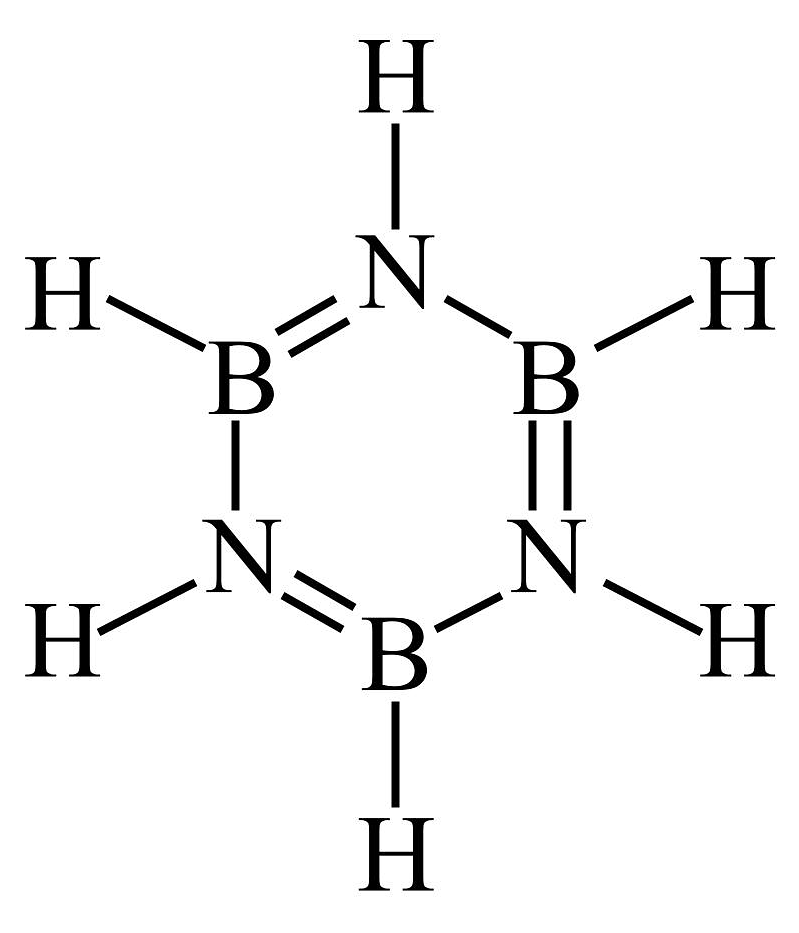 )的结构与苯相似,其中形成大π键的电子全部由N提供
B、根据原子半径推知,F-F键的键能大于Cl-Cl键,F2化学性质更稳定
C、NH3的成键电子对间排斥力比PH3小,所以NH3的键角比PH3小
D、O3是弱极性分子,其在水中的溶解度大于在四氯化碳中的溶解度
)的结构与苯相似,其中形成大π键的电子全部由N提供
B、根据原子半径推知,F-F键的键能大于Cl-Cl键,F2化学性质更稳定
C、NH3的成键电子对间排斥力比PH3小,所以NH3的键角比PH3小
D、O3是弱极性分子,其在水中的溶解度大于在四氯化碳中的溶解度
-
4、下列有关说法正确的是A、合成氨为放热反应,所以在实际生产过程中温度越低越好 B、在恒温恒容条件下,发生2SO2(g)+O2(g)2SO3(g)。当反应达到平衡后,若再充入少量O2 , 再次达到平衡后,SO3的浓度降低 C、在恒温恒压条件下,发生2NO2(g)N2O4(g)。当反应达到平衡后,若再充入少量N2O4 , 再次达到平衡后,体系颜色不变 D、CaCO3(s)+2NH(aq)Ca2+(aq)+2NH3(aq)+CO2(g)+H2O(l) H=+68.9kJ•mol-1、S=+37.3J/(mol•K)该反应可在沸水中自发进行
-
5、下列实验装置,可以达到实验目的的是
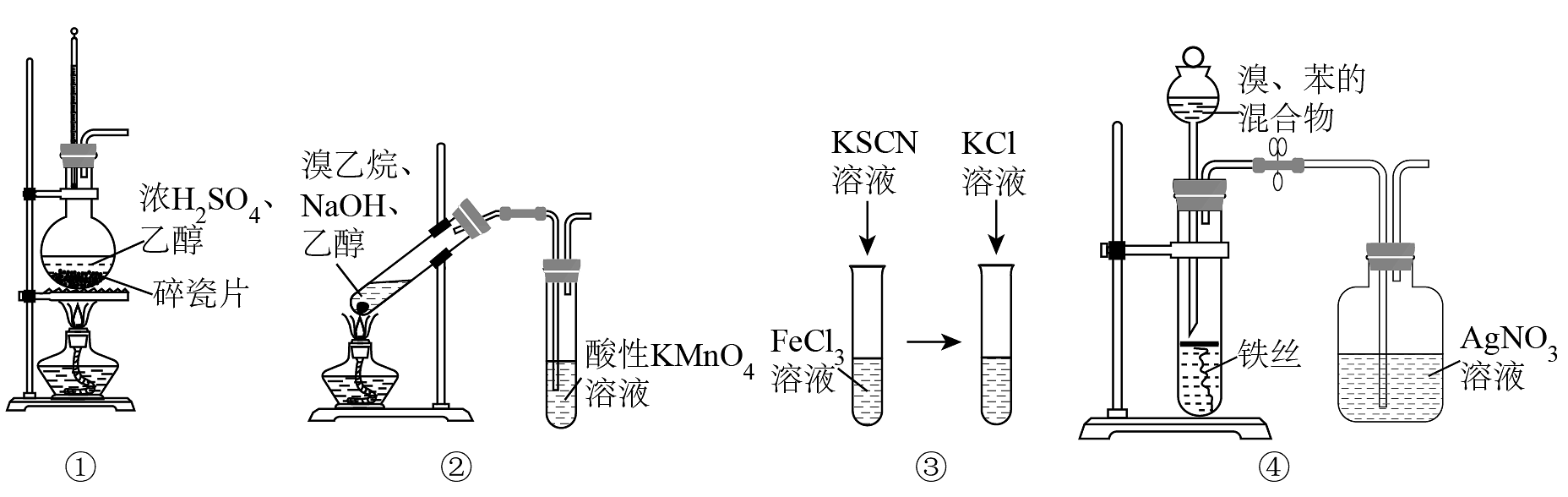 A、用装置①在实验室制备乙烯 B、用装置②证明溴乙烷消去反应有乙烯生成 C、用装置③探究KCl浓度是否对FeCl3+3KSCNFe(SCN)3+3KCl的平衡移动有影响 D、用装置④证明溴和苯发生的是取代反应而不是加成反应
A、用装置①在实验室制备乙烯 B、用装置②证明溴乙烷消去反应有乙烯生成 C、用装置③探究KCl浓度是否对FeCl3+3KSCNFe(SCN)3+3KCl的平衡移动有影响 D、用装置④证明溴和苯发生的是取代反应而不是加成反应 -
6、2021年诺贝尔化学奖授予本杰明·李斯特、大卫·麦克米兰,以表彰他们在“不对称有机催化的发展”中的贡献,用脯氨酸催化合成酮醇反应如图。下列说法错误的是
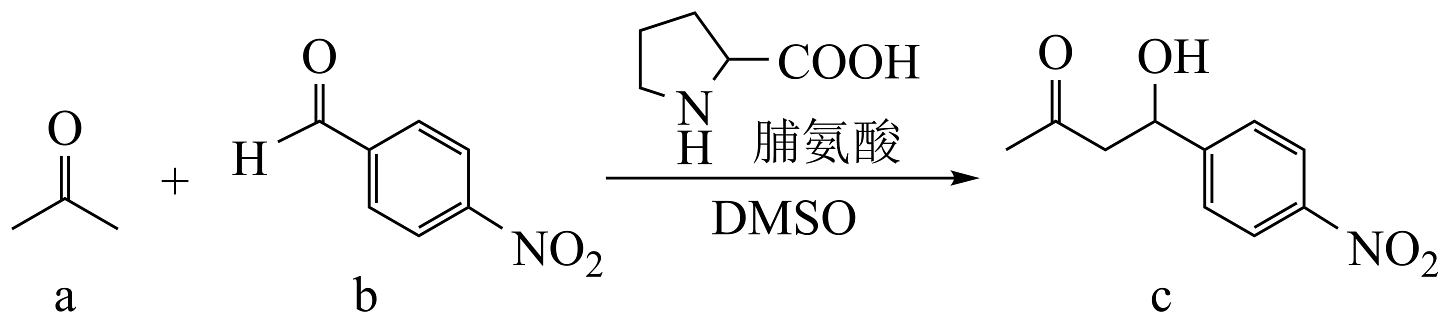 A、C的分子式为C10H11NO4 B、理论上,该反应原子利用率为100% C、脯氨酸与
A、C的分子式为C10H11NO4 B、理论上,该反应原子利用率为100% C、脯氨酸与 互为同分异构体
D、可用酸性高锰酸钾溶液鉴别b和c
互为同分异构体
D、可用酸性高锰酸钾溶液鉴别b和c
-
7、下列离子(或分子)组在相应条件下,一定能大量共存的是A、麦芽糖溶液中:MnO、K+、H+、SO B、能使苯酚溶液显紫色的溶液中:Na+、HCO、SCN-、Cl- C、银氨溶液中:OH-、NO、K+、Cl- D、Na2CO3溶液中:Al3+、SO、H+、Cl-
-
8、下列关于物质的用途的叙述不正确的是A、聚乳酸是一种很好的生物降解塑料,可用作超市购物袋等,以减少白色污染 B、NaCl可用作食品防腐剂 C、复方氯乙烷气雾剂可用于运动中的急性损伤的镇痛 D、在酱油中加入铁强化剂(如FeCl3),以减少缺铁性贫血问题的发生
-
9、设NA为阿伏加德罗常数的值。下列说法正确的是A、1L0.5mol/L的乙醇溶液中含氧原子数为0.5NA B、1molKCl晶体中所含分子数为NA C、0.1mol乙酸与足量甲醇充分反应生成的乙酸甲酯分子数目小于0.1NA D、62gP4(
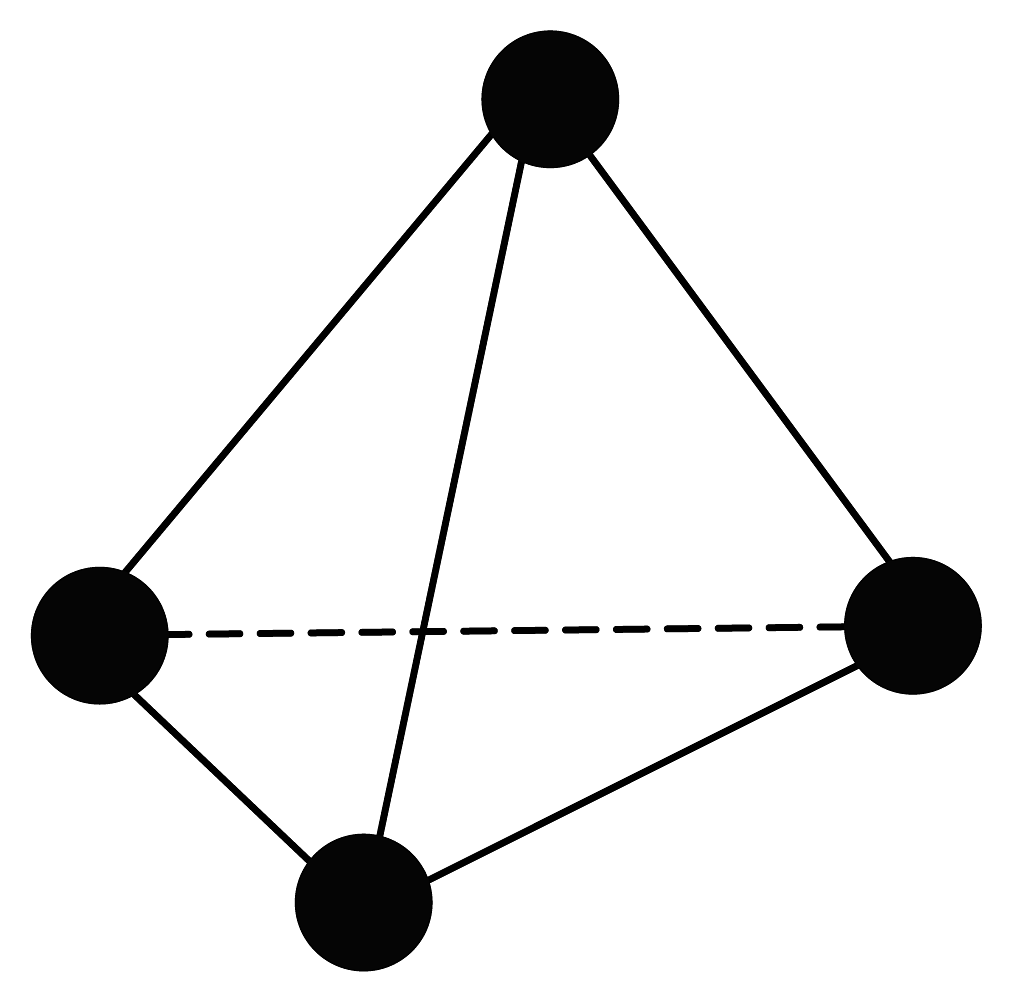 )熔化时,断裂P-P键数目为3NA
)熔化时,断裂P-P键数目为3NA
-
10、下列化学用语的表达错误的是A、乙烯的空间填充模型
 B、CaC2的电子式
B、CaC2的电子式 C、基态N原子的价层电子排布图
C、基态N原子的价层电子排布图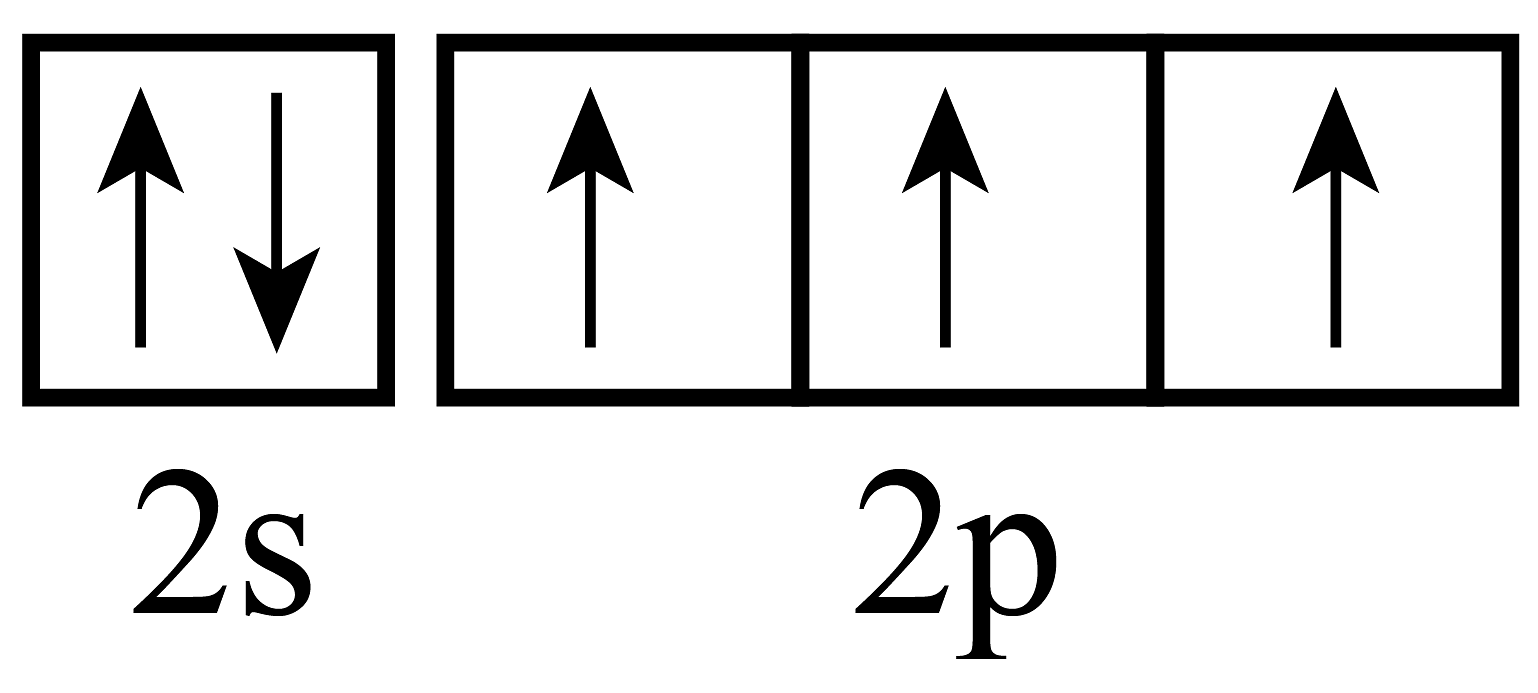 D、的VSEPR模型为平面三角形
D、的VSEPR模型为平面三角形
-
11、-受体阻滞剂F是一种治疗心血管疾病的药物,该化合物的合成路线如下:

回答下列问题:
(1)、A的结构简式是。(2)、B含有的官能团名称是、。(3)、E→F的反应类型是。(4)、C→D的化学反应方程式是。(5)、X是比B少两个碳原子的同系物,X的同分异构体能同时满足以下条件的有种(不考虑立体异构体)。i.遇溶液显紫色;ii.能发生水解反应;iii.苯环上仅有两个取代基。
其中,核磁共振氢谱显示五组峰(峰面积比为)的同分异构体的结构简式为。
(6)、参照上述合成路线,以 为原料,设计合成
为原料,设计合成 的路线(无机试剂任选)。
的路线(无机试剂任选)。 -
12、甘油制备高附加值有机胺的方法,可有效解决生物柴油产业中副产品甘油过剩。
回答下列问题:
(1)、一定温度下,可用甘油催化转化制备1,2-丙二胺。已知:i.

ii.

iii.

①反应ii的焓变。
②对于反应 , 下列说法正确的是。
A.恒温恒容时,充入氩气增大了甘油的转化率
B.当时,该反应达到平衡状态
C.当
 时,该反应达到平衡状态
时,该反应达到平衡状态D.恒温恒容时,当混合气体的平均相对分子质量不变,该反应达到平衡状态
(2)、研究甘油转化制备1,2-丙二胺反应机理时发现,该反应有两个途径(如图),分别生成两种中间产物 和
和 , TS为对应的中间状态。
, TS为对应的中间状态。
①从能量变化来看,反应速率较快的是(填“”或“”),原因是。
②下列有关说法正确的是(填正确答案标号)。
A.升高温度,生成
 和
和 的反应速率均增大
的反应速率均增大B.
 比
比 稳定
稳定C.降低压强,可以提高
 产率
产率D.选择合适的催化剂,可以增大生成
 的选择性(3)、一定温度下,甘油还可以催化转化制备乙二胺,其总反应为:。在某1L刚性密闭容器中充入、 , 达到平衡状态后,与体积分数相等。
的选择性(3)、一定温度下,甘油还可以催化转化制备乙二胺,其总反应为:。在某1L刚性密闭容器中充入、 , 达到平衡状态后,与体积分数相等。①的转化率为。
②该温度下此反应的平衡常数。
-
13、铜阳极泥(含有、、、等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:

已知:
① ;
②易从溶液中结晶析出;
③不同温度下的溶解度如下:
温度/℃
0
20
40
60
80
溶解度/g
14.4
26.1
37.4
33.2
29.0
回答下列问题:
(1)、为提高“氧化酸浸”的效率,可采取的措施有(任写二种)。(2)、“滤液1”中含有和 , “滤渣1”含有Au及、(填化学式)。(3)、“除金”时反应的离子方程式为。(4)、“氧化酸浸”和“除金”工序均需控制加入的NaCl不过量,原因是。(5)、“银还原”工序消耗的与产生的的物质的量之比为。(6)、为实现连续生产,“银转化”和“银还原”工序一般需控制温度在℃左右进行。(7)、硫代硫酸盐是一类具有应用前景的浸金试剂。“除金”时,硫代硫酸根也可作为配体提供孤电子对与形成 , 可看作是中的一个原子被S原子取代的产物。①硫代硫酸根的空间构型为:。
②分别判断中的中心S原子和端基S原子能否做配位原子并说明理由:。
-
14、硫酸亚铁铵晶体又称摩尔盐,是一种重要的化工原料,可用作净水剂、治疗缺铁性贫血的药物等。实验室利用废铁屑(主要成分为Fe,还有少量FeS和油污)合成硫酸亚铁铵晶体的步骤如下:
I.废铁屑的净化
将废铁屑放入锥形瓶中,加入溶液,加热煮沸一段时间。用倾析法除去碱液,再用蒸馏水洗净铁屑。
Ⅱ.的制备

往盛有洗净铁屑的锥形瓶中加入足量溶液,烧杯中加入过量溶液。加热使铁屑与反应至不再冒气泡(实验均在通风处进行)。趁热过滤,将滤液转入蒸发皿中。
Ⅲ.硫酸亚铁铵晶体的制备
向滤液中迅速加入一定体积的饱和溶液,调节溶液的为。经蒸发皿加热至出现晶膜时停止加热,冷却结晶,减压过滤、洗涤、干燥得到产品。
Ⅳ.产品纯度测定
溶液配制:称取产品,用蒸馏水溶解后配制成溶液。
滴定分析:量取硫酸亚铁铵溶液于锥形瓶中,加稀酸化,用标准溶液滴定至终点,重复三次,平均消耗标准溶液。已知:
①硫酸亚铁铵在空气中不易被氧化,溶于水,不溶于乙醇。
②的相对分子质量为392。
回答下列问题:
(1)、步骤Ⅰ中加入溶液的目的是。(2)、下列情况适合倾析法的有。A.沉淀呈絮状 B.沉淀的颗粒较大 C.沉淀容易沉降
(3)、步骤Ⅱ中过滤使用到的玻璃仪器有 , 烧杯中发生的化学反应方程式为。(4)、步骤Ⅲ中制得的晶体需要用(填字母代号)洗涤,目的是。A.蒸馏水 B.饱和食盐水 C.无水乙醇
(5)、步骤Ⅳ中:①“滴定分析”步骤中,下列操作错误的是。
A.用量筒量取硫酸亚铁铵溶液
B.溶液置于酸式滴定管中
C.锥形瓶内溶液变色后,立即记录滴定管液面刻度
②该产品中硫酸亚铁铵的纯度为(用含m、V的代数式表示)。
-
15、甘氨酸是人体必需氨基酸之一,在晶体和水溶液中主要以偶极离子()的形式存在。其在水溶液中存在如下平衡:。当调节溶液的使甘氨酸所带正负电荷正好相等时,甘氨酸所带的净电荷为零,此时溶液的即为甘氨酸的等电点,已知甘氨酸的等电点为5.97。在25℃时,向一定浓度的甘氨酸盐酸盐溶液中滴加溶液,、和的分布分数[如]与溶液关系如图。下列说法错误的是
 A、 B、点, C、等电点时,微粒间的数量关系是: D、的平衡常数
A、 B、点, C、等电点时,微粒间的数量关系是: D、的平衡常数 -
16、是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某(II)催化剂(用表示)能高效电催化氧化合成 , 其反应机理如图所示。下列说法正确的是
 A、M中Ru的化合价为+3 B、该过程没有非极性键的形成 C、该过程的总反应式: D、被氧化至后,配体失去质子能力减弱
A、M中Ru的化合价为+3 B、该过程没有非极性键的形成 C、该过程的总反应式: D、被氧化至后,配体失去质子能力减弱 -
17、R、X、Y、Z为短周期元素,的分子结构如图所示。中电子只有一种自旋取向;X、Y、Z处于同一周期;X的核外电子数等于Y的最高能级电子数,且等于Z的最外层电子数。下列说法错误的是
 A、单质沸点:X>Z B、简单离子半径:Z>Y C、该化合物中Z提供电子对与X形成配位键 D、R、Z、Y三种元素形成的化合物中只含有共价键
A、单质沸点:X>Z B、简单离子半径:Z>Y C、该化合物中Z提供电子对与X形成配位键 D、R、Z、Y三种元素形成的化合物中只含有共价键 -
18、一种双腔室燃料电池构造示意图如下,下列说法错误的是
 A、离子交换膜的作用是传导 B、负极反应式为: C、在电池反应中表现出氧化性和还原性 D、复合材料电极上每消耗 , 外电路中转移电子
A、离子交换膜的作用是传导 B、负极反应式为: C、在电池反应中表现出氧化性和还原性 D、复合材料电极上每消耗 , 外电路中转移电子 -
19、下列实验操作及现象所推出的结论正确的是
选项
实验操作及现象
实验结论
A
在碘水中加入环己烷,振荡、静置,下层溶液颜色变浅
碘与环己烷发生了取代反应
B
将乙醇与浓硫酸混合液加热至170℃,并将产生的气体通入酸性高锰酸钾溶液中,溶液褪色
气体成分为乙烯
C
用酒精灯灼烧织物产生类似烧焦羽毛的气味
该织物含蛋白质
D
将滴入饱和溶液中,产生使澄清石灰水变浑浊的气体
非金属性:
A、A B、B C、C D、D -
20、海水中的化学资源具有巨大的开发潜力。利用海水提取溴和镁的过程如下:

下列说法正确的是
A、通入热空气可提高吹出塔的效率 B、可用的水溶液代替的水溶液 C、电解溶液也可制备 D、可以与溶液反应生成沉淀