相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、下列实验操作、现象及结论均正确的是
选项
实验操作
现象
结论
A
用试纸分别测定溶液和溶液的pH
溶液的大
水解常数:大于
B
常温下,将滴有几滴酚酞试液的饱和碳酸钠溶液加热到50℃
溶液颜色加深,并产生大量气泡
的水解平衡正向移动
C
向两支试管中分别加入等体积的溶液,在试管中加入滴溶液
b试管溶液变黄后,产生气泡的速率明显加快
是分解的催化剂
D
向锌粒和稀硫酸反应的试管中,滴加几滴溶液
产生气泡的速率明显加快
锌粒与置换出的铜形成了铜锌原电池
A、A B、B C、C D、D -
2、钠离子电池是有望代替锂离子电池的一类二次电池,其工作原理与锂离子电池相似,以硬碳代替锂离子电池的石墨作负极材料,钠离子在正负极之间的嵌入和脱出实现电荷转移,放电时的工作原理如图所示。下列说法错误的是
 A、放电时,电子流向为铝箔负载铝箔 B、放电时,离子导体中的物质的量逐渐增大 C、充电时,铝箔发生的反应式为 D、充电时,导线中通过电子,理论上阴极质量增加
A、放电时,电子流向为铝箔负载铝箔 B、放电时,离子导体中的物质的量逐渐增大 C、充电时,铝箔发生的反应式为 D、充电时,导线中通过电子,理论上阴极质量增加 -
3、一氯胺的制备原理是。已知:键能是指气态分子中化学键解离成气态原子所吸收的能量,几种化学键的键能如下表所示。
化学键
键能
391
243
431
下列叙述错误的是
A、 B、该正反应的活化能小于逆反应的活化能 C、保持起始投料和温度相同,恒容和恒压条件下的平衡转化率相等 D、保持温度相同,按或起始投料,平衡时的体积百分含量相等 -
4、已知元素均是短周期主族元素,下表中由条件得出的结论一定正确的是
选项
条件
结论
A
若原子半径:
离子半径:
B
若第一电离能:
金属活动性顺序:X>Y
C
若共价化合物中显正价
元素的电负性:
D
若元素原子的最外层电子数:X>Y
元素的电负性:
A、A B、B C、C D、D -
5、下列实验操作规范或实验设计能达到实验目的的是


A.测定溶液的pH
B.用氢氧化钠溶液滴定醋酸溶液


C. , 颜色加深说明平衡逆移
D.测定锌和一定浓度稀硫酸的反应速率
A、A B、B C、C D、D -
6、向碳素钢中加入不同的合金元素,可制得不同性能的合金钢,常见的合金元素有Mn、Cr、Ni等。下列叙述错误的是A、Cr、Mn、Ni均属于d区元素 B、的第二电离能大于第一电离能 C、基态离子中有6个未成对电子 D、基态原子的简化电子排布式:
-
7、已知:;;。下列叙述正确的是A、的燃烧热为 B、 C、由S(s,正交硫)=S(s,单斜硫)判断,单斜硫比正交硫稳定 D、
-
8、下列说法正确的是A、属于弱电解质 B、常温下,溶液和溶液均显中性,水的电离程度相同 C、常温下,的溶液中,可能大量共存 D、常温下,溶液中水电离出 , 则溶液的可能等于3或11
-
9、工业上有一种“降碳”方法是用生产燃料甲醇,其反应原理为:。一定条件下,对达到平衡状态的该反应,下列叙述正确的是A、恒温恒容条件下,移出以提高反应速率 B、恒温恒容条件下,增加浓度以提高平衡转化率 C、升高温度或使用催化剂,均可以增大反应物活化分子百分数 D、恒温恒容条件下,使用高效催化剂以提高平衡时的体积分数
-
10、化学与生活密切相关。下列叙述错误的是A、可用于除去污水中的 B、用与两种溶液制作泡沫灭火剂 C、“保暖贴”工作过程中,主要利用了原电池的工作原理 D、饮用汽水后常常出现“打嗝”现象,可以用平衡移动原理解释
-
11、“珍贵文物蕴含着璀璨文化和深远历史,记录着人类文明和社会进步。”下列文物在潮湿空气中易发生电化学腐蚀的是


A.王趯墓志
B.T型帛画


C.“长沙丞相”铜印
D.清寿山石造像
A、A B、B C、C D、D -
12、某研究小组按下列路线合成治疗细菌感染的药物氧氟沙星:

已知:

回答下列问题:
(1)、化合物C中含氧官能团名称是。(2)、化合物B的结构简式是。(3)、下列说法错误的是_______。A、有机物A能与溴水在FeBr3作用下发生取代反应 B、有机物E与乙酸乙酯属于同系物 C、有机物E→F的转化涉及加成、消去两步反应 D、氧氟沙星的分子式是C18H20FN3O4(4)、写出D与F生成G的化学方程式。(5)、以2—氨基乙醇( )与甲醛(HCHO)为原料,且利用以上合成路线中的相关信息,设计
)与甲醛(HCHO)为原料,且利用以上合成路线中的相关信息,设计 的合成路线(用流程图表示,无机试剂选)。 (6)、写出同时符合下列条件的化合物C的同分异构体的结构简式。
的合成路线(用流程图表示,无机试剂选)。 (6)、写出同时符合下列条件的化合物C的同分异构体的结构简式。①分子中含有苯环结构,并能发生银镜反应;
②1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,有
 , 没有−O−O−。
, 没有−O−O−。 -
13、甲醇是重要的化工原料之一,也可用作燃料,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下:
反应ⅰ:CO(g)+2H2(g)CH3OH(g) ΔH1
反应ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=−49.9kJ·mol—1
反应ⅲ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH3=+41.6kJ·mol—1
回答下列问题:
(1)、在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
①反应ⅰ在(填“较低”或“较高”)温度下才能自发进行。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式:。
③m=(计算结果保留两位有效数字,已知1eV=1.6×10—22kJ)。
(2)、将一定量的CO2(g)和H2(g)充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ.相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH的选择性[×100%]和CO的选择性×100%随压强的变化曲线如图所示。
图中表示CO2的平衡转化率的曲线是(填“m”“n”或“p”),简述判断方法:。
(3)、有研究认为,在某催化剂作用下反应ⅱ先后通过反应ⅲ、ⅰ来实现。保持温度T不变,向一恒容密闭容器中充入4molCO2和8molH2 , 在该催化剂作用下发生反应,经5min达到平衡,测得H2O(g)的物质的量为3mol,起始及达平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用H2分压表示的平均反应速率为kPa·min—1(用含a的式子表示,下同,分压=总压×物质的量分数);反应ⅱ的压强平衡常数Kp=(kpa)—2(Kp为用分压代替浓度计算的平衡常数)。(4)、光催化CO2制甲醇技术也是研究热点。铜基纳米光催化材料还原CO2的机理如图所示,光照时,低能价带失去电子并产生空穴(h+ , 具有强氧化性)。在低能价带上,H2O直接转化为O2的电极反应式为。
-
14、
实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
I.FeCl3·6H2O制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后的废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)步骤①的主要目的是。
(2)步骤②控制温度在40~50℃的原因是。
II.无水FeCl3制备
已知SOCl2熔点-156℃,沸点77℃,易水解。
(3)按图装置进行实验。锥形瓶中生成无水FeCl3的总化学方程式为;仪器A的作用是。

III.产品纯度测定
(4)称取3.500g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用0.2000mol·L-1Na2S2O3溶液滴定(I+2S2O=3I—+S4O),经三次平行实验,消耗Na2S2O3溶液体积分别为19.50mL,20.02mL,19.98mL。
①所制产品的纯度为%(以无水FeCl3质量分数表示,保留三位有效数字)。
②所制产品中可能含有FeCl2杂质,检验FeCl2的试剂为(填化学式)溶液;产生FeCl2的原因可能是。
-
15、以锌灰(含及少量(PbO、CuO、Fe2O3、SiO2)和为原料可以制备脱硫剂 , 该脱硫剂的制备硫化、再生过程可表示为:

请回答下列问题:
(1)、“浸取”时需不断通入高温水蒸气,其目的是。(2)、“除杂”包括加适量锌粉、过滤、加氧化等步骤,除和外,与锌粉反应的离子还有(填离子符号)。(3)、“沉锌铁”时反应体系温度不能过高,可能的原因是。(4)、时,将一定比例、CO、CO2和H2S的混合气体以一定流速通过装有脱硫剂的硫化反应器,已知硫化过程中,与H2、H2S反应生成和 , 其化学方程式为。(5)、将硫化后的固体在的混合气体中加热再生,固体质量随温度变化的曲线如图所示,在范围内,固体质量增加的主要原因可能是。 (6)、能形成多种配离子,已知形成的一种配离子只有一种空间结构,则的空间结构为。
(6)、能形成多种配离子,已知形成的一种配离子只有一种空间结构,则的空间结构为。 -
16、难溶盐可溶于盐酸,常温下,用盐酸调节浊液的 , 测得体系中或与的关系如图。下列说法不正确的是
 A、N代表与的变化曲线 B、Y点的溶液中存在 C、常温下, D、Z点的溶液中存在
A、N代表与的变化曲线 B、Y点的溶液中存在 C、常温下, D、Z点的溶液中存在 -
17、工业上以软锰矿(主要成分为MnO2)为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如下。下列说法错误的是
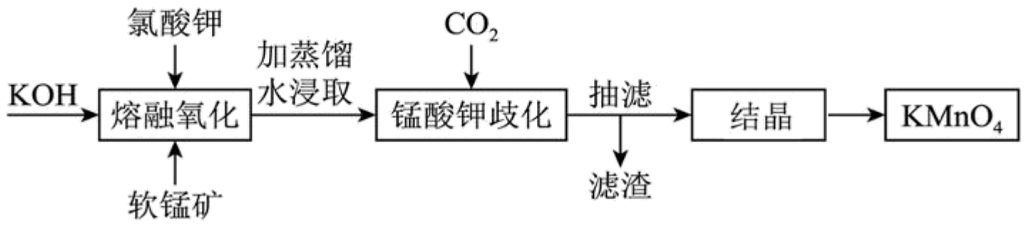 A、“熔融氧化”应在铁坩埚中进行,陶瓷坩埚或Al2O3坩埚均不行 B、“锰酸钾歧化”可以用H2SO4但不能用盐酸代替CO2 C、“结晶”操作与从NaCl溶液得NaCl晶体操作相同 D、该流程中可循环使用的物质是MnO2
A、“熔融氧化”应在铁坩埚中进行,陶瓷坩埚或Al2O3坩埚均不行 B、“锰酸钾歧化”可以用H2SO4但不能用盐酸代替CO2 C、“结晶”操作与从NaCl溶液得NaCl晶体操作相同 D、该流程中可循环使用的物质是MnO2 -
18、丙烯与氢卤酸的加成反应过程主要分两步完成,如图:

其中,反应速率主要由第一步烯烃与H+结合生成碳正离子决定。下列说法错误的是
A、反应物丙烯不存在顺反异构 B、上述条件下,丙烯生成中间产物a的反应活化能较低 C、若使用CF3CH=CH2进行上述反应,则主要产物可能为CF3CH2CH2Cl D、上述反应,在适当条件下氢卤酸中卤素离子浓度越大反应速率越快 -
19、电动汽车电池一直是研究热点,高能量密度的全固态电池有望在2027年投入应用,2030年左右实现大规模商用。现有某可充放电的全固态钠电池,工作原理如图所示,下列说法正确的是
 A、为了降低成本,可以将固态聚合物电解质换为Na3PO4溶液 B、放电时,电极电势N极高于M极 C、充电时,M极电极反应式为:Na3V2(PO4)3-2e—=NaV2(PO4)3+2Na+ D、充电时,Na+由N极迁移至M极
A、为了降低成本,可以将固态聚合物电解质换为Na3PO4溶液 B、放电时,电极电势N极高于M极 C、充电时,M极电极反应式为:Na3V2(PO4)3-2e—=NaV2(PO4)3+2Na+ D、充电时,Na+由N极迁移至M极 -
20、环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包含某些分子形成超分子。图1、2、3分别表环六糊精结构、超分子示意图及相关应用。下列说法正确的是
 A、环六糊精属于多糖 B、邻氯苯甲醚、对氯苯甲醚均易被环六糊精包合形成超分子 C、通过图2、图3可知对氯苯甲醚与环六糊精形成的超分子甲氧基、氯原子均暴露在反应环境中 D、由题目信息可知,分离环六糊精和氯代苯甲醚通常采用蒸馏法
A、环六糊精属于多糖 B、邻氯苯甲醚、对氯苯甲醚均易被环六糊精包合形成超分子 C、通过图2、图3可知对氯苯甲醚与环六糊精形成的超分子甲氧基、氯原子均暴露在反应环境中 D、由题目信息可知,分离环六糊精和氯代苯甲醚通常采用蒸馏法