相关试卷
- 广东省惠州市2016-2017学年高一上学期化学期末考试试卷
- 山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
- 河南省焦作市2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
- 山东省德州市陵城一中2016-2017学年高一上学期化学期中考试试卷
- 山东省淄博六中2016-2017学年高二上学期化学期中考试试卷
- 山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高一下学期期中化学试卷
- 2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
- 2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
-
1、下列有关说法正确的是A、Na2O和Na2O2固体中阳离子和阴离子个数比都是 B、CO2和SiO2的化学键类型和晶体类型相同 C、和NH3都可以作为配合物的配体 D、Al和N的原子轨道都有3个单电子
-
2、阴离子和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是
 A、的空间构型为正四面体 B、二脲基分子中N-H的H和离子的O形成氢键 C、所含元素原子的杂化轨道类型均相同 D、所含元素基态原子的第一电离能最大的是N
A、的空间构型为正四面体 B、二脲基分子中N-H的H和离子的O形成氢键 C、所含元素原子的杂化轨道类型均相同 D、所含元素基态原子的第一电离能最大的是N -
3、中国科学院研究员研究双层电容器中储能行为时,运用到某种离子化合物结构如图所示。其中X、Y、Z、M、L、Q均为短周期主族元素,且原子序数依次增大。M、Q同族且两种元素组成的某种阴离子在强酸性溶液环境下可以产生淡黄色沉淀;Y是有机物的基本骨架元素。下列结论正确的是
 A、Y的氢化物沸点一定高于Z的氢化物 B、Z的含氧酸不一定属于强酸 C、简单离子半径大小的顺序为: Q>X>M>L D、L的铵盐溶液能存放在玻璃试剂瓶中
A、Y的氢化物沸点一定高于Z的氢化物 B、Z的含氧酸不一定属于强酸 C、简单离子半径大小的顺序为: Q>X>M>L D、L的铵盐溶液能存放在玻璃试剂瓶中 -
4、湖北名菜“洪山菜薹”含有丰富的花青素,具有良好的抗氧化活性。其中矢车菊色素的结构如图所示。下列有关该物质的说法正确的是
 A、化学式为 B、与苯酚互为同系物 C、能与发生显色反应 D、能发生氧化反应、取代反应和消去反应
A、化学式为 B、与苯酚互为同系物 C、能与发生显色反应 D、能发生氧化反应、取代反应和消去反应 -
5、化学在生产生活中有着广泛的应用,下列两项内容说法正确且存在因果关系的是( )
物质性质
实际应用
A
硅为半导体材料
SiO2用于光纤通讯
B
Cl2具有氧化性
氯水可以漂白有色布条
C
Al表面易形成致密的氧化物薄膜
可以用铝槽车运送热的浓硫酸
D
乙醇可以使蛋白质变性
乙醇用于制作医用酒精
A、A B、B C、C D、D -
6、“空气变面包,氨功不可没”。下列说法错误的是A、液氨可用作制冷剂 B、是平面三角形的极性分子 C、可以还原CuO D、合成氨是人工固氮最重要途径
-
7、化学与生活、生产密切相关,下列说法正确的是A、为增强“84”消毒液的消杀新冠肺炎病毒效果,可加入浓盐酸 B、从石墨中剥离出的石墨烯薄片能导电,因此是电解质 C、油脂、糖类以及蛋白质在人体内均能发生水解反应 D、嫦娥五号返回器带回的月壤中含有 , 它与地球上的属于同位素
-
8、氯喹是合成一种抑制病毒药物的中间体,其合成路线如下图:
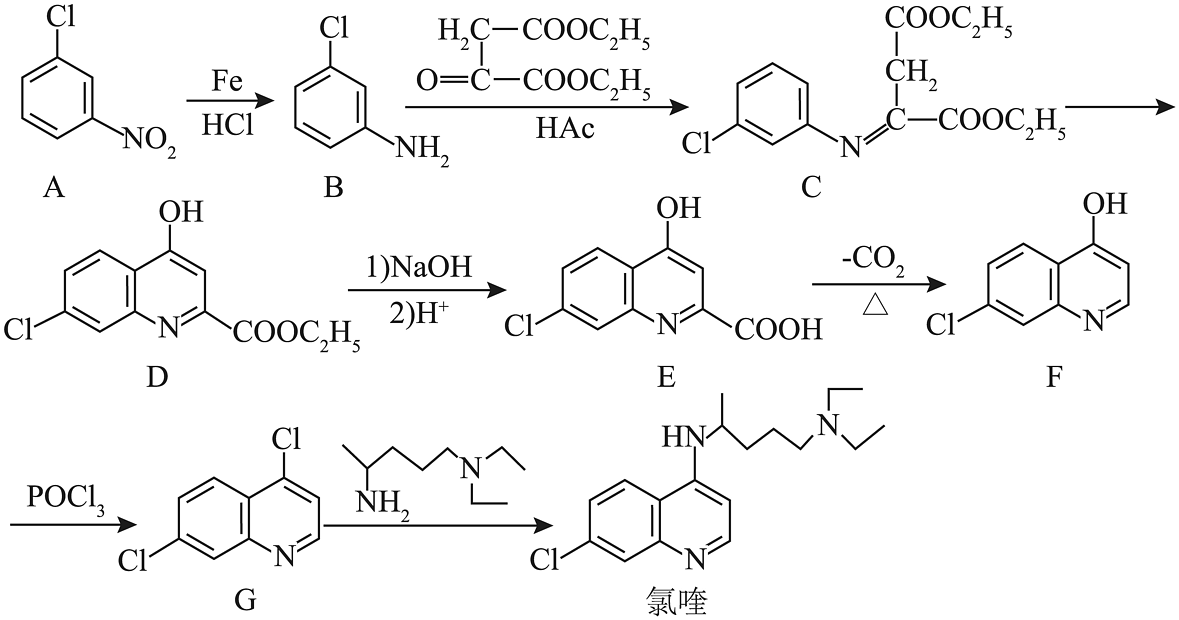 (1)、D分子中含氧官能团的名称是。(2)、的反应需经历两步,其反应类型依次为、。(3)、CD反应过程中有副产物X(与D互为同分异构体)生成,X的结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、D分子中含氧官能团的名称是。(2)、的反应需经历两步,其反应类型依次为、。(3)、CD反应过程中有副产物X(与D互为同分异构体)生成,X的结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①酸性条件下水解得两种均能发生银镜反应的有机产物,其中一种与溶液发生显色反应;②分子中有氰基(-CN);③分子中有4种不同化学环境的氢;④分子中有一个手性碳原子。
(5)、写出以1,3-丁二烯( )和
)和 为原料制备
为原料制备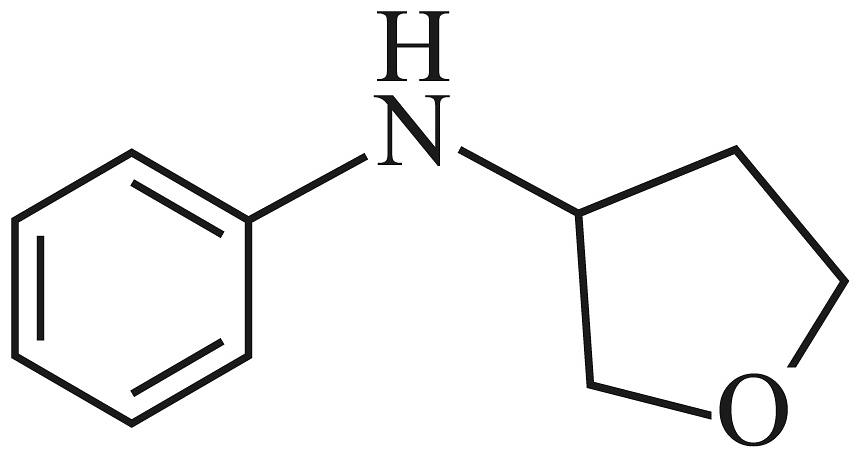 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
9、溴苯主要用于溶剂、分析试剂和有机合成等。合成溴苯所用原料苯、溴及溴苯的部分物理性质数据及实验装置如下所示。
苯
溴
溴苯
密度/g·cm-3
0.88
3.10
1.50
沸点/℃
80
59
156
水中溶解度
微溶
微溶
微溶
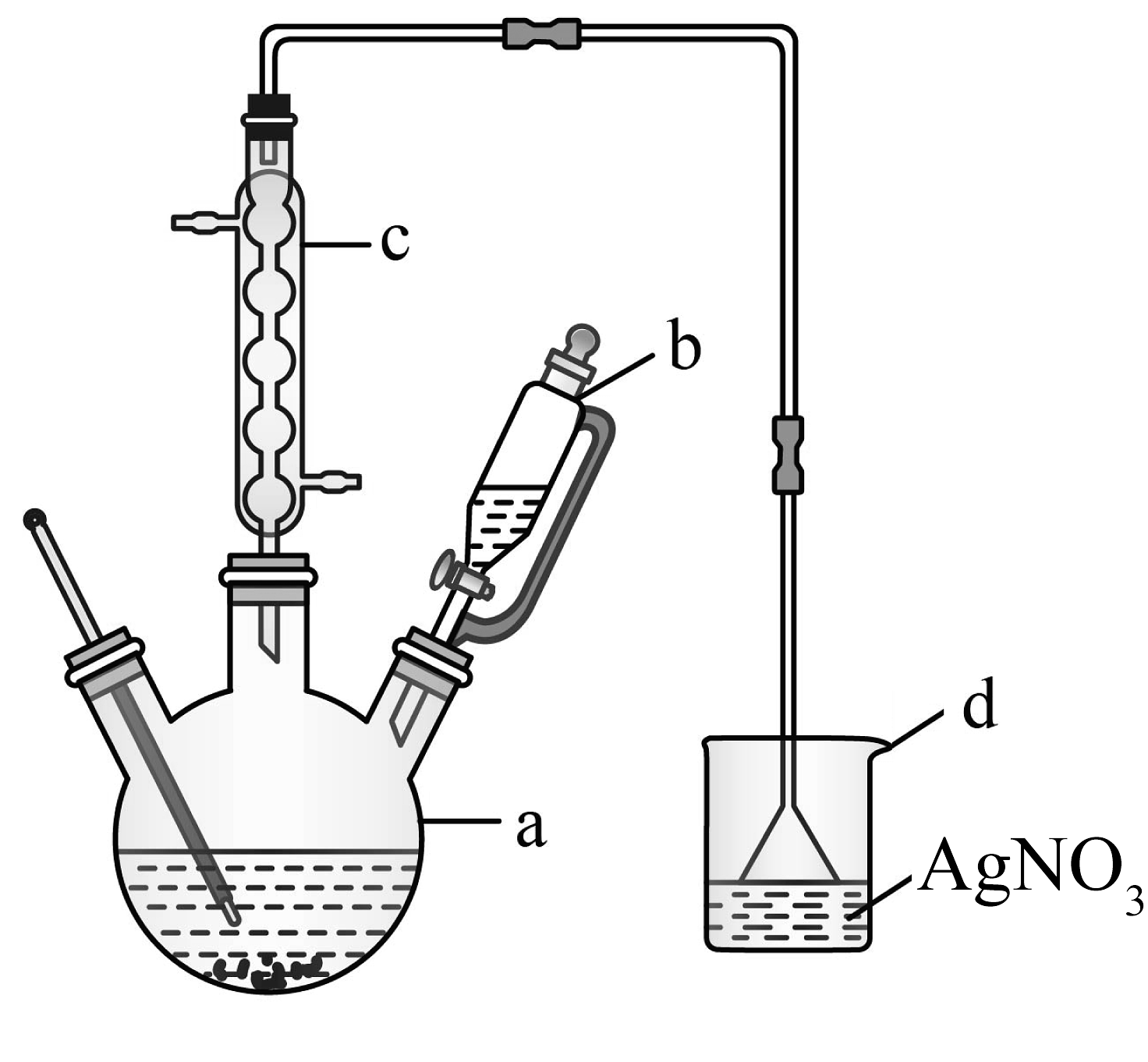 (1)、装置a名称是。(2)、在a中加入少量铁屑和苯,将b中液溴缓慢加入a,发生反应的化学方程式为 , 能说明该反应所属类型的实验现象是。装置c的作用是 , 水流方向是(填“下进上出”或“上进下出”)。(3)、若反应温度过高会生成二溴代苯,写出其中一种主要产物的结构简式。(4)、待反应结束后,从a中混合液分离、提纯产物。
(1)、装置a名称是。(2)、在a中加入少量铁屑和苯,将b中液溴缓慢加入a,发生反应的化学方程式为 , 能说明该反应所属类型的实验现象是。装置c的作用是 , 水流方向是(填“下进上出”或“上进下出”)。(3)、若反应温度过高会生成二溴代苯,写出其中一种主要产物的结构简式。(4)、待反应结束后,从a中混合液分离、提纯产物。①向a中加入水,过滤除去未反应的铁屑。
②补充完整由滤液提取溴苯的实验方案。(实验中可选用的设备和试剂:蒸馏水、10%的NaOH溶液、无水氯化钙、通风橱)
-
10、有机化合物是一种可用于小面积轻度创面镇痛的医用常见麻醉剂,对有机物A进行质谱分析、红外光谱分析,结果如图所示。
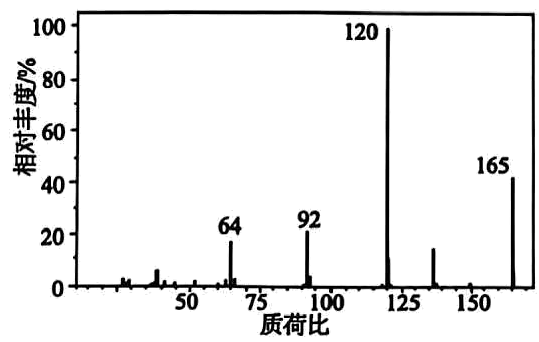
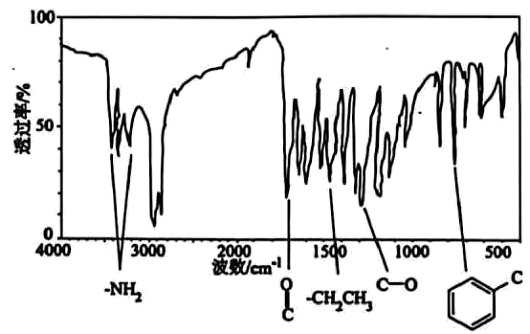 (1)、有机物完全燃烧生成二氧化碳、水和氮气,求该有机物的分子式(写出计算过程)。(2)、有机物A的核磁共振氢谱有5个峰且面积之比为3:2:2:2:2:2,该有机物的结构简式为。(3)、有机物A与氢氧化钠溶液反应的化学方程式为。(4)、有机物的一种芳香族同分异构体具有三种不同化学环境的氢,写出两种满足条件的同分异构体结构简式。
(1)、有机物完全燃烧生成二氧化碳、水和氮气,求该有机物的分子式(写出计算过程)。(2)、有机物A的核磁共振氢谱有5个峰且面积之比为3:2:2:2:2:2,该有机物的结构简式为。(3)、有机物A与氢氧化钠溶液反应的化学方程式为。(4)、有机物的一种芳香族同分异构体具有三种不同化学环境的氢,写出两种满足条件的同分异构体结构简式。 -
11、按要求回答下列问题:(1)、用系统命名法命名:
①
 :。②
:。②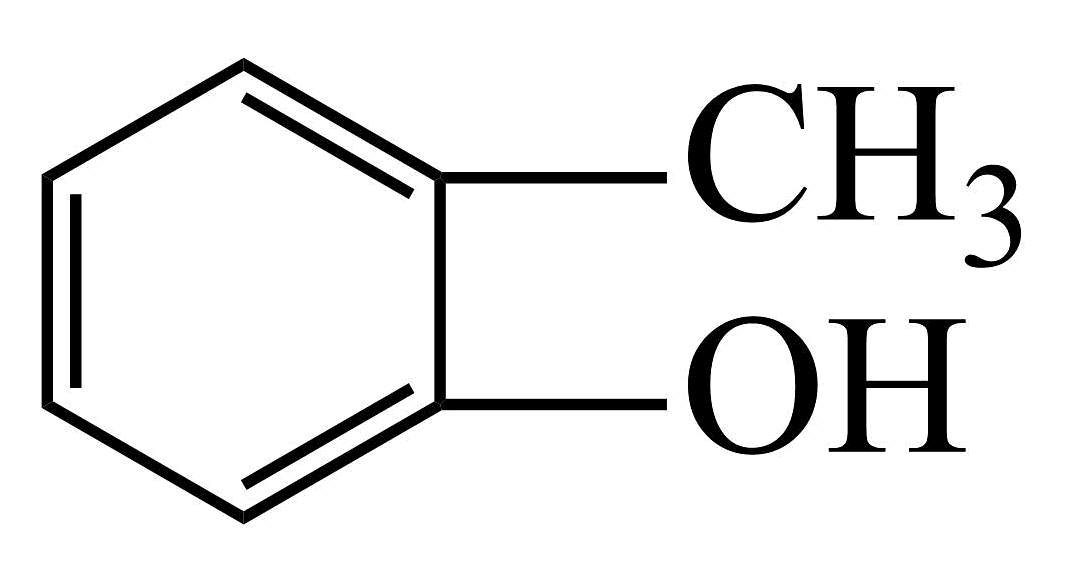 :。(2)、分子式为的芳香烃,苯环上的二氯代物有3种,其结构简式是。(3)、完成下列反应的化学方程式。
:。(2)、分子式为的芳香烃,苯环上的二氯代物有3种,其结构简式是。(3)、完成下列反应的化学方程式。①1,3-丁二烯与氯气发生1,4-加成:。
②甲苯与浓硫酸、浓硝酸的混合酸在100℃共热制得TNT:。
③向苯酚钠溶液中通入少量:。
④对苯二甲酸与乙二醇合成高分子化合物聚对苯二甲酸乙二酯:。
(4)、已知: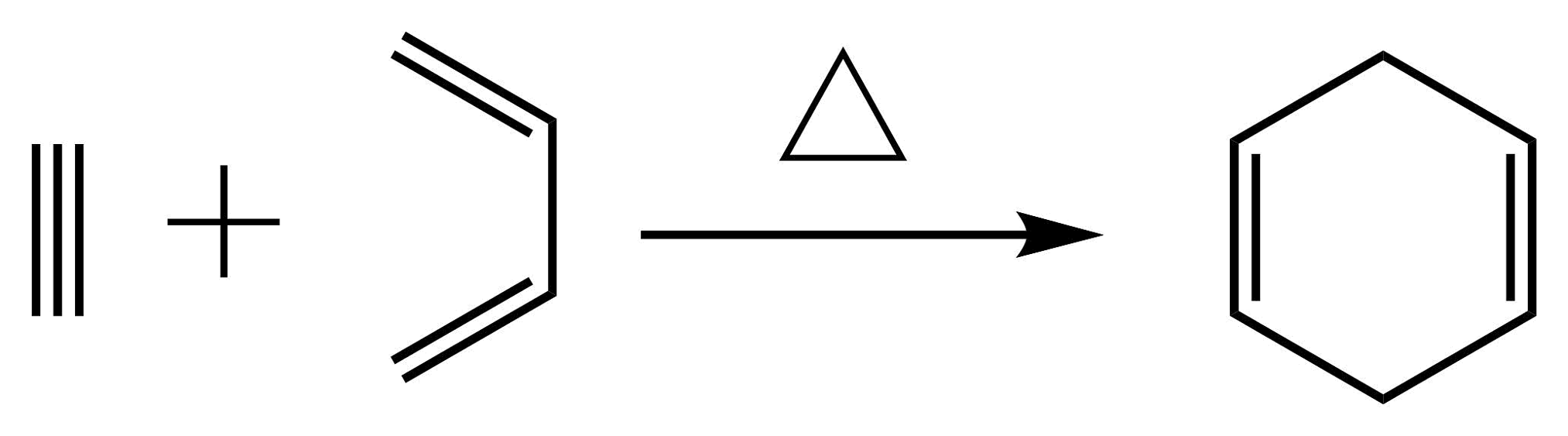 , 合成
, 合成 所用的原料是(用键线式表示)。
所用的原料是(用键线式表示)。 -
12、药品是一种免疫调节剂,其合成路线如下。下列说法正确的是
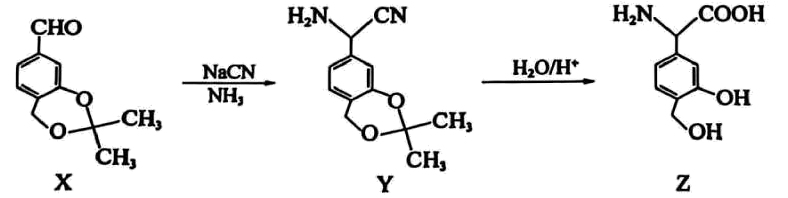 A、X分子中所有原子可能共平面 B、分子中含有2个手性碳原子 C、最多能与反应 D、可以用酸性溶液检验中是否含有
A、X分子中所有原子可能共平面 B、分子中含有2个手性碳原子 C、最多能与反应 D、可以用酸性溶液检验中是否含有 -
13、葫芦脲在超分子化学和材料科学中发挥着重要的作用。葫芦[7]脲的合成路线如下图所示,试剂和试剂均能发生银镜反应。

下列说法不正确的是
A、E与试剂a反应中二者消耗的物质的量之比为2:1 B、F、G互为同系物 C、试剂a、b的核磁共振氢谱均仅有一组峰 D、由为原料制取生成 -
14、根据下列实验操作和现象得出的结论正确的是
选项
实验操作和现象
结论
A
将少量某卤代烃与溶液混合共热,充分反应并冷却后,向溶液中加稀酸化,再滴加溶液,产生淡黄色沉淀
该卤代烃含溴元素
B
向可能含有少量苯酚的苯中滴加过量的浓溴水,未出现白色沉淀
苯中不含苯酚
C
在试管中取约溶液,加入5滴溶液,振荡后加入有机物溶液并加热,无砖红色沉淀产生
X中不含醛基
D
在试管中取少量滴有酚酞的氢氧化钠溶液,向其中滴入有机液体直至过量,溶液颜色褪去
X中含有羧基
A、A B、B C、C D、D -
15、下列有关乙酸乙酯制备实验的说法正确的是
 A、加热有利于加快反应速率,应尽可能提供较高温度 B、反应一段时间后红色溶液上方出现油状液体,其中不含密度比水大的乙酸 C、取出试管B并充分振荡后上层油状液体体积减少,部分乙酸乙酯溶解于下层溶液 D、向振荡后红色褪去的下层溶液中滴入酚酞后又出现红色,说明酚酞溶于乙酸乙酯
A、加热有利于加快反应速率,应尽可能提供较高温度 B、反应一段时间后红色溶液上方出现油状液体,其中不含密度比水大的乙酸 C、取出试管B并充分振荡后上层油状液体体积减少,部分乙酸乙酯溶解于下层溶液 D、向振荡后红色褪去的下层溶液中滴入酚酞后又出现红色,说明酚酞溶于乙酸乙酯 -
16、酸性条件下,环氧乙烷水合法制备乙二醇涉及的机理如图:
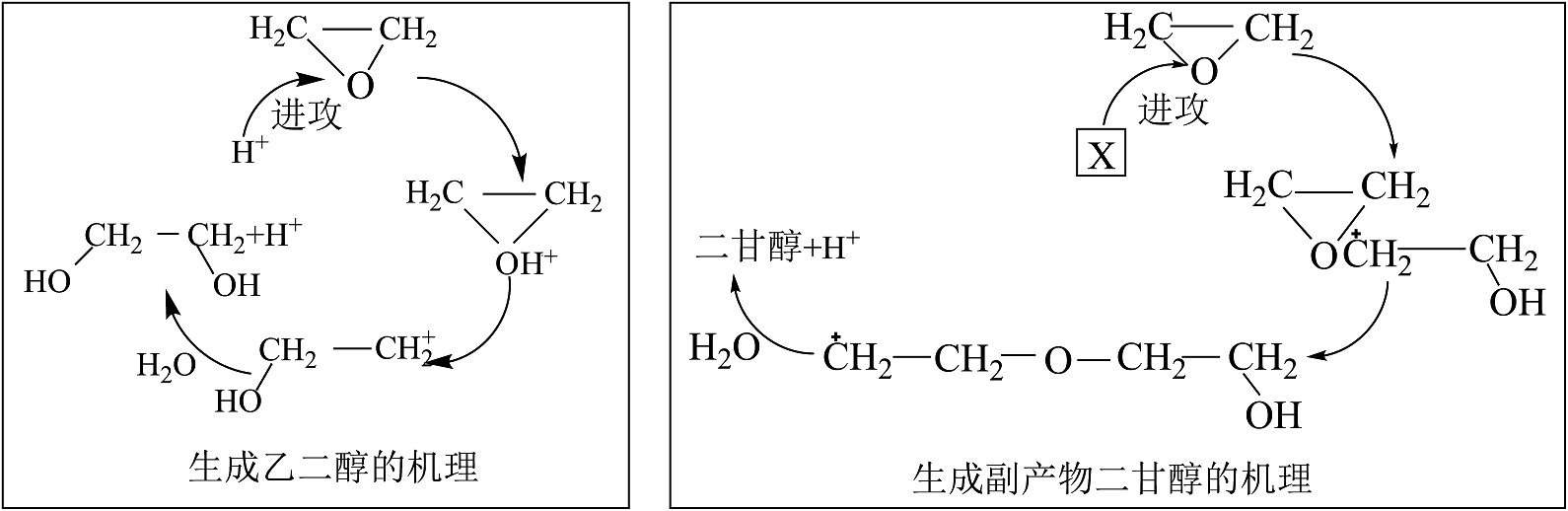
下列说法不正确的是
A、的结构简式为: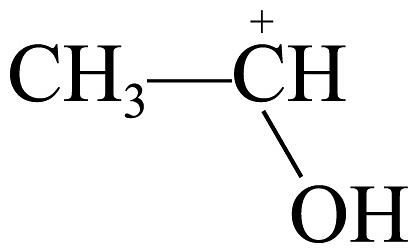 B、进攻环氧乙烷中的氧原子是因为碳氧键的共用电子对偏向氧
C、在制备乙二醇的反应中起催化作用
D、二甘醇是乙二醇发生分子间脱水反应的产物
B、进攻环氧乙烷中的氧原子是因为碳氧键的共用电子对偏向氧
C、在制备乙二醇的反应中起催化作用
D、二甘醇是乙二醇发生分子间脱水反应的产物
-
17、有机小分子通过选择性催化聚合可分别得到聚合物和 , 下列说法不正确的是
 A、X的结构简式为
A、X的结构简式为 B、Z中含有的官能团为酯基和碳碳双键
C、由生成的反应为缩聚反应
D、能在溶液中降解为小分子而不能
B、Z中含有的官能团为酯基和碳碳双键
C、由生成的反应为缩聚反应
D、能在溶液中降解为小分子而不能
-
18、按下图实验装置(部分装置略)对有机样品进行元素分析。样品完全灼烧并将所有气体产物充分吸收后,管增重管增重。质谱法测得该有机物的相对分子质量为118。下列说法正确的是
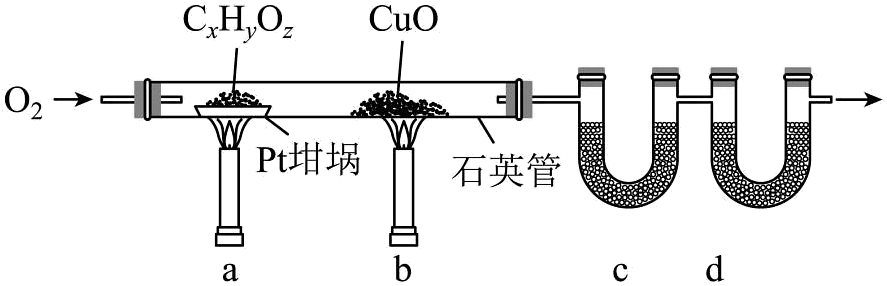 A、先通入氧气,再先后点燃a、b处煤气灯 B、中使用碱石灰吸收反应产生的 C、若撤去可能导致测得中值偏大 D、该有机物的分子式为
A、先通入氧气,再先后点燃a、b处煤气灯 B、中使用碱石灰吸收反应产生的 C、若撤去可能导致测得中值偏大 D、该有机物的分子式为 -
19、乙烯使溴水快速褪色的反应历程如图所示:

已知:①乙烯使溴的四氯化碳溶液褪色比该反应慢得多;②完全反应后两种产物含量分别为10.2%和89.8%。下列说法不正确的是
A、对乙烯与溴加成生成1,2-二溴乙烷的反应具有催化作用 B、中间产物 中所有原子最外层均达到稳定结构
C、反应Ⅱ得到两种产物含量不同的原因是溴水中浓度大于
D、乙烯与溴水反应产物应有1-溴乙醇次溴酸酯
中所有原子最外层均达到稳定结构
C、反应Ⅱ得到两种产物含量不同的原因是溴水中浓度大于
D、乙烯与溴水反应产物应有1-溴乙醇次溴酸酯
-
20、下列有机物的命名正确的是
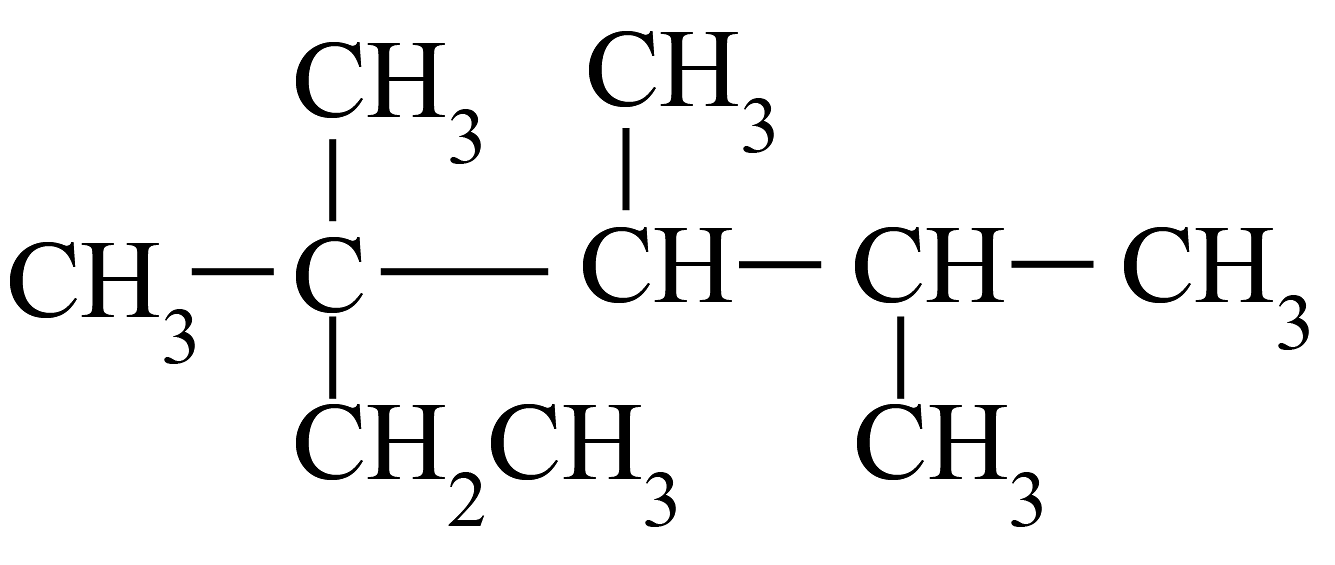

A.2,3,4-三甲基-2-乙基戊烷
B.1,3-二丙醇
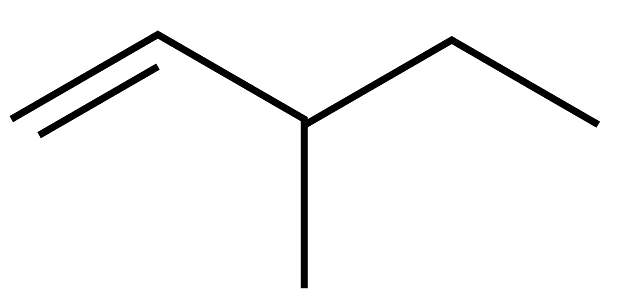
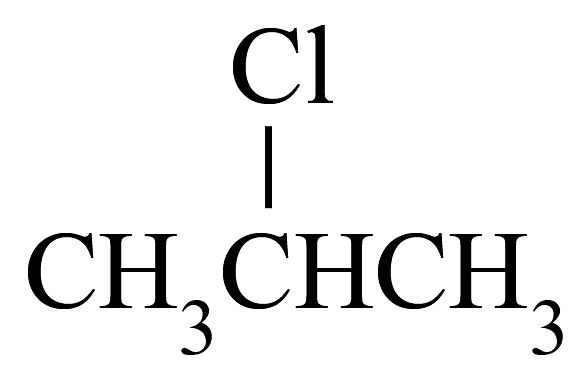
C.3-乙基-1-丁烯
D.2-氯丙烷
A、A B、B C、C D、D