相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、W、X、Z、Y为4种短周期的主族元素,原子序数依次增大,W和Z、X和Y均同主族,且X的原子序数是Y的一半,4种元素形成的化合物如图。下列说法不正确的是
 A、离子半径: B、化合物ZW与水反应可产生一种气体 C、Y的氧化物对应的水化物为强酸 D、简单氢化物的稳定性和沸点高低均
A、离子半径: B、化合物ZW与水反应可产生一种气体 C、Y的氧化物对应的水化物为强酸 D、简单氢化物的稳定性和沸点高低均 -
2、下列离子方程式正确的是A、碳酸氢钠溶液中加入足量的盐酸: B、中投入固体: C、向氢氧化铁胶体中滴加氢碘酸: D、向溶液中滴入溶液使恰好完全沉淀:
-
3、发蓝工艺是一种材料保护技术,钢铁零件经历如图转化进行发蓝处理,已知的还原产物为。下列说法不正确的是
 A、中铁的价态为 , B、反应③属于非氧化还原反应 C、反应②的离子方程式为 D、反应①中还原剂和氧化剂的物质的量之比为
A、中铁的价态为 , B、反应③属于非氧化还原反应 C、反应②的离子方程式为 D、反应①中还原剂和氧化剂的物质的量之比为 -
4、关于营养物质,下列说法不正确的是A、利用蛋白质的变性可以分离、提纯蛋白质 B、久置的食用油有“哈喇”味,因其含有碳碳双键 C、根据灼烧时产生的气味,可以鉴别蚕丝与棉花 D、淀粉、蛋白质、油脂能在酸性条件下水解
-
5、下列实验装置使用正确的是
 A、图①装置用于测定中和反应的反应热 B、图②装置用于实验室制取并收集氨气 C、图③装置用于比较C与Si的非金属性强弱 D、图④装置用于和的取代反应并有油状液体生成
A、图①装置用于测定中和反应的反应热 B、图②装置用于实验室制取并收集氨气 C、图③装置用于比较C与Si的非金属性强弱 D、图④装置用于和的取代反应并有油状液体生成 -
6、下列说法不正确的是A、天然气作为化工原料可用于合成氨和生产甲醇 B、煤的干馏得到煤焦油,从中分离可获得苯 C、天然橡胶硫化时由线型结构转变为网状结构 D、石油分馏和石油裂化均可获得汽油,二者性质相同
-
7、向下列溶液中通入足量相应气体后,各离子组还能大量存在的是A、二氧化碳:、、、 B、氨气:、、、 C、氯化氢:、、、 D、二氧化硫:、、、
-
8、下列说法正确的是A、可使紫色石蕊先变红后褪色 B、在空气里受热能迅速被氧化成 C、工业上用电解氯化钠溶液制取金属钠 D、久置的铝片插入氢氧化钠溶液中不反应
-
9、下列说法正确的是A、硬铝的硬度比铝大,利用了合金原子改变了铝原子原有的规则层状排列 B、明矾、、等作为水处理剂,利用了其杀菌消毒的作用 C、氢氟酸腐蚀玻璃可生产磨砂玻璃,利用了二氧化硅酸性氧化物的性质 D、浓硫酸干燥、、等气体,利用了浓硫酸的吸水性
-
10、下列关于实验操作说法不正确的是A、检验葡萄糖的银氨溶液和氢氧化铜悬浊液都要新制 B、试管内附着的硫可用热的碱溶液清洗,附着的银可用浓氨水清洗 C、向沸水中逐滴加入饱和氯化铁溶液煮沸至红褐色可制得氢氧化铁胶体 D、可通过与盐酸反应热效应的不同,鉴别碳酸钠和碳酸氢钠两种白色固体
-
11、下列说法正确的是A、与互为同素异形体 B、和互为同位素 C、甲醇与二甲醚互为同分异构体 D、乙酸和硬脂酸互为同系物
-
12、下列有关化学用语表示正确的是A、中子数为20的氯离子: B、的空间构型为直线型 C、乙烯的结构简式: D、溶液中的水合离子:

-
13、含有非极性共价键的离子化合物的是A、 B、 C、 D、
-
14、设为阿伏加德罗常数的值,下列说法正确的是A、的溶液中,所含的离子总数为 B、室温下,的水溶液中,所含的氧原子总数为 C、标准状况下,由和组成的固体混合物中,所含的氧原子总数一定为 D、的盐酸与溶液混合后,生成的水分子数一定为
-
15、把溶液与溶液各取混合(假设混合溶液的体积等于混合前两种溶液的体积之和)。(1)、此混合溶液中的浓度为。(2)、向混合溶液中加入足量铁粉,充分反应后(忽略溶液体积的变化),测得溶液中的浓度为 , 则。(3)、若向混合溶液中加入一定量的铁粉,充分反应后,过滤出不溶物,溶液质量增重 , 则反应后的溶液中为。
-
16、氯水中含多种微粒,往有色鲜花上滴加氯水,使鲜花褪色的微粒是A、 B、 C、 D、
-
17、下列说法正确的是A、中每个原子最外电子层都具有8电子稳定结构 B、分子的空间结构是Ⅴ形 C、晶体中既有离子键又有非极性共价键 D、溶于水形成溶液的过程中,既有离子键和共价键的断裂,又有共价键的形成
-
18、图a~c分别为氯化钠在不同状态下的导电实验(电极均为石墨电极)微观示意图。下列说法不正确的是
 A、图a表示的是干燥的固体不导电,所以电解质不一定能导电 B、图b中形成水合钠离子和水合氯离子的过程通常表示为: C、图表示熔融的能导电,因为离子的运动随温度升高而加快,克服了离子键 D、由图a~c可知,能导电的物质必须具有能自由移动、带电荷的粒子
A、图a表示的是干燥的固体不导电,所以电解质不一定能导电 B、图b中形成水合钠离子和水合氯离子的过程通常表示为: C、图表示熔融的能导电,因为离子的运动随温度升高而加快,克服了离子键 D、由图a~c可知,能导电的物质必须具有能自由移动、带电荷的粒子 -
19、下列说法正确的是A、溶于水后电离出氢离子的化合物一定是酸 B、用铂丝蘸取少量某溶液进行焰色试验,火焰呈黄色,该溶液一定是钠盐溶液 C、燃烧一定是氧化还原反应 D、氯化钠溶液在电流作用下电离出钠离子和氯离子
-
20、氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可通过氯化反应制备。(1)、硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:。
①若正反应的活化能为 , 则逆反应的活化能(用含的代数式表示)。
②恒容密闭容器中按不同进料比充入和其 , 测定温度下体系达平衡时的(为体系初始压强, , P为体系平衡压强),结果如图。
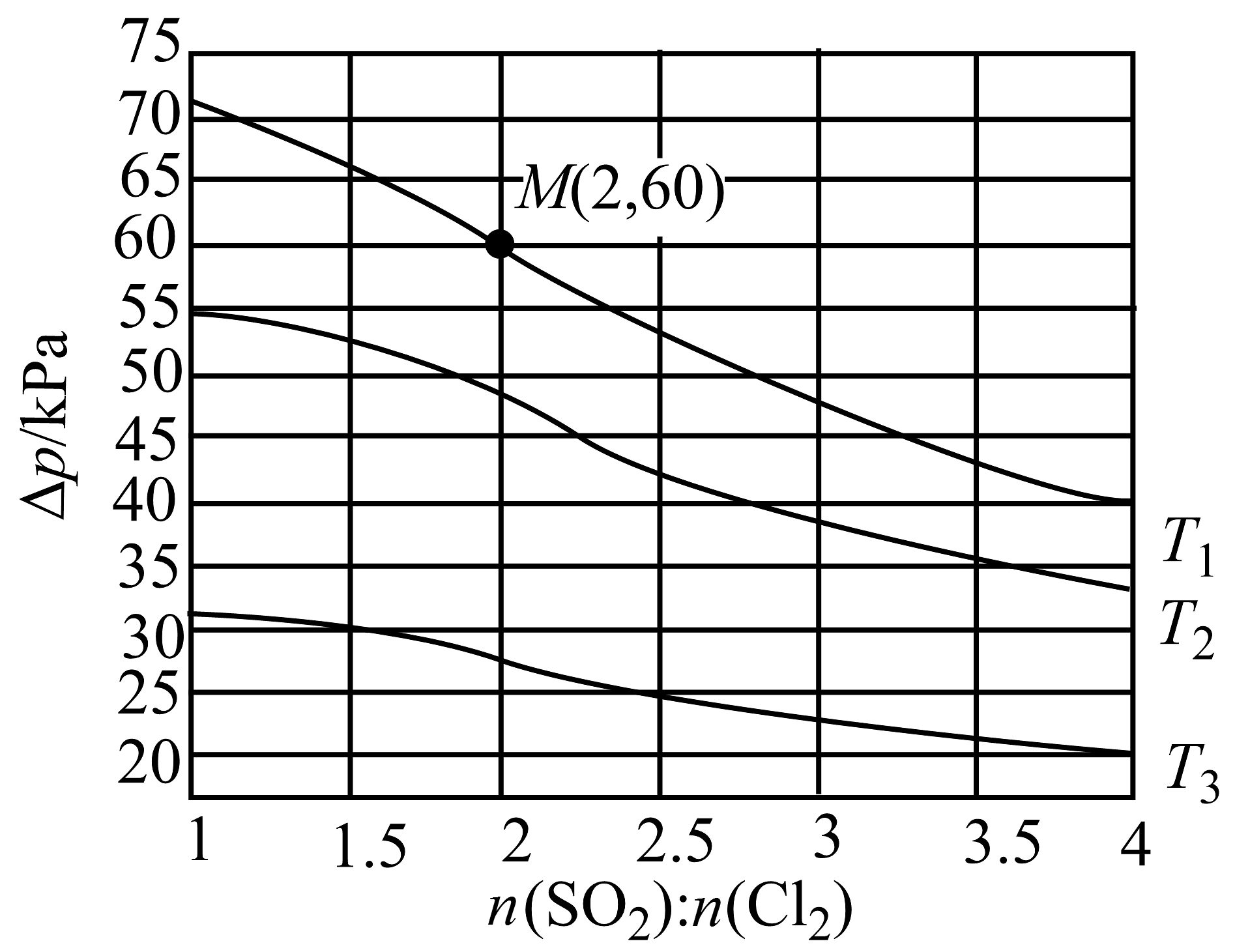
上图中温度由高到低的顺序为 , 判断依据为。M点的转化率为 , 温度下用分压表示的平衡常数。
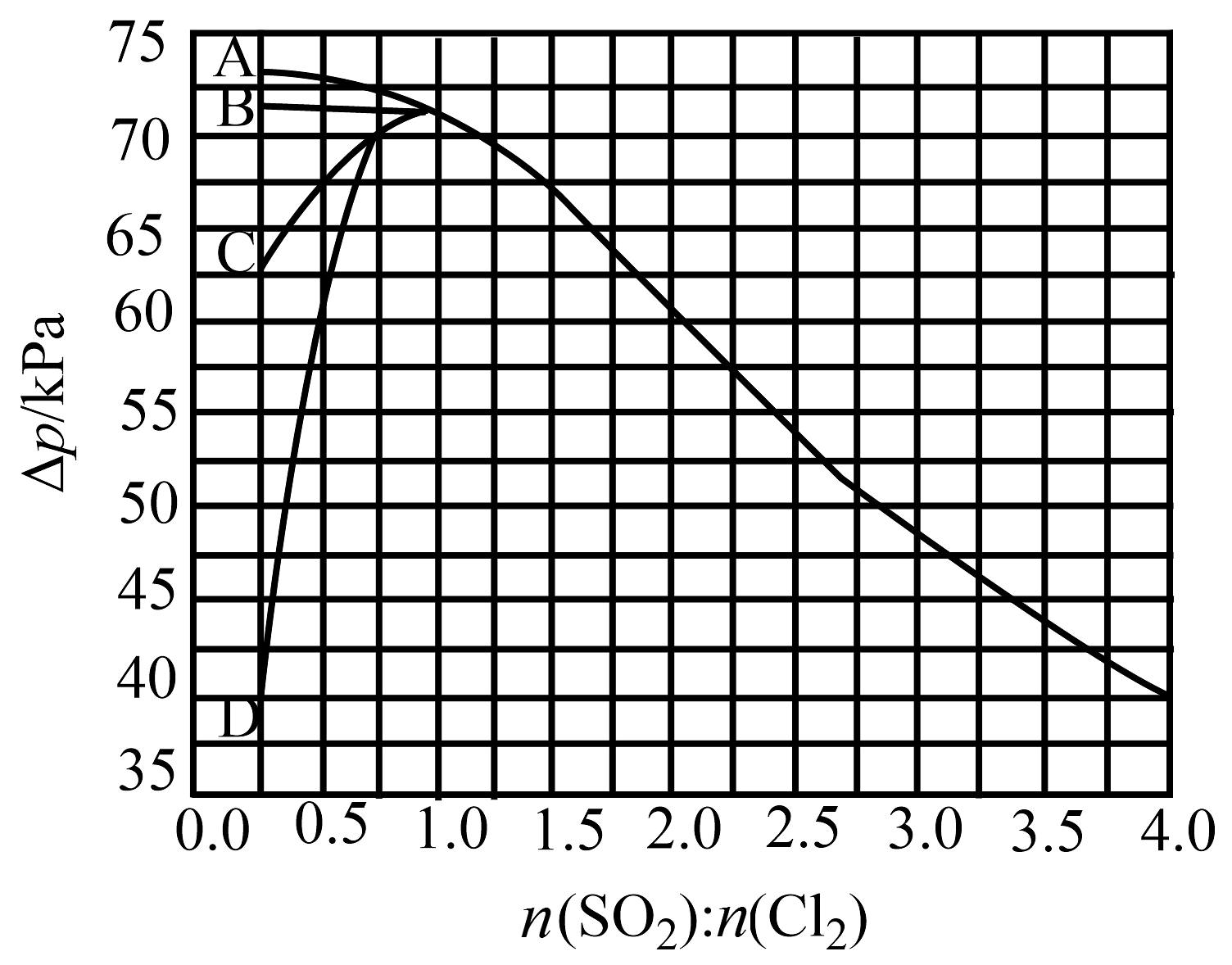
③下图曲线中能准确表示温度下随进料比变化的是(填序号)。
 (2)、1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度氯化时反应过程为
(2)、1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度氯化时反应过程为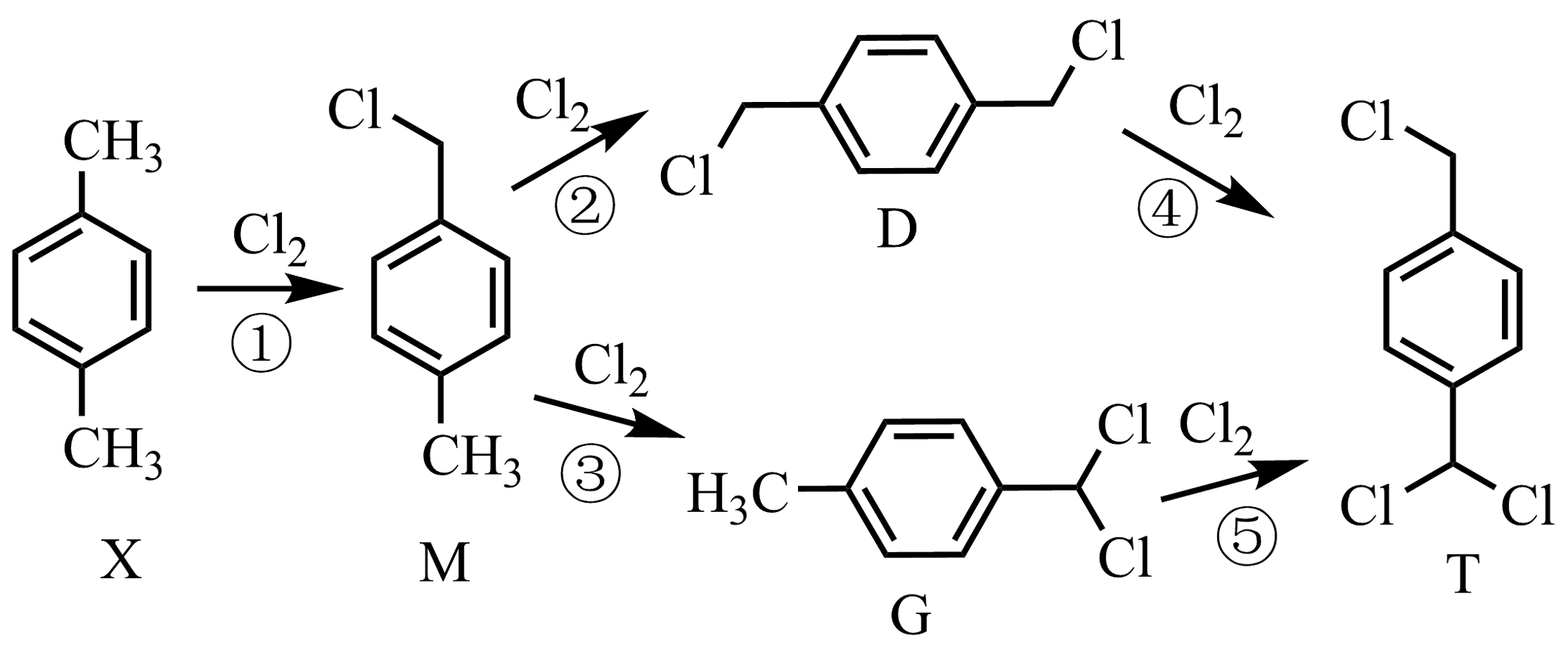
以上各反应的速率方程均可表示为 , 其中分别为各反应中对应反应物的浓度,k为速率常数(分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,。
①时, , 且内 , 反应进行到时,。
②时, , 若产物T的含量可忽略不计,则此时后,随T的含量增加,(填“增大”“减小”或“不变”)。