相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、叔丁基氯 与碱溶 液经两步反应 得到叔丁基醇,反应 (CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示:

下列说法正确的是
A、该反应为吸热反应 B、(CH3)3C+比(CH3)3 CCl 稳定 C、第一步反应一定比第二步反应快 D、增大碱的浓度和升高温度均可加快反应速率 -
2、某反应由两步反应A→B→C构成,其反应能量曲线如图所示,下列叙述正确的是
 A、两步反应均为吸热反应 B、三种物质中B最稳定 C、A与C的能量差为 D、A→B的反应不一定需要加热
A、两步反应均为吸热反应 B、三种物质中B最稳定 C、A与C的能量差为 D、A→B的反应不一定需要加热 -
3、滴定法是用于测定溶液中微粒浓度的重要方法。某实验小组利用滴定法测定碘酒中碘的含量。(1)、配制稀碘液:移取10.00mL碘酒,准确配制100mL稀碘液。需要的玻璃仪器有:烧杯、玻璃棒、(从下列图中选择,填选项) 。
A.
 B.
B.  C.
C.  D.
D.  (2)、测定碘含量:每次取25.00mL稀碘液于锥形瓶中,滴加几滴淀粉溶液,加入适量稀后,用浓度为0.1000标准溶液滴定,实验数据如下表所示。
(2)、测定碘含量:每次取25.00mL稀碘液于锥形瓶中,滴加几滴淀粉溶液,加入适量稀后,用浓度为0.1000标准溶液滴定,实验数据如下表所示。序号
溶液的用量/mL
稀碘液的用量/mL
1
21.32
25.00
2
20.02
25.00
3
19.98
25.00
已知:
①第1次实验溶液的用量明显多于后两次,原因可能是
A.盛装标准溶液的滴定管用蒸馏水洗净后,未润洗
B.滴入半滴标准溶液,溶液变色,即判定达滴定终点
C.滴定达终点时发现滴定管尖嘴内有气泡产生
D.滴定终点读取滴定管刻度时,俯视标准液液面
②该碘酒中碘的含量为。(已知)
(3)、借鉴(2)的方法,用图所示的流程测定海带中的碘含量。
①加入发生的离子反应方程式是。
②预测达到滴定终点的实验现象为 , 在实验时却发现溶液变色片刻后,恢复滴定前的颜色。继续滴加 , 溶液变色片刻后再一次恢复原色。
(4)、探究异常现象产生的原因。该学习小组通过设计对照实验,发现空气中的氧气并不能较快地氧化待测液中的。
提出猜想:过量的将生成的重新氧化成碘单质。
验证猜想:将2mL待测液、2滴0.1溶液、2滴淀粉溶液和混合,用溶液滴定,若待测液变为无色后又反复变色,则证明猜想不成立。
提出疑问:什么物质反复氧化碘离子。
寻找证据:按图中的流程,用量改为少量,氧化后的待测液静置半小时,利用氧化还原电势传感器测定滴定过程中电势的变化,待溶液变色后停止滴定,溶液恢复原色后继续滴加至溶液变色,循环往复,得到图所示的曲线。

已知:
ⅰ氧化性物质的电势值高于还原性物质:
ⅱ一定条件下,氧化性物质的浓度越高,电势越高,还原性物质浓度越高,电势越低。
a-b段电势升高的原因是(填化学式)被氧化。由a-b段电势变化的斜率小于b-c段可推测溶液反复变色的原因是。
优化流程:将用氧化后的待测液 , 再进行滴定,到达滴定终点时待测液变色后不会恢复原色。
-
4、利用双极膜电解含有的溶液,使转化成碳燃料,实现了还原流动。电解池如下图所示,双极膜中水电离的和在电场作用下可以向两极迁移。下列说法不正确的是
 A、银网电极与电源负极相连 B、双极膜b侧应该用质子交换膜 C、阴极电极反应为: D、双极膜中有0.1mol 电离,则阳极附近理论上产生0.05mol
A、银网电极与电源负极相连 B、双极膜b侧应该用质子交换膜 C、阴极电极反应为: D、双极膜中有0.1mol 电离,则阳极附近理论上产生0.05mol -
5、价类二维图和实验是学习元素及其化合物的重要方法。下列说法不正确的是
 A、a→f→g→h的每一步转化均需要加入氧化剂 B、通过上图实验装置可制备e,并较长时间保持白色沉淀不变色 C、d可与足量的HI溶液发生复分解反应得到g D、c→a可通过在一定条件下加入CO、Al等还原剂实现
A、a→f→g→h的每一步转化均需要加入氧化剂 B、通过上图实验装置可制备e,并较长时间保持白色沉淀不变色 C、d可与足量的HI溶液发生复分解反应得到g D、c→a可通过在一定条件下加入CO、Al等还原剂实现 -
6、将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是
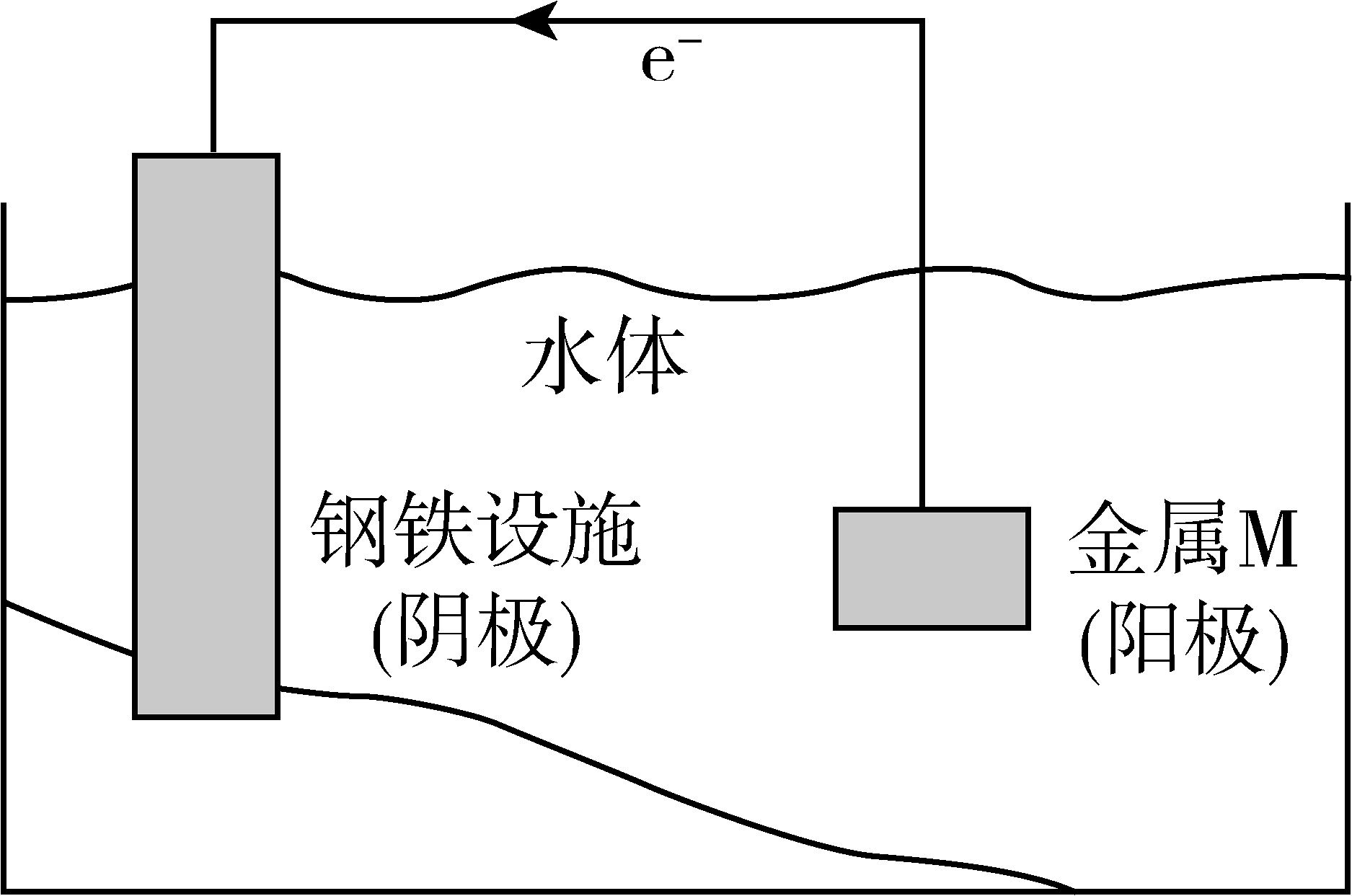 A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快
A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快 -
7、向过氧化钠与水反应后的溶液中滴加2滴酚酞试液,溶液先变红后褪色。为了探究其原因,进行下图三个实验。实验①取反应后溶液加入二氧化锰后迅速产生大量气体,使带火星的木条复燃;实验②溶液变红,且不褪色:实验③通入氧气,溶液红色不褪去。下列说法不正确的是
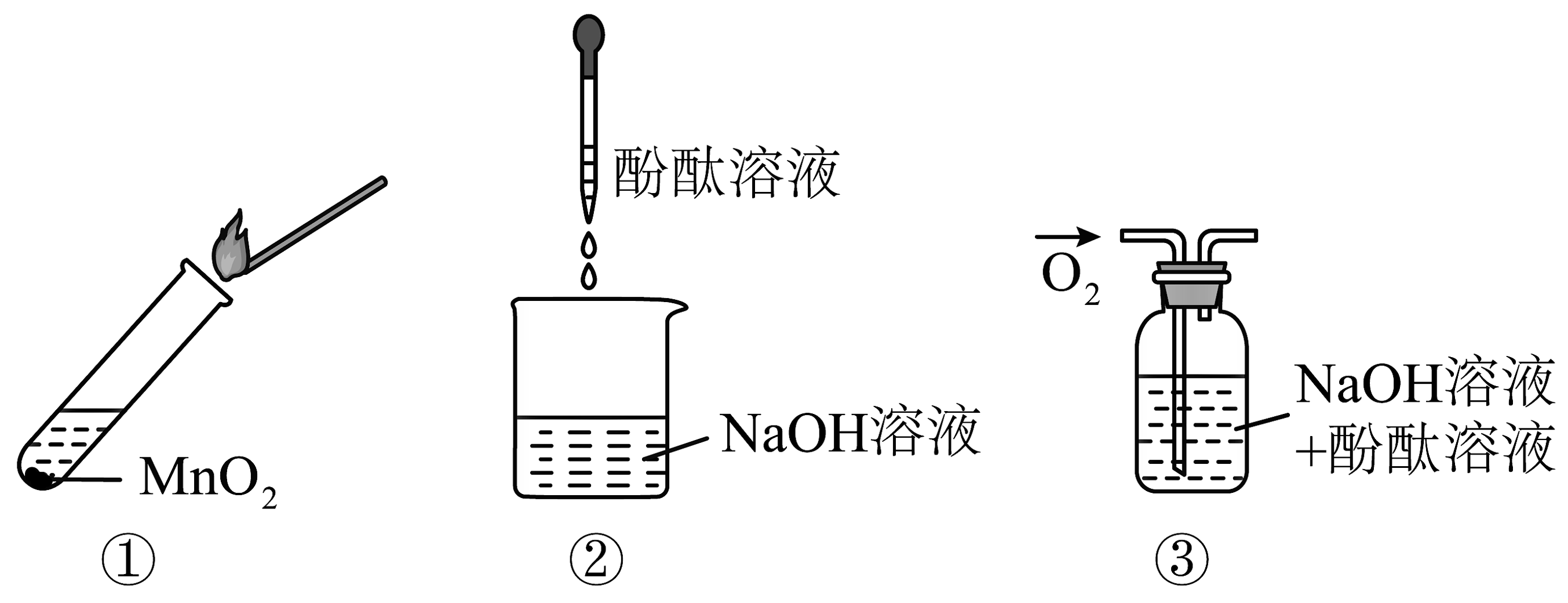 A、实验①中发生的反应是氧化还原反应 B、实验①证明过氧化钠与水反应需要作催化剂 C、实验②③证明使酚酞褪色的不是氢氧化钠和氧气 D、由上述实验可知:过氧化钠与水混合有这个反应发生
A、实验①中发生的反应是氧化还原反应 B、实验①证明过氧化钠与水反应需要作催化剂 C、实验②③证明使酚酞褪色的不是氢氧化钠和氧气 D、由上述实验可知:过氧化钠与水混合有这个反应发生 -
8、针对如图所示的乙醇分子结构,下列说法不正确的是
 A、与乙酸、浓硫酸共热时,②键断裂 B、与钠反应时,①键断裂 C、与浓硫酸共热至170℃时,②、④键断裂 D、在Ag催化下与O2反应时,①、③键断裂
A、与乙酸、浓硫酸共热时,②键断裂 B、与钠反应时,①键断裂 C、与浓硫酸共热至170℃时,②、④键断裂 D、在Ag催化下与O2反应时,①、③键断裂 -
9、下列反应中,只做氧化剂的是A、 B、 C、 D、
-
10、下列物质的应用中,与氧化还原反应无关的是A、用和制取盐酸 B、用生石灰()作干燥剂 C、用铝粉和作管道疏通剂 D、用漂白棉、麻、纸张
-
11、某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如表:
编号
电极材料
电解质溶液
电流表指针偏转方向
1
Mg、Al
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、石墨
稀硝酸
偏向石墨
4
Mg、Al
NaOH溶液
偏向Mg
根据表中记录的实验现象,回答下列问题。
(1)、实验1、2中Al电极的作用是否相同?。(2)、实验3中铝为极,石墨电极反应式为。(3)、实验4中铝为负极,写出铝电极的电极反应式:。 -
12、以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1<0
Ⅱ.CO(g)+2H2(g)=CH3OH(g) ΔH2<0
Ⅲ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3>0
向恒压、密闭容器中通入1molCO2和3molH2发生上述反应,平衡时CH3OH、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是
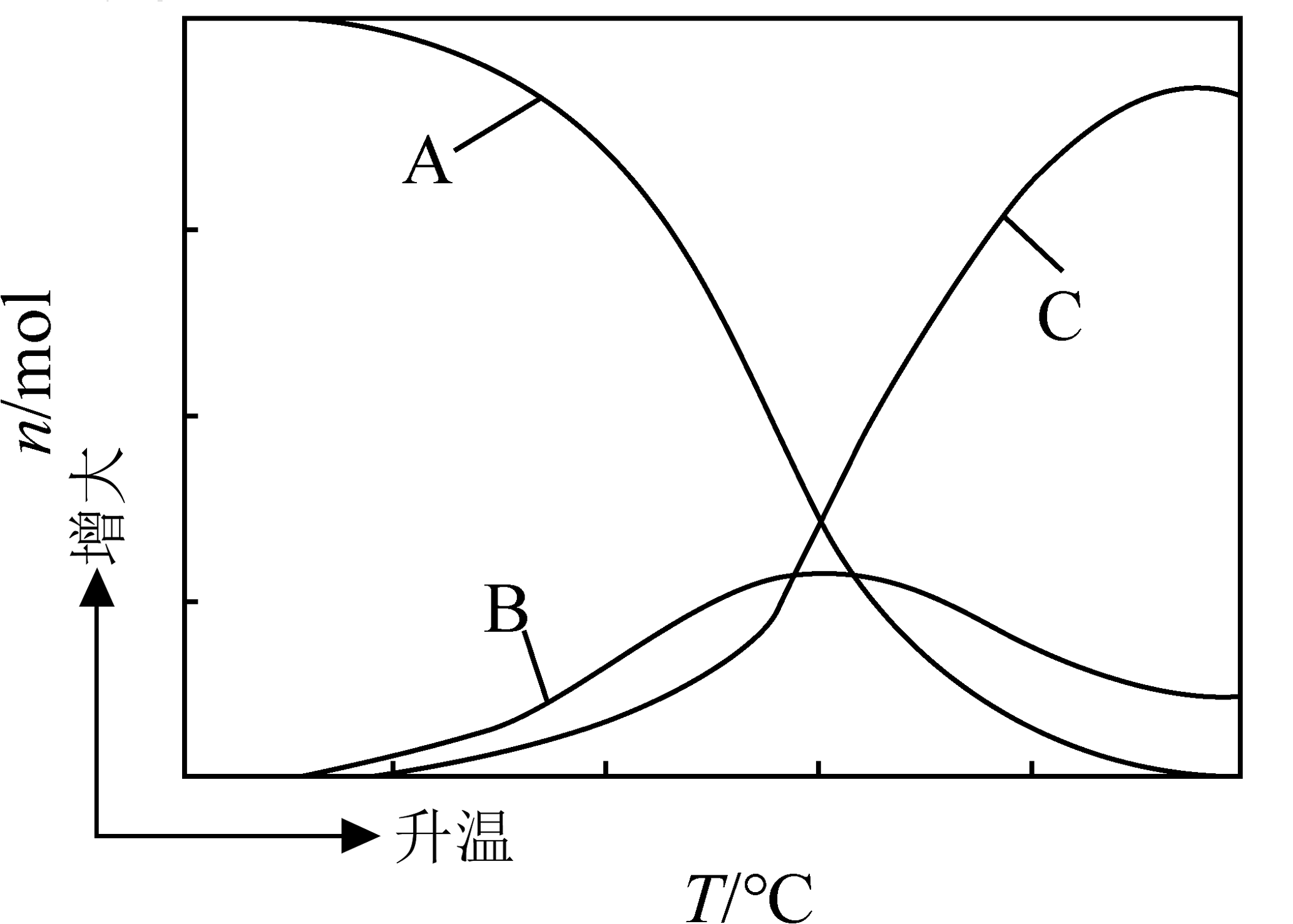 A、反应Ⅰ平衡常数可表示为K= B、图中曲线B表示CO的物质的量随温度的变化 C、某时刻CH3OH(g)为amol,CO为bmol,此时H2O(g)为(a+b)mol D、为提高CH3OH的平衡产率,需要选择低温、低压的反应条件
A、反应Ⅰ平衡常数可表示为K= B、图中曲线B表示CO的物质的量随温度的变化 C、某时刻CH3OH(g)为amol,CO为bmol,此时H2O(g)为(a+b)mol D、为提高CH3OH的平衡产率,需要选择低温、低压的反应条件 -
13、向100 mL NaOH溶液中通入一定量的CO2气体,经充分反应后,再向所获得的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是
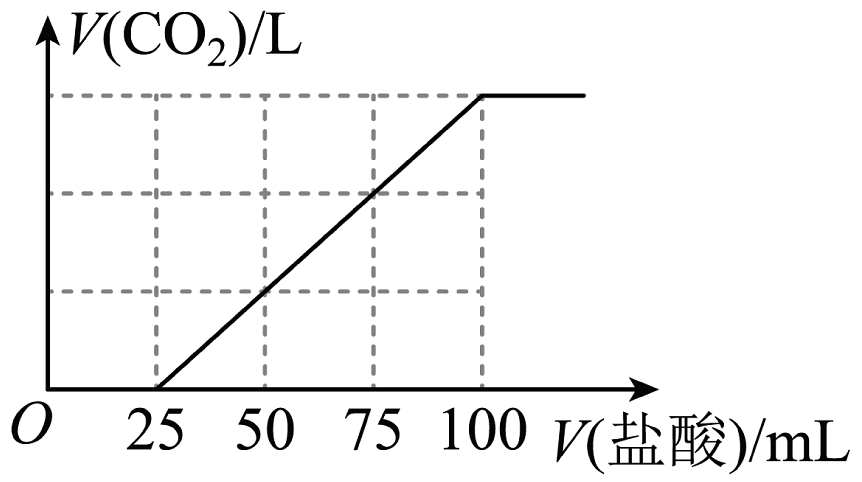 A、原NaOH溶液的物质的量浓度为0.1 mol/L B、通入CO2在标准状况下的体积为224 mL C、V(盐酸)=0~25 mL的范围内发生的离子反应为:+ H+= D、所得溶液的溶质成分为Na2CO3和NaHCO3
A、原NaOH溶液的物质的量浓度为0.1 mol/L B、通入CO2在标准状况下的体积为224 mL C、V(盐酸)=0~25 mL的范围内发生的离子反应为:+ H+= D、所得溶液的溶质成分为Na2CO3和NaHCO3 -
14、下列有关热化学方程式的叙述正确的是A、2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol可以表示氢气的燃烧热 B、已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-28.7kJ/mol D、已知2C(s)+2O2(g)=2CO2(g) ΔH1 ;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1<ΔH2
-
15、工业上以铬铁矿(主要成分为FeO⋅Cr2O3 , 含有少量Al2O3)为原料制备金属铬的流程如图。下列有关流程中的步骤说法错误的是
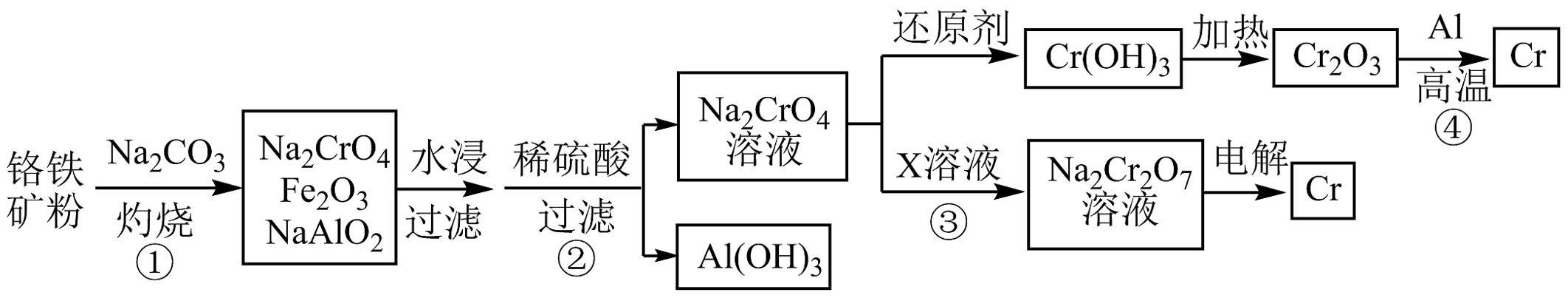 A、①需持续吹入空气作氧化剂 B、②需加入过量稀硫酸 C、③X一般为硫酸 D、④发生了铝热反应
A、①需持续吹入空气作氧化剂 B、②需加入过量稀硫酸 C、③X一般为硫酸 D、④发生了铝热反应 -
16、有机化合物的结构简式如图所示。下列说法正确的是
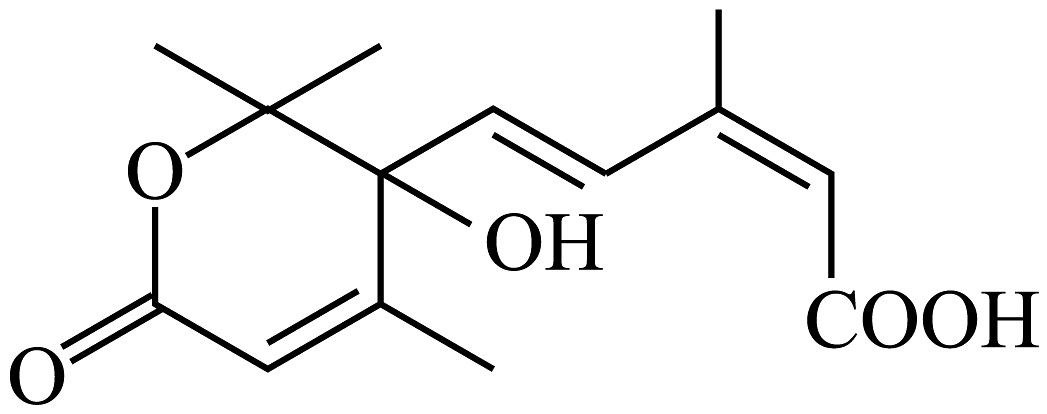 A、分子中含有5种官能团 B、该有机物既可以使酸性溶液褪色又可以使溴水褪色 C、1mol在一定条件下可与5mol氢气发生反应 D、有机化合物分子中所有碳原子都在同一平面上
A、分子中含有5种官能团 B、该有机物既可以使酸性溶液褪色又可以使溴水褪色 C、1mol在一定条件下可与5mol氢气发生反应 D、有机化合物分子中所有碳原子都在同一平面上 -
17、微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液作模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
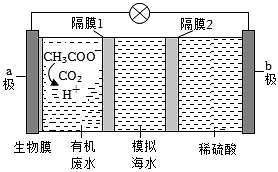 A、b极每生成1molH2 , 模拟海水理论上除盐58.5g B、隔膜1为阴离子交换膜,隔膜2为阳离子交换膜 C、负极反应为CH3COO-+2H2O-8e-=2CO2+7H+ D、电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
A、b极每生成1molH2 , 模拟海水理论上除盐58.5g B、隔膜1为阴离子交换膜,隔膜2为阳离子交换膜 C、负极反应为CH3COO-+2H2O-8e-=2CO2+7H+ D、电池工作一段时间后,正、负极产生气体的物质的量之比为2:1 -
18、用下列实验装置进行相应实验,能达到实验目的的是
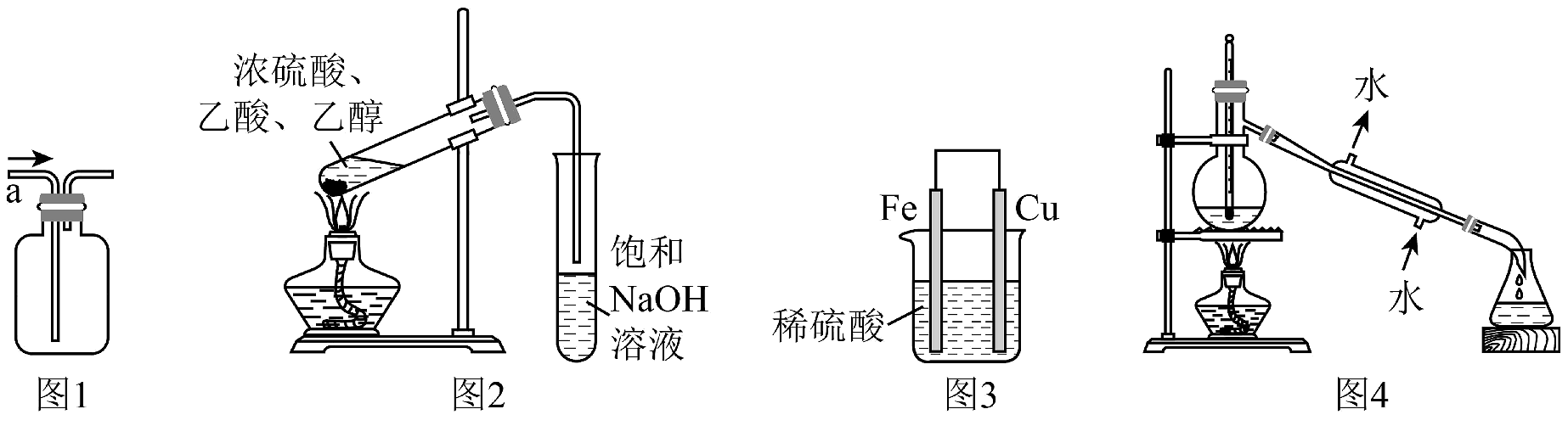 A、用图1所示装置从a口进气收集纯净的CH4 B、用图2所示装置制取并收集乙酸乙酯 C、用图3所示装置比较Fe、Cu的金属活动性 D、用图4所示装置进行石油的蒸馏实验
A、用图1所示装置从a口进气收集纯净的CH4 B、用图2所示装置制取并收集乙酸乙酯 C、用图3所示装置比较Fe、Cu的金属活动性 D、用图4所示装置进行石油的蒸馏实验 -
19、下列说法正确的是A、
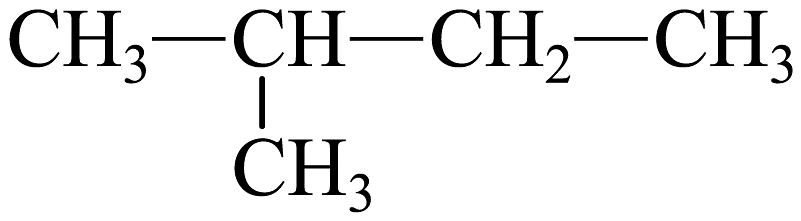 与
与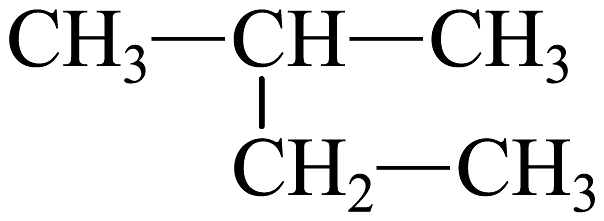 为同一种物质
B、H2、D2、T2互为同分异构体
C、CH3Cl和ClCH2CH2Cl互为同系物
D、
为同一种物质
B、H2、D2、T2互为同分异构体
C、CH3Cl和ClCH2CH2Cl互为同系物
D、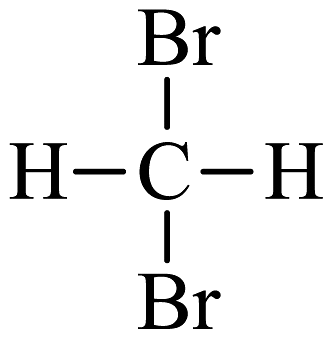 与
与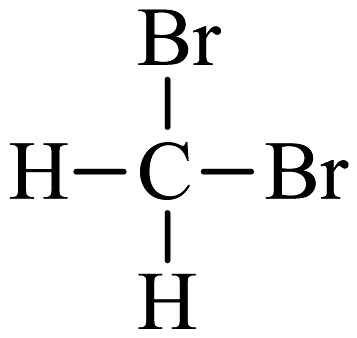 互为同分异构体
互为同分异构体
-
20、以下实验装置能达到实验目的的是
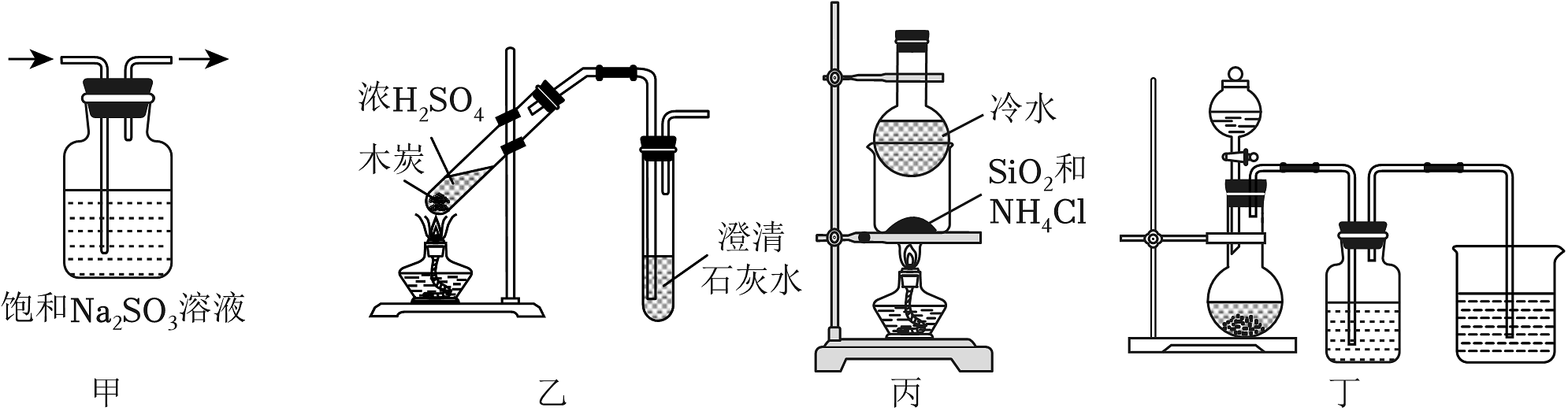 A、甲:除去SO2中的HCl B、乙:验证反应有CO2生成 C、丙:分离SiO2和NH4Cl D、丁:用铜片和稀硝酸制备NO并收集NO
A、甲:除去SO2中的HCl B、乙:验证反应有CO2生成 C、丙:分离SiO2和NH4Cl D、丁:用铜片和稀硝酸制备NO并收集NO