相关试卷
- 江西省九江市重点高中2016-2017学年高二下学期化学开学考试试卷
- 高中化学人教版选修4 第一章 单元测试卷
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.3核素
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
- 2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.1元素周期表
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.2资源综合利用环境保护
- 2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
-
1、在无色透明的碱溶液中,能大量共存的离子组A、Fe3+、Na+、、Cl- B、Mg2+、、、Cl- C、Na+、K+、、Cl- D、Cu2+、Na+、、
-
2、分类是学习和研究化学的一种重要思想方法,下列关于物质分类的说法中正确的是A、漂白粉、胆矾都是混合物 B、烧碱、氯化钠都是离子化合物 C、二氧化碳、一氧化碳都是酸性氧化物 D、水、氨水都是弱电解质
-
3、下列离子方程式中正确的是A、氯气与碘化钾溶液反应:Cl2+I-=Cl-+I2 B、氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ C、碳酸钠溶液与足量稀盐酸反应:+2H+=H2O+CO2↑ D、钠与水反应:Na+2H2O=Na++2OH-+H2↑
-
4、下列各组反应,最终一定能得到白色沉淀的是A、向Na2CO3溶液中加入CaCl2溶液 B、向CuSO4溶液中加入NaOH溶液 C、向FeCl2溶液中加入过量NaOH溶液 D、向Al2O3固体中加入过量NaOH溶液
-
5、下列离子方程式书写正确的是A、石灰乳中通入少量: B、往溶液中通入少量: C、碳酸氢钾溶液中滴少量氢氧化钡溶液: D、向溶液中滴加溶液至中性:
-
6、下列电离方程式书写不正确的是A、HNO3=H++ B、Ba(OH)2=Ba2++OH- C、NH4NO3=+NO D、NaHCO3=Na++
-
7、中华民族有着光辉灿烂的发明史,下列发明创造的主要原理不涉及化学变化的是A、黑火药的使用 B、用铁矿石炼铁 C、打磨磁石制备指南针 D、粮食酿酒
-
8、中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是A、《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳极”这是利用了“KNO3 的氧化性” B、《本草经集注》中记载了区分硝石(KNO3) 和朴消(Na2SO4)的方法:“以火烧之, 烟起,乃真硝石也”,二者也可以利用“焰色试验”区分 C、古人很早就掌握了用孔雀石和木炭一起加热进行火法炼铜的工艺,孔雀石的主要成分Cu2(OH)2CO3物质类别属于碱 D、夏天晒盐,冬天捞碱,是古人巧妙运用温度变化和溶解度差异获得资源的方法
-
9、某同学对胶体的有关认识正确的是( )A、氯化钠注射液能产生丁达尔效应,属于胶体 B、通电时溶液中的溶质粒子向两极移动,而胶体分散质粒子向某一极移动 C、Fe(OH)3胶体具有吸附性,可用于净水 D、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
-
10、过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq)⇌CH3CO3H(aq)+H2O(l) △H=-13.7KJ/mol
(1)市售过氧乙酸的浓度一般不超过21%,原因是 。
(2)利用上述反应制备760 g CH3CO3H,放出的热量为kJ。
(3)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。

①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)= g/h(用含m的代数式表示)。
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是。(写出2条)。
(4) SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40 nm和70 nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
-
11、表示阿伏加德罗常数的值。下列说法正确的是A、溶液中含有的数目小于(忽略水的电离) B、标准状况下,与充分反应,生成的分子数目为 C、标准状况下,22.4L HF中含有氟原子的数目为 D、完全分解,得到的分子数目为
-
12、在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是
 A、Ea为逆反应活化能,E
A、Ea为逆反应活化能,E 为正反应活化能
B、该反应为放热反应,ΔH=Ea’-Ea
C、所有活化分子的平均能量高于或等于所有分子的平均能量
D、温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
为正反应活化能
B、该反应为放热反应,ΔH=Ea’-Ea
C、所有活化分子的平均能量高于或等于所有分子的平均能量
D、温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
-
13、某研究小组探究Fe3+盐溶液与Cu的反应,进行了如下实验。
实验装置
序号
试剂a
实验现象

I
0.25 mol·L-1Fe2(SO4)3溶液
溶液逐渐变为蓝色。2天后,Cu片有较大量剩余,溶液仍为蓝色
Ⅱ
0.5 mol·L-1FeCl3溶液
溶液逐渐变为蓝绿色,铜片表面覆盖有白色固体(经检验为CuCl)。2天后,白色固体消失,Cu片无剩余,溶液中产生大量红褐色沉淀
Ⅲ
0.5 mol·L-1 Fe(NO3)3溶液
溶液逐渐变为绿色,实验过程中未见气泡产生。 2天后,Cu片少量剩余,溶液中产生大量红褐色沉淀
资料:i.CuCl、CuSCN是难溶于水的白色固体;
ii.Fe2+ + NO⇌[Fe(NO)]2+ (棕色)。
(1)、用化学用语解释Fe3+盐溶液显酸性的原因。(2)、实验I中发生反应的离子方程式为。(3)、小组同学取2 mL实验I中反应2天后的溶液于试管中,加入2滴1 mol·L-1 KSCN溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想Fe2+可能在该条件下被Cu2+氧化了。
①用离子方程式表示甲同学的猜想。
②甲同学通过实验证实了其猜想,实验方案是。
(4)、对比实验I和实验Ⅱ,小组同学推测Cl-可以催化Fe3+与Cu反应。其理由是。(5)、实验Ⅱ中产生大量红褐色沉淀的原因是。(6)、实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了[Fe(NO)]2+ , 设计并实施了以下实验,验证了其猜想。步骤
实验操作
实验现象
①
向盛有2 g金属Cu片的烧杯中加入试剂X
2天后溶液颜色无明显变化,铜片表面有细小气泡附着
②
继续加入少量FeSO4固体
溶液迅速变为浅棕色
试剂X是。
综合以上实验,Fe3+盐溶液与Cu反应的多样性与阴离子种类、生成物存在形式等有关。
-
14、有关Na2O2性质实验如下:
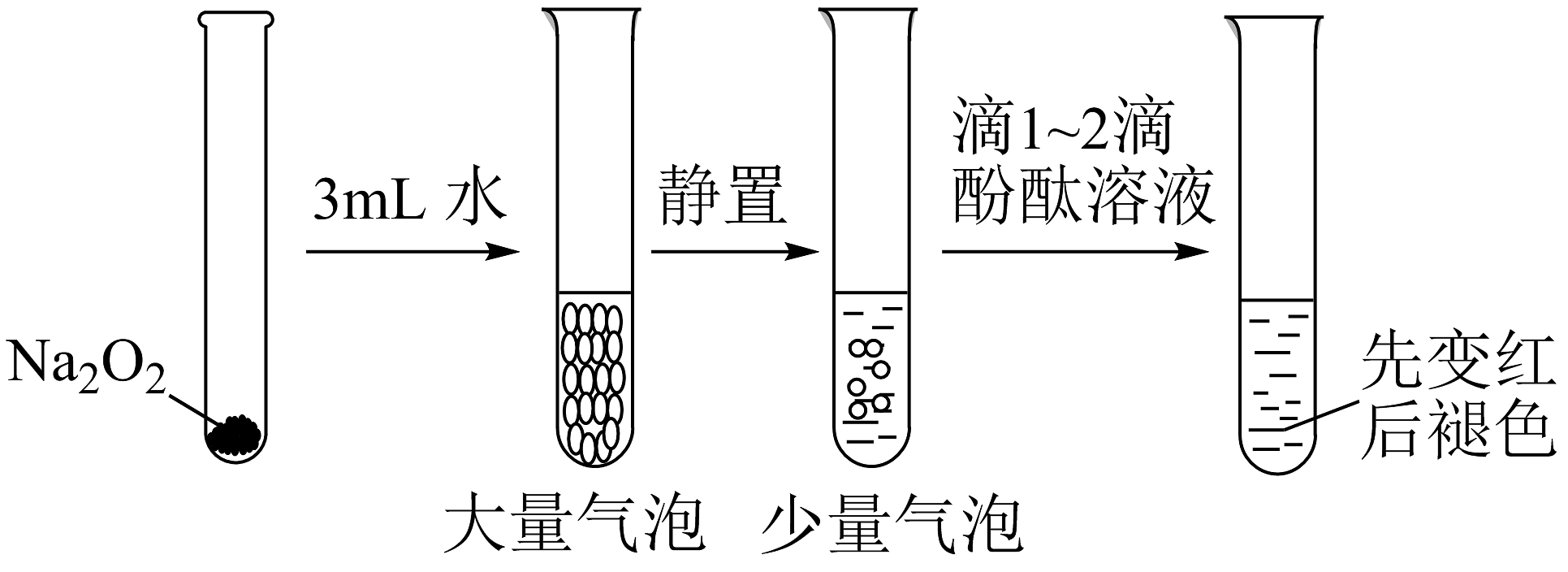
已知:①Na2O2与水反应经历了Na2O2+2H2O =2NaOH+H2O2;
②酚酞褪色原因与溶液的强碱性或强氧化性有关。
根据上述实验可以得出的结论是
A、双氧水能使酚酞褪色 B、浓氢氧化钠能使酚酞褪色 C、双氧水和浓氢氧化钠都能使酚酞褪色 D、可利用二氧化锰和水来完善实验方案 -
15、化学小组研究金属的电化学腐蚀,实验如下:
序号
实验Ⅰ
实验Ⅱ
实验


现象
铁钉周边出现_________色
锌片周边未见明显变化
铁钉周边出现蓝色
铜片周边略显红色
下列说法不正确的是
A、实验Ⅰ中铁钉周边出现红色 B、实验I中负极的电极反应式: C、实验Ⅱ中正极的电极反应式: D、对比实验I、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀 -
16、利用超分子可分离和 , 将、混合物加入一种空腔大小适配的“杯酚”中进行分离的流程如图。下列说法正确的是
 A、一个分子中含有90个键 B、“杯酚”与形成氢键 C、一个晶胞中含有8个分子 D、该分离过程利用的是超分子的自组装特征
A、一个分子中含有90个键 B、“杯酚”与形成氢键 C、一个晶胞中含有8个分子 D、该分离过程利用的是超分子的自组装特征 -
17、化学与生活、社会发展息息相关,下列化学知识解读不正确的是
选项
(劳动项目)
化学知识解读
A.
疫情期间常使用“84”消毒液进行消毒
“84”消毒液具有强氧化性
B.
焙制面包时使用碳酸氢钠
碳酸氢钠受热易分解
C.
用盐酸刻蚀鸡蛋壳制作艺术品
发生氧化还原反应
D.
使用明矾净水
胶体具有吸附性
A、A B、B C、C D、D -
18、在密闭容器中进行反应:X(g)+3Y(g)═2Z(g),有关下列图像的说法错误的是
 A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<0
A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<0 -
19、、、分别表示化学平衡常数、电离常数和水的离子积常数。下列说法正确的是A、达平衡后,改变某一条件时不变,的平衡转化率可能增大、减小或不变 B、在、条件下,在密闭容器中进行合成氨的反应,使用催化剂后增大 C、室温下 , 说明的酸性比的强 D、时,均为4的盐酸和醋酸溶液中不相等
-
20、在我国空间站的太空课堂中,航天员向水球内注入蓝色颜料后,将一颗泡腾片(由碳酸氢钠和有机酸组成的混合物)放进了水球内。水球“沸腾”了!无数气泡在其中产生,逐渐将水球充满,如图所示。下列说法正确的是
 A、泡腾片溶于水只发生物理变化 B、气泡的主要成分是酸性氧化物 C、泡腾片中的碳酸氢钠属于碱类 D、泡腾片溶于水发生分解反应
A、泡腾片溶于水只发生物理变化 B、气泡的主要成分是酸性氧化物 C、泡腾片中的碳酸氢钠属于碱类 D、泡腾片溶于水发生分解反应