-
1、双极膜(BP)是阴、阳复合膜,在直流电作用下,阴、阳膜复合层间的解离成和。利用双极膜电渗析法和惰性电极电解食盐水可获得淡水、NaOH溶液和盐酸,其工作原理如下图所示,M、N为离子交换膜。下列说法错误的是( )
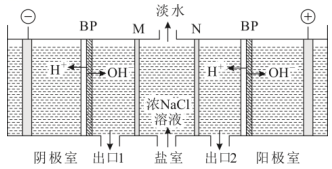 A、M膜为阳离子交换膜 B、出口2的产物是盐酸 C、若去掉双极膜(BP),阳极室会有生成 D、电路中每转移1mol电子,两极共得到0.5mol气体
A、M膜为阳离子交换膜 B、出口2的产物是盐酸 C、若去掉双极膜(BP),阳极室会有生成 D、电路中每转移1mol电子,两极共得到0.5mol气体 -
2、一种采用和为原料制备的装置示意图如下。
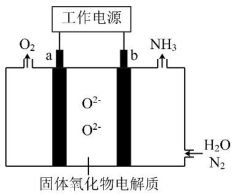
下列有关说法正确的是( )
A、在b电极上,被还原 B、金属Ag可作为a电极的材料 C、改变工作电源电压,反应速率不变 D、电解过程中,固体氧化物电解质中不断减少 -
3、中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金。下列关于这三个工业生产的描述中正确的是( )A、电解精炼铜时,负极反应式: B、氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气 C、在氯碱工业中,电解池中的阴极产生的是 , NaOH在阳极附近产生 D、电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
-
4、下列热化学方程式书写正确的是( )A、燃烧的热化学方程式: B、 C、一定条件下,与充分反应生成放热 , 其热化学方程式为: D、已知:与反应生成时,放出184.6kJ的热量,则有:
-
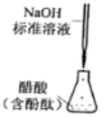
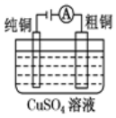
5、利用下列实验装置不能达到实验目的的是( )
选项
A
B
C
D
目的
探究生铁在不同条件下的电化学腐蚀
测定中和反应的反应热
测定醋酸溶液的浓度
铜的电解精炼
实验装置
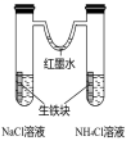
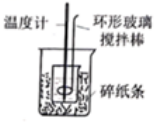
 A、A B、B C、C D、D
A、A B、B C、C D、D -
6、正丁烷催化裂解为乙烷和乙烯的反应历程如下(*代表催化剂):
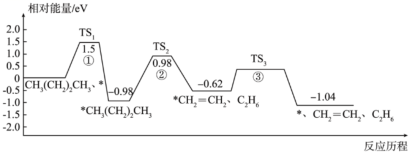
下列说法正确的是( )
A、使用催化剂能降低该反应的 B、过渡态、、中稳定性最强的是 C、正丁烷裂解生成乙烷和乙烯的反应为放热反应 D、正丁烷裂解生成乙烷和乙烯的决速步骤是反应① -
7、已知I容器恒压,II容器恒容,其它条件相同时,在I、II中分别加入3molZ,起始时容积相同,发生反应并达平衡.下列说法正确的是( )
 A、从起始到平衡所需时间: B、平衡后若在I中再加入2molZ,则新平衡时Z的体积分数变小 C、平衡时Z的转化率: D、平衡后若在I中再加入0.1molY,则X的物质的量将减少
A、从起始到平衡所需时间: B、平衡后若在I中再加入2molZ,则新平衡时Z的体积分数变小 C、平衡时Z的转化率: D、平衡后若在I中再加入0.1molY,则X的物质的量将减少 -
8、向体积均为1L的两个恒容密闭容器中分别充入2molX和1molY发生反应: , 其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示,下列说法正确的是( )
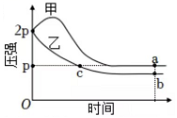 A、 B、气体总物质的量: C、a点平衡常数: D、反应速率:
A、 B、气体总物质的量: C、a点平衡常数: D、反应速率: -
9、对于可近反应: , 下列各图正确的是( )A、
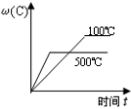 B、
B、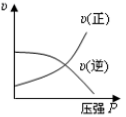 C、
C、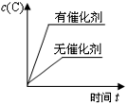 D、
D、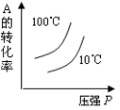
-
10、C和在生产、生活、科技中是非常重要的燃料。已知:① ②
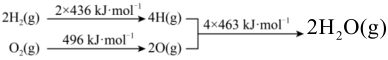
下列推断正确的是( )
A、C的燃烧热为 B、 , , 该反应是非自发反应 C、 D、将分解成和 , 至少需要提供的热量 -
11、羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在一定温度下的容积不变的密闭容器中发生反应:。下列叙述中,不能说明反应达到化学平衡状态的是( )A、的生成速率与的生成速率相等 B、单位时间内消耗amolCO,同时消耗 C、容器内气体的总压强不再变化 D、CO的浓度不再变化
-
12、在恒容密闭容器中,由CO合成甲醇的反应为 , 在其他条件不变的情况下,测得温度对反应的影响结果如图所示。下列有关说法错误的是( )
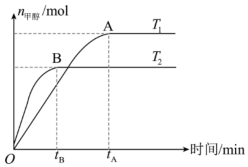 A、平衡时正反应速率: B、平衡常数: C、CO合成反应的 D、处于A点的反应体系从变到 , 达到平衡状态时减小
A、平衡时正反应速率: B、平衡常数: C、CO合成反应的 D、处于A点的反应体系从变到 , 达到平衡状态时减小 -
13、在恒容密闭容器中充入和发生如下反应: , 如图所示为该反应正反应的平衡常数和逆反应的平衡常数随温度变化的曲线。下列分析正确的是( )
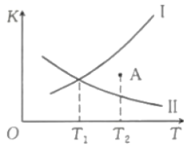 A、曲线I为 , 曲线II为 B、时,A点 C、时,的平衡转化率为40% D、其他条件不变,在原平衡基础上再充入和 , 达新平衡时转化率将减小
A、曲线I为 , 曲线II为 B、时,A点 C、时,的平衡转化率为40% D、其他条件不变,在原平衡基础上再充入和 , 达新平衡时转化率将减小 -
14、已知: 。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入 , 某时刻测得各组分的物质的量浓度如表。下列说法中正确的是( )
物质
0.08
1.6
1.6
A、此时刻反应未达到平衡状态 B、容器内压强不变,不能说明反应达平衡 C、平衡时,再加入与起始等量的 , 达新平衡后体积分数减小 D、平衡时,反应混合物的总能量降低50kJ -
15、在一密闭容器中,反应达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原平衡时的60%,则( )A、平衡向逆反应方向移动了 B、物质A的转化率减小了 C、物质B的质量分数增大了 D、
-
16、已知反应:其反应机理如下:①快 ②慢 下列有关该反应的说法正确的是( )A、该反应的速率主要取决于①的快慢 B、是该反应的催化剂 C、正反应的活化能比逆反应的活化能小akJ/mol D、增大的浓度能增大活化分子百分数,加快反应速率
-
17、一定条件下,在密闭恒容的容器中,发生反应:能表示该反应达到平衡状态的是( )A、 B、 C、混合气体密度保持不变 D、
-
18、化合物I是一种手性有机医药材料。实验室由芳香化合物A制备I的一种合成路线如下:
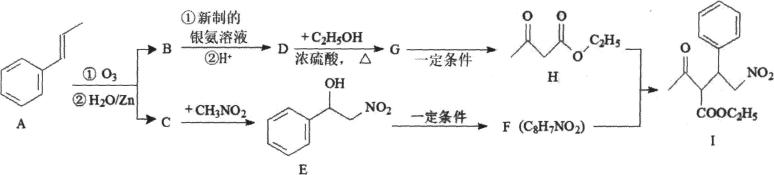
已知:
请回答下列问题:
(1)、C的结构简式为;H中官能团的名称为。(2)、由E生成F的反应类型为。(3)、写出G生成H的化学方程式。(4)、写出由H和F合成I的化学方程式。(5)、E有多种同分异构体,其中符合下列条件的同分异构体有种(不考虑立体异构),写出其中核磁共振氢谱显示有5种不同化学环境的氢,且峰面积之比为3:2:2:1:1的同分异构体的结构简式。①苯环上有两个取代基;
②能与饱和碳酸氢钠溶液反应放出CO2;
③能与FeCl3发生显色反应;
(6)、请利用题干中给出的信息反应①②,写出以 为原料制备化合物
为原料制备化合物 的合成路线,其他无机试剂任选。
的合成路线,其他无机试剂任选。 -
19、碱式氧化镍(NiOOH)为镍氢电池的正极材料。用含镍废渣(主要成分为NiO、Fe3O4。还含有少量的CuO、Cr2O3、SiO2等杂质)为主要原料制取NiOOH的工艺流程如图1所示。

已知:①部分金属硫化物的Ksp (25℃)为Ksp(FeS)=6.3×10-18、Ksp(CuS)=6.3×10-36。
②当溶液pH>12时,Cr(OH)3会转化为CrO2-。
回答下列问题:
(1)、Fe、Ni元素在周期表位于区。与Cr原子具有相同最外层电子排布的基态原子还有。(2)、“酸浸”后所得废渣的主要成分为(填“化学式”);除铜步骤的离子方程式为。(3)、“氧化”时,若用稀硝酸代替过氧化氢氧化Fe2+ , 从环保角度分析其(填“是合理的”或“是不合理的”),理由是。(4)、黄钠铁矾的化学式为NaFe3(SO4)2(OH)6 , 其属于(填“正盐”“酸式盐”或“碱式盐”)。“沉铁”时,加入Na2CO3溶液的目的是。(5)、“沉镍”时,加入NaOH溶液调节pH至13,滤液中的Cr2(SO4)3转化为NaCrO2 , 写出该反应的离子方程式。(6)、“灼烧”反应过程中氧化剂与还原剂的物质的量之比为。 -
20、三四氢呋喃合氯化铬[CrCl3(THF)3]是一种重要的有机反应的催化剂。某研究小组以Cr2O3(绿色固体)、CCl4、THF(四氢呋喃,液体)等物质为原料制备三四氢呋喃合氯化铬的装置如下图。
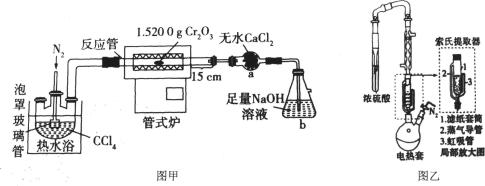
回答下列问题:
(1)、I.无水CrCl3(紫色固体,易升华)的制备装置如图甲所示(夹持装置略)。
仪器a的名称为。(2)、本实验持续通入N2的目的有赶走体系中原有的空气、。(3)、反应管的温度升到660℃时发生反应,生成CrCl3和COCl2(光气),其化学方程式为。(4)、 COCl2有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是(填化学式)。(5)、反应管右端有15cm在加热炉外,其作用是。(6)、II.CrCl3(THF)3的合成装置如图乙所示(搅拌和夹持装置略):
将制备的无水CrCl3和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为CrCl3+3THF CrCl3(THF)3 。
CrCl3(THF)3 。
实验时烧瓶中THF受热蒸发,蒸气沿“索氏提取器”导管2上升至球形冷凝管,冷凝后滴入滤纸套筒内与套筒内的固体物质接触并发生反应。当液面达到“索氏提取器”虹吸管3顶端时,经虹吸管3返回双颈烧瓶。从而实现了THF与CrCl3的连续反应及产物的连续萃取。
合成中加入Zn的目的是(用离子方程式表示)。(7)、 CrCl3和CrCl3(THF)3在THF中的溶解性分别为、(填“溶”或“不溶”)。(8)、合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品4.60 g。则该实验的产率为%(保留小数点后两位)。[已知:Cr2O3的摩尔质量为152 g/mol; CrCl3(THF)3的摩尔质量为374.5 g/mol]